肠内外免疫营养对重症急性胰腺炎大鼠机体免疫功能的影响
2021-12-30韩智君穆扎帕依米提迪米拉阿里根帕尔哈提阿不都热衣木
韩智君,穆扎帕·依米提,迪米拉·阿里根,帕尔哈提·阿不都热衣木
重症急性胰腺炎(Severe Acute Pancreatitis,SAP)是指胰酶在胰腺内被激活后引起胰腺组织自身消化的急性化学性炎症,具有起病迅急、病情重、并发症多、病死率高等特点[1]。近年来营养支持作为一种非手术治疗方法临床应用较多[2],常见的营养支持方法包括肠内营养支持[3](Enteral Mutrition,EN)和肠外营养支持(Parenteral Nutrition,PN)。肠外营养是临床常用的方法,刺激性小且符合SAP高代谢要求;肠内营养可刺激SAP患者肠黏膜细胞生长,促进肠道功能恢复,保持肠黏膜结构完整[4]。免疫营养是在普通营养基础上添加免疫营养素后可以针对炎性反应、营养不良、代谢异常、免疫失衡等方面改善患者的营养、代谢和免疫状态[5]。由此,本研究构建大鼠SAP模型,并给予适当的肠内、肠外免疫营养配方,对比肠内、肠外免疫营养治疗对SAP大鼠肠屏障的作用,并初步解析其机制。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 选取清洁级SD雄性大鼠,共48只,8~12 W,体重200~240 g,购自广东省医学实验动物中心,合格证号:SCXK(粤)2013-0002。将大鼠随机分为假手术组、模型组、普通肠内营养组、肠内免疫营养组、普通肠外营养组和肠外免疫营养组,每组8只。
1.1.2 实验主要试剂与仪器 内毒素试剂盒、FITCConjugated Mouse anti-Rat CD4 monoclonal antibody、PEConjugated Mouse anti-Rat CD8 monoclonal antibody、大鼠分泌型免疫球蛋白(SIgA)、白细胞介素10(IL-10)、白细胞介素6(IL-6)、ELISA检测试剂盒、流式细胞仪BD FACSCantoTMⅡ(Becton-Dickinson)、倒置荧光显微镜、低速离心机、实时荧光定量PCR仪、酶标仪。
1.2 建立动物模型、分组 根据参考文献[6]建立大鼠SAP模型。假手术组:切开腹腔后,不注射牛磺胆酸钠,轻翻胰腺后缝合切口。将建立模型的大鼠随机分为模型组、普通肠内营养组、肠内免疫营养组、普通肠外营养组和肠外免疫营养组。模型组大鼠腹腔注射生理盐水。普通肠内营养组:建模24 h内,经空肠匀速输入平衡液,建模24 h后,给予瑞素。肠内免疫营养组:在瑞素中加入谷氨酰胺(24.15 g/kg)、精氨酸(11.63 g/kg)和ω-3脂肪酸(3 g/kg)。普通肠外营养组:建模24 h内,经颈内静脉匀速输入平衡液,建模24 h后,给予每100 ml含7%凡命、20% 英脱利匹特、50%葡萄糖溶液、7 ml力肽、0.4 ml注射用水溶性维生素(Soluvit)、0.4 ml多种微量元素注射液(Ⅱ)(Addamel)和0.4 ml脂溶性维生素注射液(Ⅱ)(Vitalipid)以及22 ml平衡液。肠外免疫营养组:在普通肠外营养的基础上按1.5 ml/kg加入L-丙氨酰-L-谷氨酰胺(L-alanyl-L-glutamine, LALG)后立即输入。连续给药3 d。
1.3 酶联免疫吸附测定(Enzyme Linked Immunosorbent Assay,ELISA)检测各组大鼠小肠黏液SIgA含量及血浆IL-10、IL-6表达水平 处理结束后麻醉处死大鼠并采用腹主动脉取血5 ml,将血液置于肝素抗凝管中,2 500 r/min离心15 min,取血浆,采用ELISA检测各组大鼠血浆IL-10、IL-6的表达水平。剪取空回肠纵行剖开,用玻片刮取大鼠肠黏液,加入l ml浓度为0.01 mol/L的PBS缓冲液,30 000 r/min离心10 min,取上清,采用ELISA检测大鼠肠黏液SIgA含量。
1.4 HE染色检查胰腺组织病理学改变 麻醉处死大鼠取胰腺,用生理盐水冲洗,15%中性甲醛溶液固定、石蜡包埋、切片(4 μm),苏木素染色液染色3~10 min,光镜下观察胰腺组织的病理改变。
1.5 各组大鼠血浆内毒素检测 采用无热原肝素钠采血管采集腹主动脉血5 ml,2 500 r/min离心15 min,取血浆,按照内毒素试剂盒说明书进行。
1.6 流式细胞术检测外周血CD4+T、CD8+T、CD4+T/CD8+T淋巴细胞 在专用试管中加入大鼠外周血标本100 μl,分别加入异硫氰酸荧光素(Fluorescein Isothiocyanate,FITC)标记的CD4单克隆抗体和FITC标记的CD8单克隆抗体5 μl,然后充分混匀,室温下避光孵育15 min,然后每管加入红细胞裂解液2 ml充分混匀,室温避光下溶血10 min,1 500 r/min离心10 min,弃上清,PBS洗涤后采用流式细胞术进行检测。
1.7 实时荧光定量PCR检测各组大鼠occludin mRNA表达水平 取小肠组织约2 g,加入TRIZOL试剂后进行匀浆。逆转录成cDNA,取2 μl cDNA为模板,配制25 μl Realtime PCR反应体系,具体反应体系参照试剂盒说明书,95℃预变性15 min,95℃变性10 s,60℃退火延伸30 s,扩增40个循环。甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate Dehydrogenase,GAPDH) 为 内 参, 采 用2-△△Ct法 计 算。occludin引物为:上游5’-ACGGTGCCATAGAATGAGATGTTG-3',下 游5’-CAGCTAGTTGTTCATTTCTGCACCA-3';GAPDH引 物 为: 上 游5’-TCCCTCAAGATTGTCAGCAA-3’, 下 游5’-AGATCCACAACGGATACATT-3’。
1.8 统计学处理 采用SPSS 20.0统计软件进行数据分析,结果用表示,采用单因素方差分析对多样本实验结果进行统计分析,进一步两两比较采用最小显著性差异法(Least-Significant Difference,LSD-t)检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠小肠黏液SIgA含量及血浆IL-6、IL-10表达水平 与假手术组相比,模型组大鼠IL-6表达水平均显著升高而小肠黏液SIgA含量、IL-10表达水平降低(P<0.05);与模型组相比,各治疗组大鼠IL-6表达水平均降低而SIgA含量、IL-10表达水平升高(P均<0.05);与普通肠内营养组和普通肠外营养组相比,肠内免疫营养组和肠外免疫营养组IL-6表达水平均有不同程度降低而SIgA含量、IL-10表达水平均升高(P均<0.05);与肠外免疫营养组相比,肠内免疫营养组IL-6表达水平更低而SIgA含量、IL-10表达水平更高(P<0.05)。见表1。
表1 各组大鼠 SIgA含量及血浆IL-6、IL-10表达水平比较(±s,n=48)
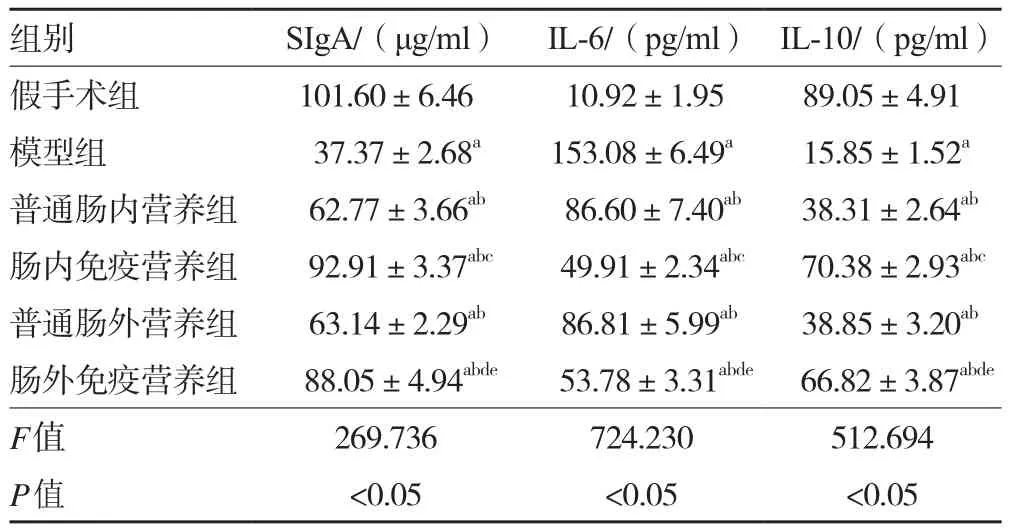
表1 各组大鼠 SIgA含量及血浆IL-6、IL-10表达水平比较(±s,n=48)
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与普通肠内营养组比较,cP<0.05;与普通肠外营养组比较,dP<0.05;与肠内免疫营养组比较,eP<0.05
组别 SIgA/(μg/ml) IL-6/(pg/ml) IL-10/(pg/ml)假手术组 101.60±6.46 10.92±1.95 89.05±4.91模型组 37.37±2.68a 153.08±6.49a 15.85±1.52a普通肠内营养组 62.77±3.66ab 86.60±7.40ab 38.31±2.64ab肠内免疫营养组 92.91±3.37abc 49.91±2.34abc 70.38±2.93abc普通肠外营养组 63.14±2.29ab 86.81±5.99ab 38.85±3.20ab肠外免疫营养组 88.05±4.94abde 53.78±3.31abde 66.82±3.87abde F值 269.736 724.230 512.694 P值 <0.05 <0.05 <0.05
2.2 各组大鼠胰腺组织病理形态学变化 假手术组大鼠胰腺细胞结构正常,包膜完整。模型组大鼠出现广泛凝固性坏死,间质水肿明显,大量单核和中性粒细胞浸润。普通肠内营养组和普通肠外营养组大鼠胰腺组织结构与模型组相比,较完整,坏死组织较少,中性粒细胞浸润减少,病变程度相对减轻;肠内免疫营养组和肠外免疫营养组大鼠胰腺组织结构较普通肠内营养组和普通肠外营养组完整,坏死组织减少,中性粒细胞浸润减少,且肠内免疫营养组大鼠胰腺组织结构较肠外免疫营养组大鼠更完整。见图1。
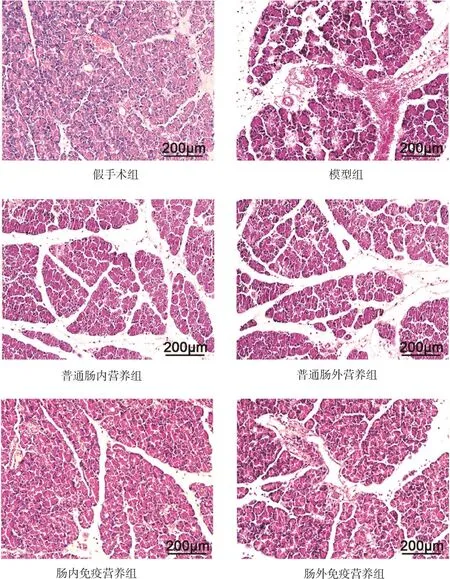
图1 各组大鼠胰腺组织病理形态学变化(HE染色,×100)
2.3 各组大鼠血浆内毒素含量 与假手术组相比,模型组大鼠血浆内毒素含量显著升高(P<0.05);与模型组相比,各治疗组大鼠内毒素含量均降低(P均<0.05);与普通肠内营养组和普通肠外营养组相比,肠内免疫营养组和肠外免疫营养组内毒素含量均有不同程度降低(P均<0.05)。见表2。
表2 各组大鼠血浆内毒素含量(±s,n=48)
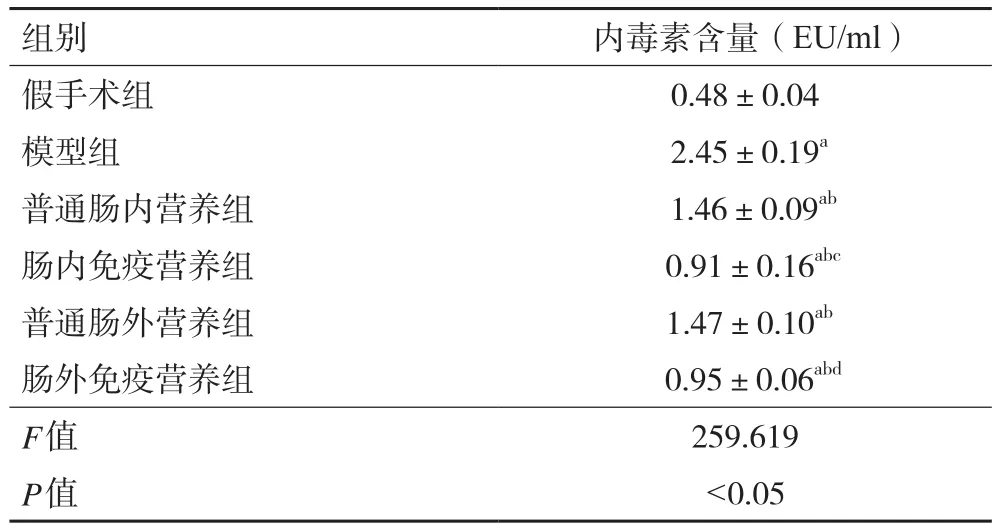
表2 各组大鼠血浆内毒素含量(±s,n=48)
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与普通肠内营养组比较,cP<0.05;与普通肠外营养组比较,dP<0.05
组别 内毒素含量(EU/ml)假手术组 0.48±0.04模型组 2.45±0.19a普通肠内营养组 1.46±0.09ab肠内免疫营养组 0.91±0.16abc普通肠外营养组 1.47±0.10ab肠外免疫营养组 0.95±0.06abd F值 259.619 P值 <0.05
2.4 各组大鼠外周血CD4+T、CD8+T、CD4+T/CD8+T淋巴细胞 与假手术组相比,模型组大鼠外周血CD4+T、CD4+T/CD8+T淋巴细胞均显著降低(P<0.05);与模型组相比,各治疗组大鼠CD4+T、CD4+T/CD8+T淋巴细胞均升高(P均<0.05);与普通肠内营养组和普通肠外营养组相比,肠内免疫营养组和肠外免疫营养组CD4+T、CD4+T/CD8+T淋巴细胞均有不同程度升高(P均<0.05);而各组CD8+T淋巴细胞差异无统计学意义(P>0.05)。见表3、图2。
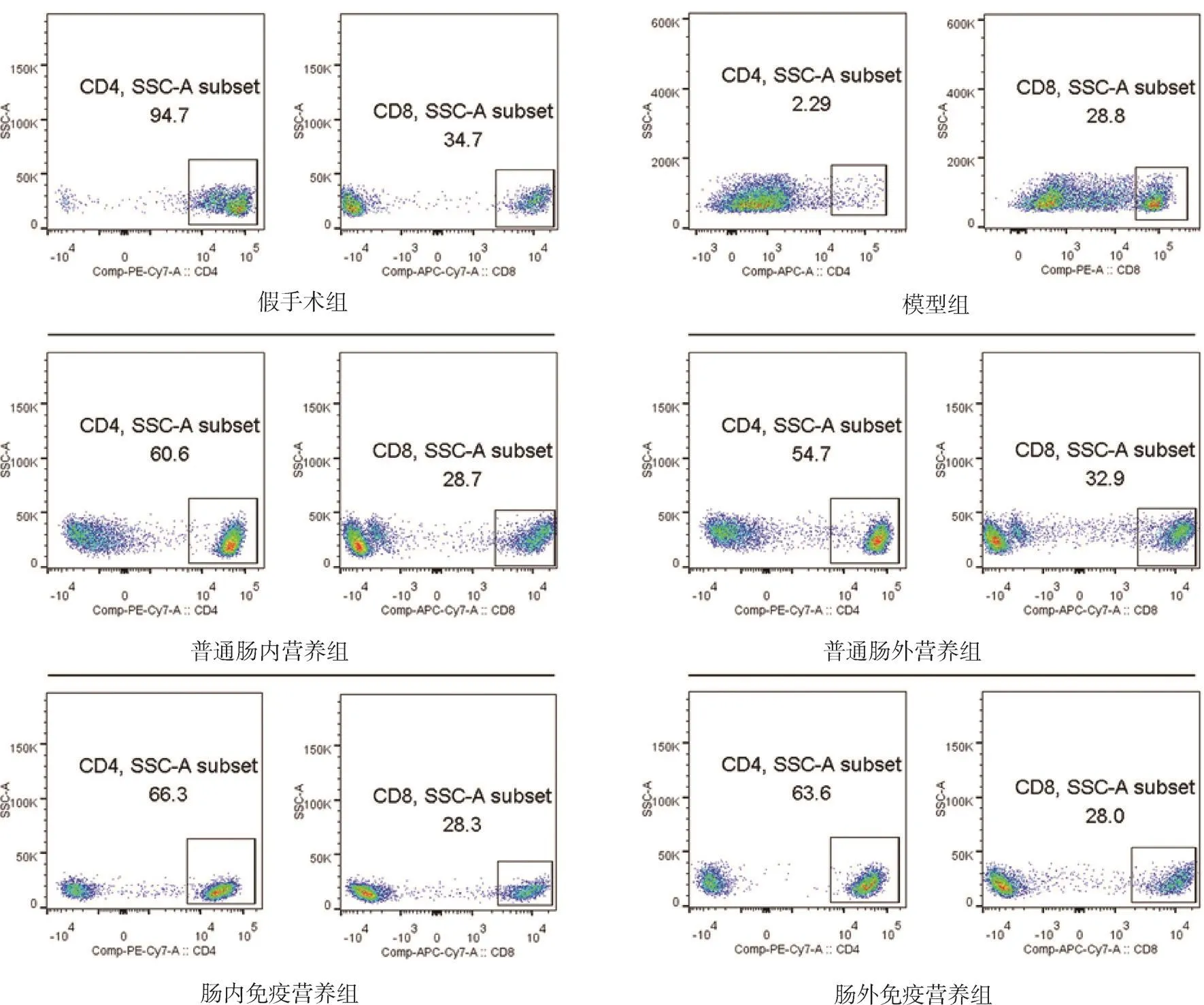
图2 各组大鼠外周血CD4+T、CD8+T淋巴细胞
表3 各组大鼠外周血CD4+T、CD8+T、CD4+T/CD8+T淋巴细胞比较(±s,n=48)
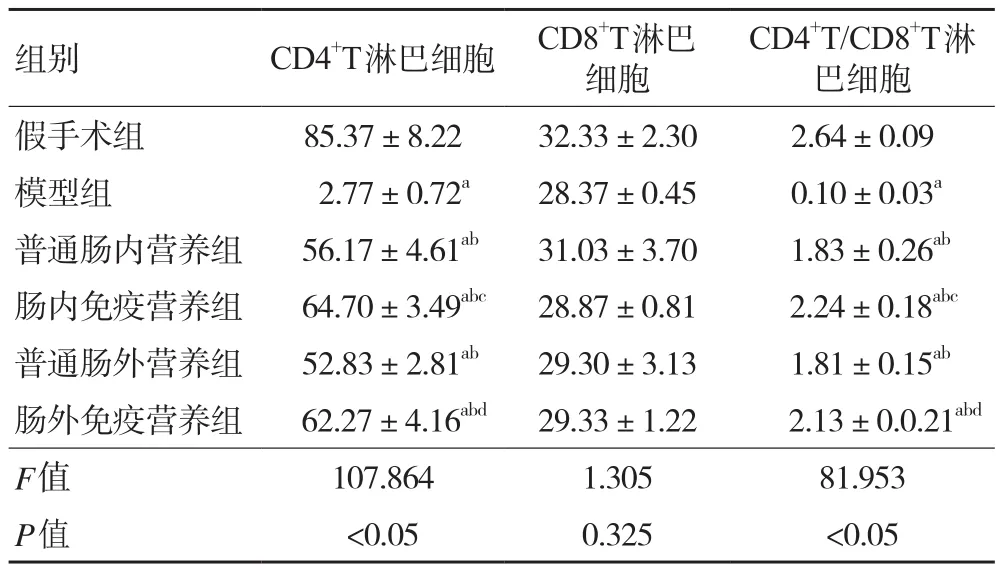
表3 各组大鼠外周血CD4+T、CD8+T、CD4+T/CD8+T淋巴细胞比较(±s,n=48)
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与普通肠内营养组比较,cP<0.05;与普通肠外营养组比较,dP<0.05
组别 CD4+T淋巴细胞 CD8+T淋巴细胞CD4+T/CD8+T淋巴细胞假手术组 85.37±8.22 32.33±2.30 2.64±0.09模型组 2.77±0.72a 28.37±0.45 0.10±0.03a普通肠内营养组 56.17±4.61ab 31.03±3.70 1.83±0.26ab肠内免疫营养组 64.70±3.49abc 28.87±0.81 2.24±0.18abc普通肠外营养组 52.83±2.81ab 29.30±3.13 1.81±0.15ab肠外免疫营养组 62.27±4.16abd 29.33±1.22 2.13±0.0.21abd F值 107.864 1.305 81.953 P值 <0.05 0.325 <0.05
2.5 各组大鼠小肠粘黏膜occludin mRNA表达水平 与假手术组相比,模型组大鼠小肠黏膜occludin mRNA表达水平显著降低(P<0.05);与模型组相比,各治疗组大鼠occludin mRNA表达水平升高(P<0.05);与普通肠内营养组和普通肠外营养组相比,肠内免疫营养组和肠外免疫营养组occludin mRNA表达水平均有不同程度升高(P<0.05)。见表4。
表4 各组大鼠小肠粘膜occludin mRNA半定量表达水平(±s,n=48)
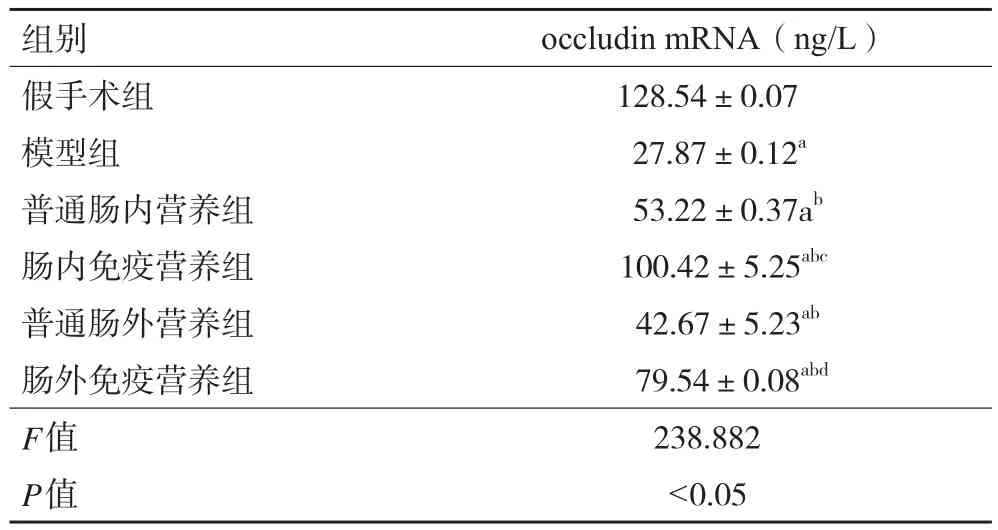
表4 各组大鼠小肠粘膜occludin mRNA半定量表达水平(±s,n=48)
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与普通肠内营养组比较,cP<0.05;与普通肠外营养组比较,dP<0.05
组别 occludin mRNA(ng/L)假手术组 128.54±0.07模型组 27.87±0.12a普通肠内营养组 53.22±0.37ab肠内免疫营养组 100.42±5.25abc普通肠外营养组 42.67±5.23ab肠外免疫营养组 79.54±0.08abd F值 238.882 P值 <0.05
3 讨 论
肠道是机体最大的细菌存储所和内毒素中心,SAP在急性反应期免疫过激,会引起肠屏障的损伤,导致大量肠源性内毒素释放入血并激活体内炎症因子,从而促进全身炎症反应引起多器官衰竭,免疫异常在SAP病情的发展中起重要作用[7-8]。有研究表明,肠屏障功能的损伤所引发内毒素及细菌移位被认为是胰腺继发感染的重要原因[9]。肠道免疫屏障主要依靠肠黏膜表面黏液及肠腔中的免疫球蛋白(以SIgA为主)和淋巴细胞,共同完成肠道的局部免疫防御功能[10]。有研究发现,SAP大鼠肠黏膜组织中产生了严重的病理损伤,血清和肠组织中炎症因子水平升高提示系统性及肠道出现局部炎症环境[11]。另有研究发现,在SAP发生进展中,由于循环血液中肠源性内毒素水平升高,导致NF-κB、IL-1β、IL-6、IL-8等多种细胞炎性因子分泌增加[12-13]。本研究建立SAP大鼠模型,结果发现与假手术组相比,模型组大鼠血浆内毒素含量、IL-6表达水平均显著升高而小肠黏液SIgA含量、IL-10表达水平降低;光镜结果显示与假手术组相比,模型组大鼠出现广泛凝固性坏死,间质水肿明显,大量单核和中性粒细胞浸润。此外,流式细胞术结果发现,模型组大鼠外周血CD4+T、CD4+T/CD8+T淋巴细胞均显著降低。提示SAP大鼠模型建立成功,大鼠免疫功能被破坏,体内炎症水平及内毒素升高,导致肠组织损伤,促进SAP发展。
紧密连接蛋白是肠黏膜机械屏障重要组成部分,occludin作为肠上皮重要的紧密连接蛋白,主要参与肠壁通透性的调节,对于维护黏膜屏障的完整性有非常重要的意义[14-15]。有研究发现,occludin蛋白表达的变化是引起细菌移位、维持肠黏膜屏障功能的关键[16]。本研究结果发现,与假手术相比,模型组大鼠小肠黏膜occludin mRNA表达水平显著降低;与模型组相比,各治疗组occludin mRNA表达水平明显升高。提示SAP大鼠小肠黏膜occludin表达降低会导致肠道通透性增高,从而导致内毒素等从肠腔中进入血液。
目前临床对于SAP的治疗主要采取营养支持治疗作为重要的辅助手段。有研究发现,将肠内免疫微生态营养应用于重症急性胰腺炎,有利于维持抗炎反应的平衡,实现对病情及预后的改善[17]。另有研究表明,谷氨酰胺增强的肠外营养能显著改善SAP大鼠机体免疫、降低血浆内毒素,有利于细胞与器官功能的恢复[18]。本研究采用肠外免疫营养和肠内免疫营养进行治疗并进行比较,以分析肠外和肠内营养对SAP大鼠肠组织免疫功能的影响。结果发现,与普通肠内营养组和普通肠外营养组相比,肠内免疫营养组和肠外免疫营养组内毒素含量、IL-6表达水平均有不同程度降低而SIgA含量、IL-10表达水平、CD4+T、CD4+T/CD8+T淋巴细胞及occludin mRNA表达均升高;与肠外免疫营养组相比,肠内免疫营养组大鼠各项指标改善更为显著。提示肠内外免疫营养支持均可显著改善SAP。
综上所述,SAP大鼠小肠黏膜occludin表达降低导致内毒素等从肠腔中进入血液,破坏大鼠免疫功能,体内炎症水平升高,导致肠组织损伤;肠内外免疫营养支持均可显著改善SAP,但肠内免疫营养支持在提升SAP大鼠免疫机能和改善免疫状态方面效果优于肠外营养。
