地克珠利在鸡蛋中的残留消除规律研究
2021-12-30霍美霞侯旖璇刘海燕黄玲利
霍美霞,孙 磊,侯旖璇,刘海燕,王 磊,黄玲利
(国家兽药残留基准实验室(华中农业大学),农业农村部食品兽药残留检测重点实验室(华中农业大学),农业农村部畜禽产品质量安全风险评估实验室(武汉),华中农业大学动物医学院,武汉 430070)
地克珠利(Diclazuril,DIC)是三嗪类新型广谱抗球虫药,其化学名为氯嗪苯乙腈,在低剂量时能有效控制鸡盲肠球虫,破坏球虫卵囊,在家禽养殖中广泛使用[1]。DIC对鸡常见球虫类型均有良好的效果,如柔嫩、堆型、毒害、布氏、巨型、和缓艾美耳球虫,抗球虫作用因球虫种属不同略有差异[2]。研究结果表明,其抗球虫效果优于莫能菌素、氨丙啉、尼卡巴嗪等抗球虫药,具有高效低毒的特点,是目前混饲浓度最低的一种抗球虫药[3]。抗球虫药物的大量使用可能导致药物原形或代谢产物蓄积于可食性动物产品(组织、牛奶、鸡蛋等)中,从而进入到食物链中威胁人类健康。鸡蛋是生活中常见的高营养食物之一,我国每年生产并消费世界40%左右的鸡蛋,人均鸡蛋消费量约为世界水平的2倍[4]。在蛋鸡产蛋期使用禁用药物,未严格遵守休药期和垫料或饮水中的药物暴露,均会导致鸡蛋中药物残留,造成食品安全的潜在风险[5]。已有文献报道DIC在鸡蛋中存在残留的发生[6]。DIC临床使用剂量用少,连续用药后在鸡体内消除慢,仅含有5%的残留物也需要长达15 d的时间才能成为无残留的鸡蛋[7]。农业农村部在《食品安全国家 食品中兽药最大残留限量》(GB31650-2019)中规定,家禽产蛋期禁用DIC[8]。然而,临床实际应用过程中因未及时观察给药时间,垫料、饲料及水源的交叉感染等原因都可能会导致鸡蛋中的DIC残留发生。由于DIC是批准用于蛋鸡养殖的药物,只是禁止用于产蛋期。其食品安全风险远低于禁用药,如果以零检出判定蛋产品的安全性过于严苛,对蛋鸡养殖会造成困扰。本试验拟建立超高效液相色谱-串联质谱法(UPLC-MS/MS)检测鸡蛋中地克珠利含量的方法,通过研究地克珠利在鸡蛋中的残留消除情况,结合国际食品安全性评价规范,初步确定DIC在鸡蛋中的最大残留限量,并提出弃蛋期,为地克珠利在蛋鸡生产上的安全应用提供科学依据。
1 材料与方法
1.1 主要材料 地克珠利标准品(生产批号101831-37-2,含量99.8%),购自中国兽医药品监察所;地克珠利溶液(批准文号:兽药字190752045,含量0.5%),购自广东万士达动物药业有限公司;色谱纯甲醇和乙腈购自西班牙Scharlau公司;分析纯甲醇和乙腈购自国药集团化学试剂有限公司。
1.2 主要仪器 Waters Acquity超高效液相色谱仪,配备Waters Quattro Premier XE质谱分析仪。Avanti J-25型高速冷冻离心机,购自日本日立公司。JQ-3200型超声波清洗器,购自昆山市超声仪器有限公司。MILLIPORE IQ 7000型超纯水仪,购自贝莱美生物科技有限公司。XW-80A微型涡旋混合仪,购自上海沪西分析仪器厂有限公司。微量移液器,200 μL/ 1 mL/ 5 mL,购自Eppendorf Research plus。PL203分析天平(Max=210 g,d=0.001 g),购自梅特勒-托利多仪器(上海)有限公司。SQP电子天平(Min=10 mg,Max=220 g,d=0.1 mg),购自赛多利斯科学仪器(北京)有限公司。
1.3 试验动物及分组 选取体重约1.7 kg的30只健康高产白羽蛋鸡,随机分为空白组(5只)和给药组(25只),给予无抗菌饲料以及随意饮水,环境温度保持在25 ℃左右。每天监测母鸡生理状况,适应环境1周。
1.4 给药与采样 0.5%地克珠利溶液用饮用水稀释成1 mg/L,给药组经饮水给药连续给药12 d,空白对照组给予等量饮用水。自给药当天,每天收集鸡蛋直至停药后25 d。给药组每天至少收集20枚鸡蛋,空白对照组收集鸡蛋样本作为空白对照,所有样品均质后保存在-20 ℃冰箱中直至分析。
1.5 样品处理 分别称取均质蛋清、蛋黄和全蛋鸡蛋样品1 g (精确到0.01 g)于10 mL 离心管中,精密加入乙腈溶液2.5 mL,涡旋3 min,超声10 min,4500 r/min离心10 min,再用同样的方法重新提取一次,将两次提取的上清液合并后移至50 mL离心管中,加入5 mL正己烷去脂,取上清液备用。
净化:OASIS PRiME HLB固相萃取柱(6cc,200 mg)无需活化,1 mL 80%乙腈水预洗后,取上述提取上清液2.5 mL,将其过柱,取1 mL滤液经 0.22 μm微孔滤膜过滤后,用UPLC-MS/MS测定。
1.6 样品分析
1.6.1 色谱条件 色谱柱:Waters ACQUITY UPLC BEH C18 Column(2.1×50 mm, 1.7 μm);流动相:A相为乙腈;B相为超纯水溶液;流速:0.2 mL/min;进样量:5 μL。梯度洗脱程序见表1。

表1 梯度洗脱程序表Tab 1 Gradient elution schedule
1.6.2 质谱条件 采用ESI离子源,负离子(ESI-)模式扫描,多离子反应监测(MRM)模式测定,质谱参数如表2所示。

表2 地克珠利物质谱检测的特征离子参数Tab 2 Characteristic ion parameters of diclazuril mass spectrometry
1.6.3 基质标准工作曲线 分别取空白全蛋样品、蛋清及蛋黄样品1 g加入适量地克珠利标准溶液,使样品中药物终浓度为1、10、100、200、500 μg/kg,经样品前处理之后,进行UPLC-MS/MS测定,以特征离子质量色谱峰面积为纵坐标,标准溶液浓度为横坐标,绘制基质标准工作曲线。
1.6.4 精密度和准确度 分别取空白全蛋样品、蛋清及蛋黄样品1 g加入适量地克珠利标准溶液,使样品中药物终浓度为2.5、10、50 μg/kg,经样品前处理之后,进行UPLC-MS/MS测定,计算回收率。基质添加样品分为5批,连续3 d测定计算日内和日间变异系数。回收率计算公式(1)如下:
(1)
式中,X:试样中待测物回收率;A:试样峰面积;As:标准工作液峰面积;W:试样体积(mL);V:待测提取液的总体积(mL)。
1.6.5 灵敏度 本试验方法的灵敏度包括检测限(Limit of detection,LOD)和定量限(Limit of quantification,LOQ)。LOD是指样品中能够检测到的被测物的最低含量,LOQ是指样品中被测物能被定量测定的最低量,其测定结果应具有一定的准确度与精密度。将低浓度的标准工作液进行稀释,添加到各个空白组织中,经样品前处理之后,过0.22 μm滤膜进行上机检测。以信噪比(S/N≥3)时的待测物浓度定义为LOD;以信噪比(S/N≥10)时待测物的浓度定义为LOQ。
1.6.6 稳定性 分别取空白全蛋样品、蛋清及蛋黄样品1 g加入适量地克珠利标准溶液,使样品中药物终浓度为2.5、10、50 μg/kg,每个浓度设置5个重复,经样品前处理之后分别于4 ℃条件下放置24 h,-20 ℃冰箱冷冻放置24 h,-20 ℃反复冻融3次,进行UPLC-MS/MS测定,计算峰面积和RSD值。
1.7 数据处理
1.7.1 消除动力学参数计算 将蛋清、蛋黄和全蛋中测得的地克珠利的色谱峰面积代入基质标准工作曲线,得到地克珠利在鸡蛋中的残留量。将三种鸡蛋样品中各时间点的地克珠利含量进行对数转换,将对数转换后药物浓度与时间做回归分析,进行残留曲线拟合,根据回归方程lnC=lnC0-kt(C:任一时间点药物浓度,C0:初始浓度,k:消除速率常数),计算地克珠利在三种鸡蛋样品中的消除方程C=C0ekt和消除半衰期t1/2(t1/2=0.693/k)。
1.7.2 最大残留限量和弃蛋期 根据地克珠利预期用途和在适用的食用组织的食物消耗值中进行ADI值的分配,计算地克珠利在鸡蛋中的ADI值和初步理论限量值。根据鸡蛋中地克珠利的初步理论限量值,代入公式(2)中计算鸡蛋中安全浓度(Safe Concentration, SC)。

将安全浓度的值代入公式(3)计算最大残留限量。
MRLe=SCe×Rm×Re
(3)
式中,MRLe指蛋中最高残留限量(μg/kg);SCe指蛋中安全浓度(μg/kg);Rm指残留标示物与总残留的比例(%);Re指定量分析方法回收率(%)。
地克珠利在蛋黄、蛋清及全蛋样品的残留消耗速率不完全相同,参照鸡蛋中地克珠利的临时MRL,采用WT1.4软件,以95%的可信限为标准,DIC在对三种鸡蛋样品中残留量进行线性回归分析。样品中DIC浓度高于MRL的时间段为弃蛋期。
2 结果与分析
2.1 最低检测限与最低定量限 依据3倍信噪比确定检测限,地克珠利在鸡蛋全蛋样品,蛋清样品及蛋黄样品的检测限均为0.5 μg/kg;依据10倍信噪比确定检测限,地克珠利在鸡蛋全蛋样品,蛋清样品及蛋黄样品的定量限均为2.5 μg/kg。结果表明,该方法灵敏度高,满足地克珠利在蛋清、蛋黄和全蛋中残留检测的需要。
2.2 特异性和专一性 空白的鸡蛋全蛋样品、蛋清样品和蛋黄样品添加2.5 μg/kg(定量限浓度)的地克珠利标准品溶液,按照已建立好的样品前处理方法处理后上样检测,如图1所示:DIC在2.3 min处出峰,且附近无杂峰出现,显示出该方法的特异性良好,符合定量方法学考核要求。地克珠利的标准曲线及在鸡蛋全蛋样品基质、蛋黄基质、蛋清基质线性回归方程及相关系数见表3,相关系数r>0.998,线性良好。

(a:空白蛋清;b:空白蛋黄;c:空白全蛋;d:蛋清加标;e:蛋黄加标;f:全蛋加标)(a: Blank egg white; b: Blank yolk; C: Blank whole egg; D: Egg white added DIC; E: Egg yolk added DIC; F: Egg added DIC)图1 地克珠利在蛋清、蛋黄和全蛋中的色谱图Fig 1 Chromatogram of diclazuril in egg white, egg yolk and egg
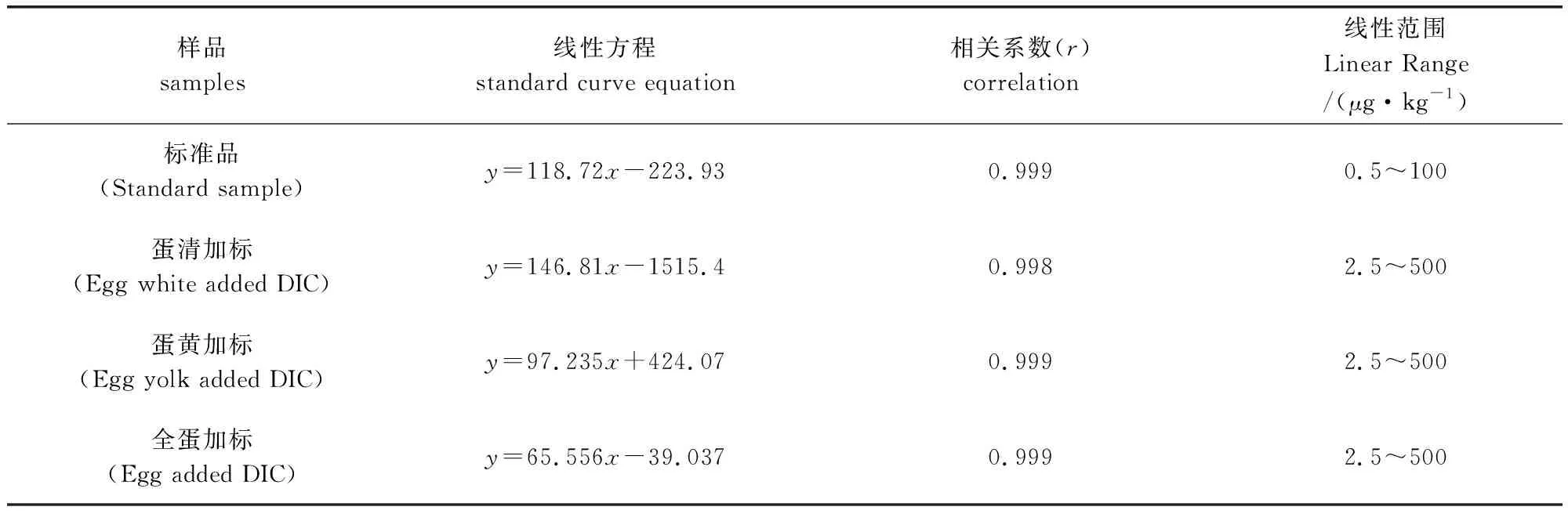
表3 地克珠利标准曲线方程及相关系数Tab 3 The standard curve equation and correlation coefficient of diclazuril
2.3 准确度和精密度 方法的准确度用回收率表示,精密度用日内间变异系数表示,结果如表4所示:本方法在2.5~50 μg/kg添加浓度水平上的鸡蛋样品的平均回收率为75.90%~90.38%,地克珠利在全蛋样品、蛋清样品及蛋黄样品的日内变异系数分别为:3.23%~5.88%、4.12%~8.26%、7.20%~8.14%,日间变异系数分别为:4.00%~7.11%、4.62%~8.21%、7.01%~7.74%。本试验所建立的地克珠利在鸡蛋样品中的残留检测方法符合方法学考核要求,可用于地克珠利在鸡蛋(全蛋、蛋清、蛋黄)中的残留消除研究。
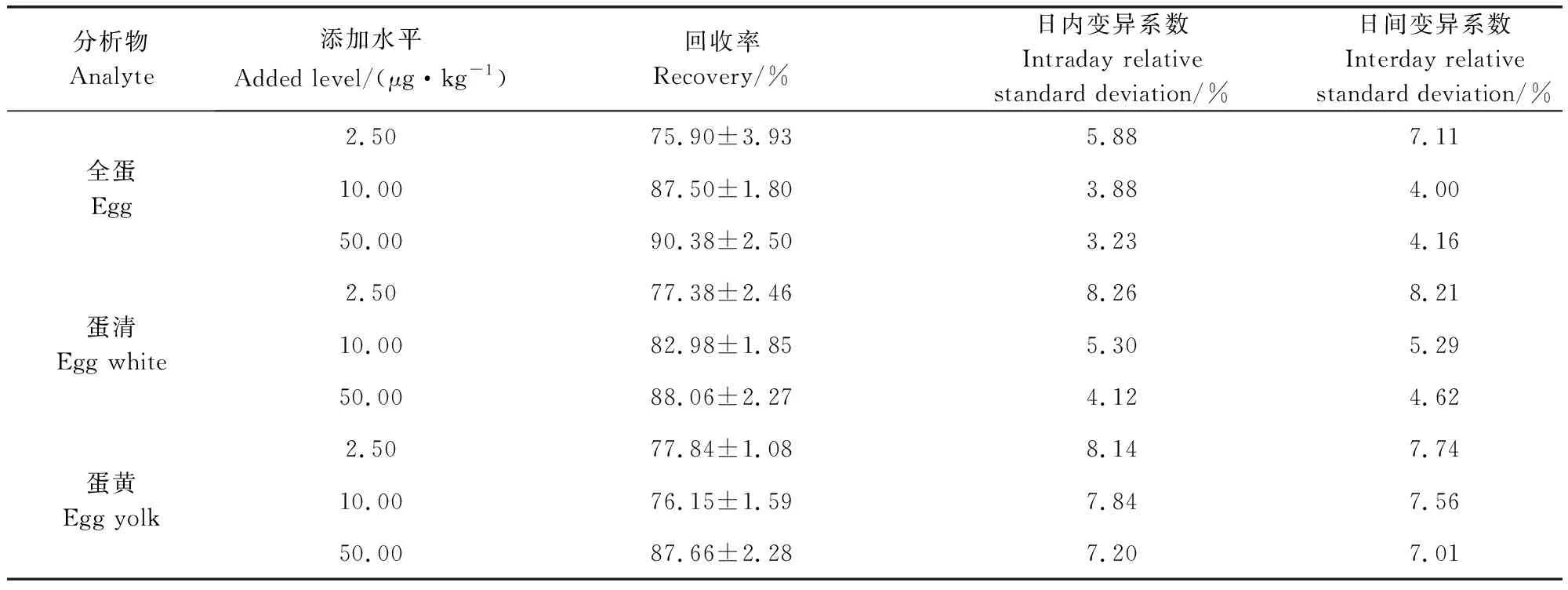
表4 地克珠利在全蛋、蛋清和蛋黄中的回收率和精密度Tab 4 Recovery and precision of diclazuril in whole egg, egg white and yolk
2.4 稳定性 地克珠利标准溶液和在空白的全蛋样品、蛋清样品、蛋黄样品添加2.5,10,50 μg/kg三个浓度水平的样品的稳定性如表5所示,在4 ℃条件下放置24 h,-20 ℃冰箱冷冻放置24 h,-20 ℃反复冻融3次的条件下,经检测地克珠利标准溶液样品间的RSD值小于6.91%,蛋清加标样品间的RSD值小于7.36%,蛋黄加标样品间的RSD值小于6.36%,全蛋加标样品间的RSD值小于8.11%。结果表明,地克珠利标准溶液、蛋清加标样品、蛋黄加标样品和全蛋加标样品的稳定性良好。

表5 地克珠利标准溶液和样品稳定性Tab 5 Diclazuril standard solutions and stability of samples
2.5 地克珠利在鸡蛋中的残留消除特征 蛋鸡连续12 d给药后,在12 d时全蛋样品的最高浓度,浓度为229.54±1.09 μg/kg;停药后3 d时,观察到DIC浓度下降为164.85±3.61 μg/kg。停药14 d时,DIC残留浓度降低至一个较低的水平(16.11±0.57 μg/kg),停药21 d后检测不到DIC存在,全蛋中消除半衰期为T1/2为1.78 d;蛋清中DIC的分布相对于蛋黄较低,12 d时残留浓度最高,为88.12±2.79 μg/kg,停药10 d时降至较低的残留水平(12.53±0.38 μg/kg),消除半衰期为T1/2为6.93 d,第14天时蛋清样品中检测不到DIC存在;监测到蛋黄的最高残留浓度为311.02±4.46 μg/kg(给药后第12天),残留消除过程较为缓慢,消除半衰期为T1/2为2.57 d,第14天时降至较低的浓度(26.04±2.45 μg/kg),第21天后检测不到DIC(表6)。
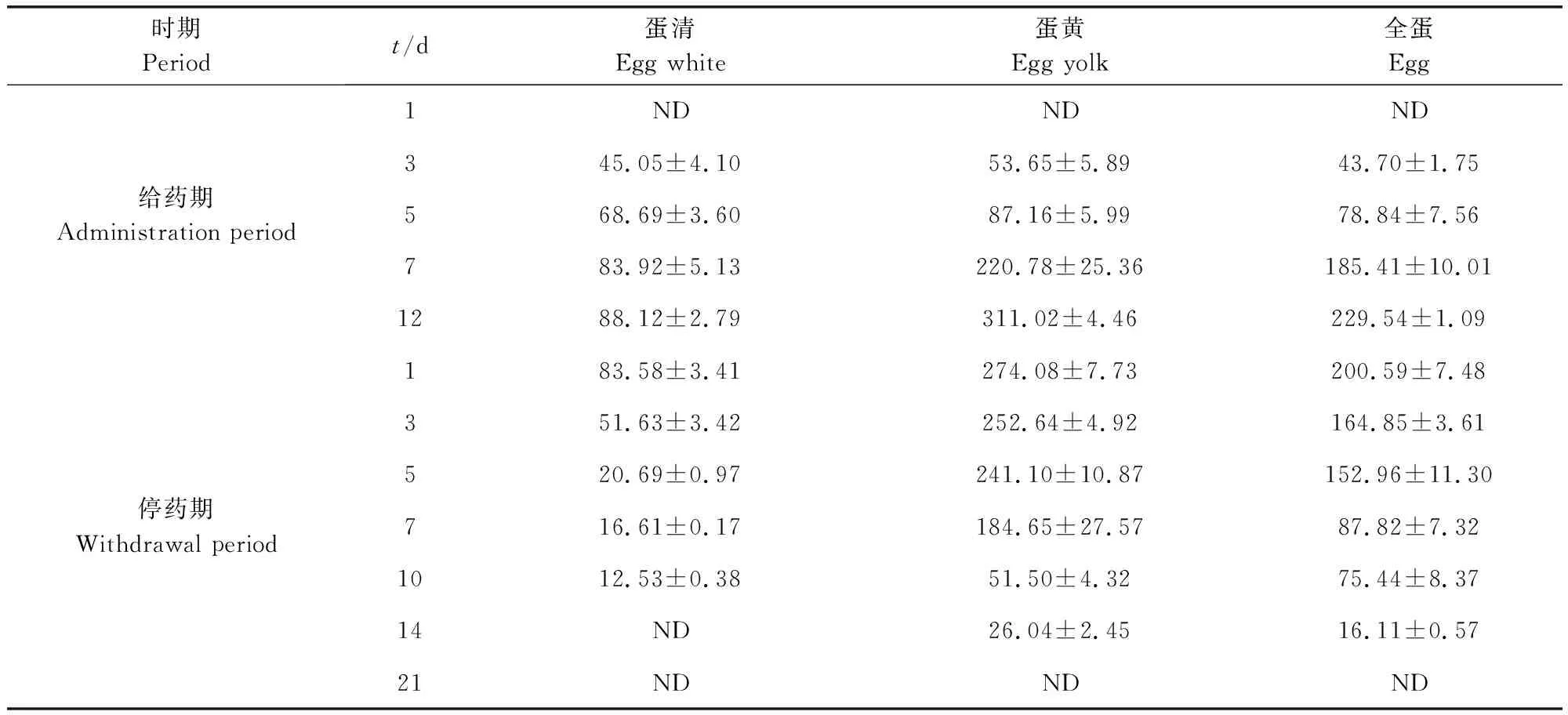
表6 鸡蛋样品中地克珠利残留量(n=10)(μg/kg)Tab 6 Diclazuril residue in egg samples(n=10)(μg/kg)
DIC在蛋清、蛋黄和全蛋样品中的消除参数及消除曲线如表7和图2所示。

表7 鸡蛋中地克珠利的消除参数Tab 7 Elimination parameters of diclazuril in eggs

图2 地克珠利在鸡蛋中的消除曲线Fig 2 The elimination curve of diclazuril in eggs
2.6 最大残留限量和弃蛋期推算
2.6.1 ADI值的确定和分配 GB 31650-2019中规定地克珠利的ADI值为0.03 mg/kg.bw。ADI的分配根据药物预期用途和每个组织的食物消耗值在适用的食用组织中进行划分。
WHO推荐的食物消费系如下:一个60 kg体重的人,一天动物性食物消费量:哺乳动物或禽肉500 g(其中:肌肉300 g,肝脏100 g,肾脏50 g,脂肪50 g);或者鱼肉300 g。另加奶 1500 g,鸡蛋100 g,蜂蜜50 g。将ADI值(100%)按比例分配到各种食品动物的可食性组织中。
根据药物批准使用的动物不同,应将ADI值在不同组织中分配:如果药物批准用于肉牛、猪、肉禽,则只考虑分配至肌肉+脂肪+肝+肾中;如果药物还批准用于奶牛和/或奶羊,则还要考虑分配到奶中,即肌肉+脂肪+肝+肾+奶;如果药物还批准用于蛋禽,则还要分配到蛋中,即肌肉+脂肪+肝+肾+蛋;如果药物还批准用于蜜蜂,则还要分配到蜂蜜中,即肌肉+脂肪+肝+肾+蜂蜜;如果药物同时批准涉及以上所有的动物,则应将全部ADI值分配到所涉及的上述组织和产品中,即肌肉+脂肪+肝+肾+奶+蛋+蜂蜜。
每种可食性组织中ADI的分配比例原则上等于该组织的推荐消耗量与批准动物的推荐可食性组织总量的比值,也可根据具体情况酌情分配。地克珠利ADI值为30 μg/kg体重,并且批准使用于畜禽,因此,ADI的分配值考虑畜禽肌肉300 g、肝脏100 g、肾脏50 g、脂肪50 g和鸡蛋100 g。据此,分配给鸡蛋的ADI值应为根据药物的ADI值与食物分配系数,计算出地克珠利在鸡蛋中的初步理论限量值:
2.6.2 安全浓度计算 安全浓度(Safe Concentration, SC)是指食品动物用药后,动物性产品任何可食用部分允许人终生每日摄入且不超过ADI的药物总残留量。每种可食性组织中安全浓度的计算均基于一个60 kg的成年人每日摄入WHO推荐的食物消费量,同时考虑ADI的分配比例,鸡蛋中安全浓度为:

2.6.3 临时MRL标准建议 鉴于我国规定蛋鸡产蛋期禁止使用地克珠利,现有文献未能提供蛋中残留标示物占总残留的比例,按FDA推荐的主要代谢物判定标准10%进行保守估计,制订地克珠利在鸡蛋中的临时MRL标准。
MRLe=SCe×Rm×Re=3000×10%×80%=
240(μg/kg)。
其中,MRLe指蛋中最高残留限量(μg/kg);SCe指蛋中安全浓度(μg/kg);Rm指残留标示物与总残留的比例(%);Re指定量分析方法回收率(%)。为便于实际应用,将MRL进行取整。因此,建议鸡蛋中地克珠利的临时MRL为240 μg/kg。
2.6.4 弃蛋期 参照鸡蛋中地克珠利的临时MRL为240 μg/kg,蛋清和全蛋样品中地克珠利的浓度低于240 μg/kg,因此,以蛋黄样品进行弃蛋期分析。采用WT1.4软件,以95%的可信限为标准,MRL设为240 μg/kg,曲线拟合结果如图3所示。结果表明,自给药第5.11天开始,截止到停药第7.38天,蛋黄中地克珠利的含量均超过MRL,因此,弃蛋期从给药第5天至停药第8天,共16 d。

(a:给药期;b:停药期)(a: Administration period;b: Withdrawal period)图3 地克珠利在鸡蛋的弃蛋期拟合图Fig 3 Diclazuril in the off-drug period of eggs
3 讨 论
3.1 色谱条件的优化 目前,地克珠利的色谱条件在多篇文献中均有报道,侯轩等[9]采用0.2%甲酸水:乙腈(70∶30,V/V)的流动相进行梯度洗脱,样品运行时间为12 min。陈彤等[10]采用0.1%甲酸水:甲醇(90∶10,V/V)的流动相进行梯度洗脱,样品运行时间为6 min。为了达到快速检测鸡蛋中地克珠利含量的目的,本研究优化了样品运行时间, 在4 min内完成鸡蛋中地克珠利含量的检测。同时,本研究中比较了不同流动相相对分离度、峰形、灵敏度等影响。结果发现:水相的酸碱度对地克珠利的分离影响不大,对质谱响应值也无明显影响,加入甲酸并没有提高响应值。有机相用乙腈比用甲醇时地克珠利峰形更好。因此,本研究采用乙腈-水作为流动相体系。
3.2 样品提取与净化 鸡蛋是磷脂含量最高的食物之一,此外还含有大量的脂肪,极大干扰目标化合物的分析。目前,国内外关于地克珠利的提取与净化方法有许多报道[6,9,11-14],提取试剂一般为乙酸乙酯、乙腈、甲醇、乙腈和乙酸乙酯(5∶2)混合溶液。本试验比较了不同提取剂对样品回收率的影响,结果表明甲醇提取效果较差,回收率较低,为45%~50%,使用乙腈和乙酸乙酯提取,回收率为70%~95%,但乙酸乙酯提取杂质较多,影响后续净化步骤。而乙腈能够有效沉淀蛋白,防止样品基质中杂质堵塞固相萃取柱,因此选择乙腈作为样品提取液。同时,本研究比较了OASIS HLB固相萃取柱和OASIS PRiME HLB固相萃取柱的净化效果,结果表明,OASIS HLB小柱的净化效果较弱,回收率为55%~60%,并有杂峰干扰,无法有效地去除蛋黄样品中的磷脂和脂肪,净化后的液体浑浊,对仪器有损害作用。OASIS PRiME HLB小柱具有步骤简单、洗脱液清澈、净化快速的优势,能有效去除鸡蛋样品中的磷脂和脂肪等杂质,回收率在80%左右。因此,OASIS PRiME HLB(6cc,200 mg)固相萃取柱净化效果更好。
3.3 地克珠利在鸡蛋中的残留消除规律 参照《兽药残留试验指导原则(征求意见稿)》及临床推荐给药剂量制定地克珠利给药12 d的试验方案。结果表明,给药期间蛋清、蛋黄和全蛋中地克珠利残留量与给药时间成正比,最高残留量均出现在给药第12天,蛋黄中地克珠利残留浓度最高,在蛋清中残留浓度最低。这可能与药物在鸡蛋中残留浓度与蛋黄和蛋清的形成时间密切相关,蛋白的形成时间为1~2 d,蛋黄在卵巢中形成时间为12 d[15]。停药后蛋清、蛋黄和全蛋中地克珠利残留前期消除较快、后期消除缓慢,从消除半衰期来看,地克珠利在蛋清中滞留时间比在蛋黄中长,消除更慢,这可能与地克珠利与蛋白质的结合的稳定性密切相关,稳定性越好,在蛋清中的残留越长[16]。
4 结 论
目前,国内外关于地克珠利在鸡蛋中的残留消除研究很少,随着抗球虫药物的广泛使用,地克珠利在鸡蛋中的残留情况不容忽视。本研究针对鸡蛋中地克珠利残留建立了一种简单、高效、灵敏的UPLC-MS/MS检测方法,并首次研究和探讨了地克珠利在蛋清、蛋黄和全蛋中的残留消除规律,地克珠利在蛋黄中消除最快,在蛋清中消除最慢。根据地克珠利在鸡蛋中的残留情况,建议鸡蛋中地克珠利的最大残留限量为240 μg/kg,弃蛋期从给药第5天至停药第8天,共16 d,为临床应用提供科学依据。
