一株高产胞外多糖的乳酸芽孢杆菌的筛选及功能鉴定
2021-12-29靳宝林杨晓宇白林含
丁 涛, 靳宝林, 杨晓宇, 白林含
(四川大学生命科学学院生物资源与生态环境教育部重点实验室, 成都610064)
芽孢杆菌作为益生菌用于生产发酵食品和保存食品已有很多年的历史.因其具有分泌蛋白酶、抗菌物质的能力以及在胃肠道环境下较强的生存能力,得到越来越多的关注[1].芽孢杆菌是一种外源性的芽孢形成细菌,通常不能定植于胃肠道中,但可保持胃肠道微生物的良好平衡以及改善动物的生产性能[2].已有研究表明益生芽孢杆菌可以在胃肠道的生理损伤条件下起预防作用[3],同时因产生胞外多糖而具有体外清除自由基、抗脂质过氧化的能力和体内提高抗氧化酶的活性、抗脂质过氧化的能力,还可调节内源性抗氧化剂的活性[4].大量从天然发酵食物中分离出具有益生菌特性的芽孢杆菌,正以多种形式商业化[5].
微生物胞外多糖是具有糖苷键的高分子量聚合物的大分子.多种微生物包括细菌、真菌、藻类均能在其生长过程中分泌胞外多糖,相比而言细菌产生能力较强.胞外多糖不仅具有抗氧化活性,还具有特殊的生理活性,如降低胆固醇、抗肿瘤和调节机体免疫能力等,是功能性保健产品和医药产品的重要成分[6].微生物胞外多糖还可能在调节肠道菌群中起重要作用,如双歧杆菌的应用[7].
本实验室从四川怀远发酵米糕作坊环境中分离纯化了多株芽孢杆菌,对其中高产胞外多糖和乳酸的XQ进行分子鉴定、功能鉴定及模拟胃肠道的耐受性试验以及菌株安全性方面探究,为开发益生菌提供新的资源菌株.
2 材料与方法
2.1 材 料
菌株(XQ),由本实验室分离保存;L-乳酸,购自成都市科隆化学品有限公司;血琼脂平板,购自郑州安图生物工程股份有限公司;大肠杆菌、金黄色葡萄球菌、肠炎沙门氏菌由四川大学王红宁教授实验室提供;OXOID药敏纸片购自Thermo Scientific公司.货号分别为CT0024B、CT0041B、CT0425B、CT0020B、CT0058B、CT0013B、CT0264B、 CT0052B、 CT1754B.
2.2 实验方法
2.2.1 16S rDNA鉴定 采用M13的通用引物:M13F: 5′-TGTAAAACGACGGCCAGT-3′;M13R: 5′-CAGGAAACAGCTATGACC-3′.进行菌液PCR验证,由成都擎科公司进行测序.将测序序列在NCBI数据库Blast上进行序列比对分析,在MEGA 6.06软件中采用Likelihood方法构建系统发育进化树.
2.2.2 产乳酸检测 将XQ接种至50 mL MRS液体培养基中,37 ℃,200 r/min培养48 h.发酵液中乳酸含量的测定参照付卫明等人的反相高效液相色谱法[8].色谱条件:柱子为C-18反相柱子;流动相为pH2.5磷酸缓冲液;柱温为室温;流速为1 mL/min;波长为210 nm;进样量为20 μL;L-乳酸为内标.
2.2.3 胞外多糖的粗提取 将XQ接种至100 mL产胞外多糖液体培养基中,接种量为3%,37 ℃ 200 r/min发酵3 d.参照王辑[9]的方法对发酵液中的胞外多糖进行粗提取,并采用苯酚-硫酸法[10]测定粗胞外多糖的含量.
2.2.4 胞外多糖的纯化 取粗胞外多糖溶液在纯水中透析(透析袋MWCO为3 000~7 000),上样DEAE(GE XK16)中,离子水、0.1 mol/mL、0.3 mol/mL、0.5 mol/mL NaCl溶液分阶段洗脱,每阶段洗脱3个柱体积,流速为1 mL/min,分体积收集洗脱液(3 mL/管),用苯酚-硫酸法检测多糖洗脱液含量,以各管在490 nm的吸光光度测定对应管数作图,绘制其洗脱曲线.合并各个洗脱峰的洗脱液,利用超滤管(MWCO3000)浓缩,在纯水中透析.
2.2.5 体外抑菌实验[11]将XQ接种至50 mL LB液体培养基中,接种量为2%,30 ℃ 200 r/min培养3 d.将发酵液上清液冷冻干燥后,稀释20倍后过滤,得到浓缩的无菌发酵滤液,吸取50 μL浸润空白滤纸片;粗胞外多糖吸取50 μL浸润空白滤纸片.
将大肠杆菌、肠炎沙门氏菌、金黄色葡萄球菌活化12 h均匀涂布于LB固体培养基上;后将上述滤纸片放置于LB平板上.其中,无菌LB培养液的滤纸片为空白对照,氯霉素(30 μg)药敏纸片为阳性对照.每个实验重复3次,37 ℃恒温培养12 h,观察滤纸片周围的抑菌圈.
2.2.6 羟自由基清除活性 羟自由基清除活性的测定参照金鸣等人[12]的方法.
羟自由基清除活性=(A1-A0)/
(A-A0)×100%
式中,A0是对照试验的吸光光度值(即以水代替样品);A1是样品试验的吸光光度值;A是以水替代反应体系中的H2O2和样品的吸光度值.
2.2.7 DPPH自由基清除活性DPPH自由基清除活性的测定参照Shimada等人[13]的方法测定.
羟自由基清除活性=[1-(A1-A)]/
A0×100%
式中,A0是对照试验的吸光光度值(即以水代替样品);A1是样品试验的吸光光度值;A是以水替代反应体系中的DPPH溶液的吸光度值.
2.2.8 抗肿瘤活性测定 采用 Ramamoorthy等人[14]的方法测定胞外多糖的抗肿瘤活性.选择A549和HepG2细胞作实验对象,细胞在37 ℃、5% CO2细胞培养箱中培育24 h后,在A549、HepG2中分别加入终浓度为4和6 mg/mL的胞外多糖,在空白对照中加入等体积的培养基,继续培养24 h后;采用CCK-8法[15]体外检测细胞活性.
生长抑制率=(1-A1/A0)×100%
式中,A0是对照试验的吸光光度值(即以培养基代替样品);A1是样品试验的吸光光度值.
2.2.9 耐受性实验 采用Maragkoudakis等人[16]的方法进行人工模拟胃肠道耐受性和胆盐耐受性实验.
相对存活率=A1/A0×100%
式中,A0是未处理(0 h)的活菌数的对数值;A1是处理后的活菌数的对数值.
2.2.10 药敏实验 将XQ用棉签均匀涂布于MH琼脂表面,将涂布后的平板在室温下干燥3~5 min,用无菌镊子将药敏纸片贴于MH琼脂表面,使纸片与琼脂完全接触.每种药敏纸片设置3个重复.将平板置于37 ℃恒温培养箱中倒置培养16 h.实验结果根据CLSL分析[17].
2.2.11 溶血实验 将XQ均匀涂布到血琼脂平板上,37 ℃孵育24 h,检测溶血情况[18].
2.2.12 数据分析 使用EXCEL统计数据并利用Prism 6进行作图.试验数据SPSS进行数据处理,采用Ducan法进行单因素方差分析.
3 结果与分析
3.1 分子鉴定
将XQ的16S rDNA序列分别与NCBI中的GenBank中收录的序列进行BLAST分析,利用MEGA 6软件的Likelihood方法构建系统发育树,见图1.XQ与短小芽孢杆菌Bacilluspumilusstrain BDH8(序列登录号:KF933629.1)相似性为99.62%.
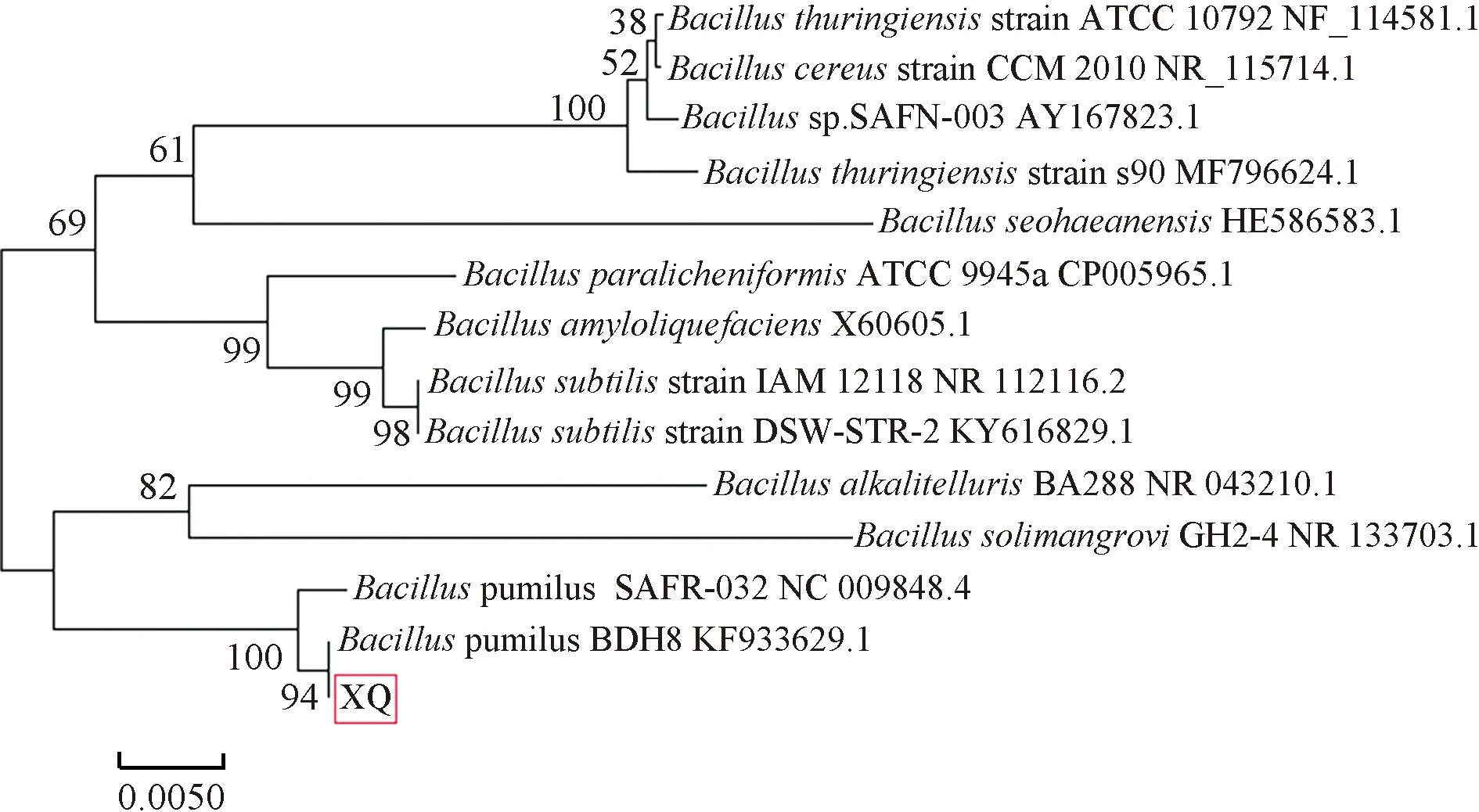
图1 XQ 16 S rDNA聚类分析Fig.1 16 S rDNA cluster analysis of XQ
3.2 HPLC检测乳酸含量
根据乳酸HPLC检测标准曲线,乳酸的保留时间为10.6 min,以乳酸浓度为横坐标(X轴),峰面积为纵坐标(Y轴),绘制标准曲线,得到方程为y=350 038.700 7x+1 056 828.801 1,R2=0.99,在0~35 g/L范围内具有良好的线性关系(见图2).
图3(a),乳酸溶液出峰时间为10.632 min,图3(b)发酵液中的乳酸出峰时间10.616 min,图3(c) 6 mg/mL乳酸溶液与发酵液混合液中的出峰时间为10.119 min,在发酵液中添加乳酸发现其峰升高(相较于发酵液),说明XQ产乳酸.检测其发酵液中乳酸,计算得到其峰面积为3 859 147,带入公式,其发酵液中乳酸含量为8 mg/mL.
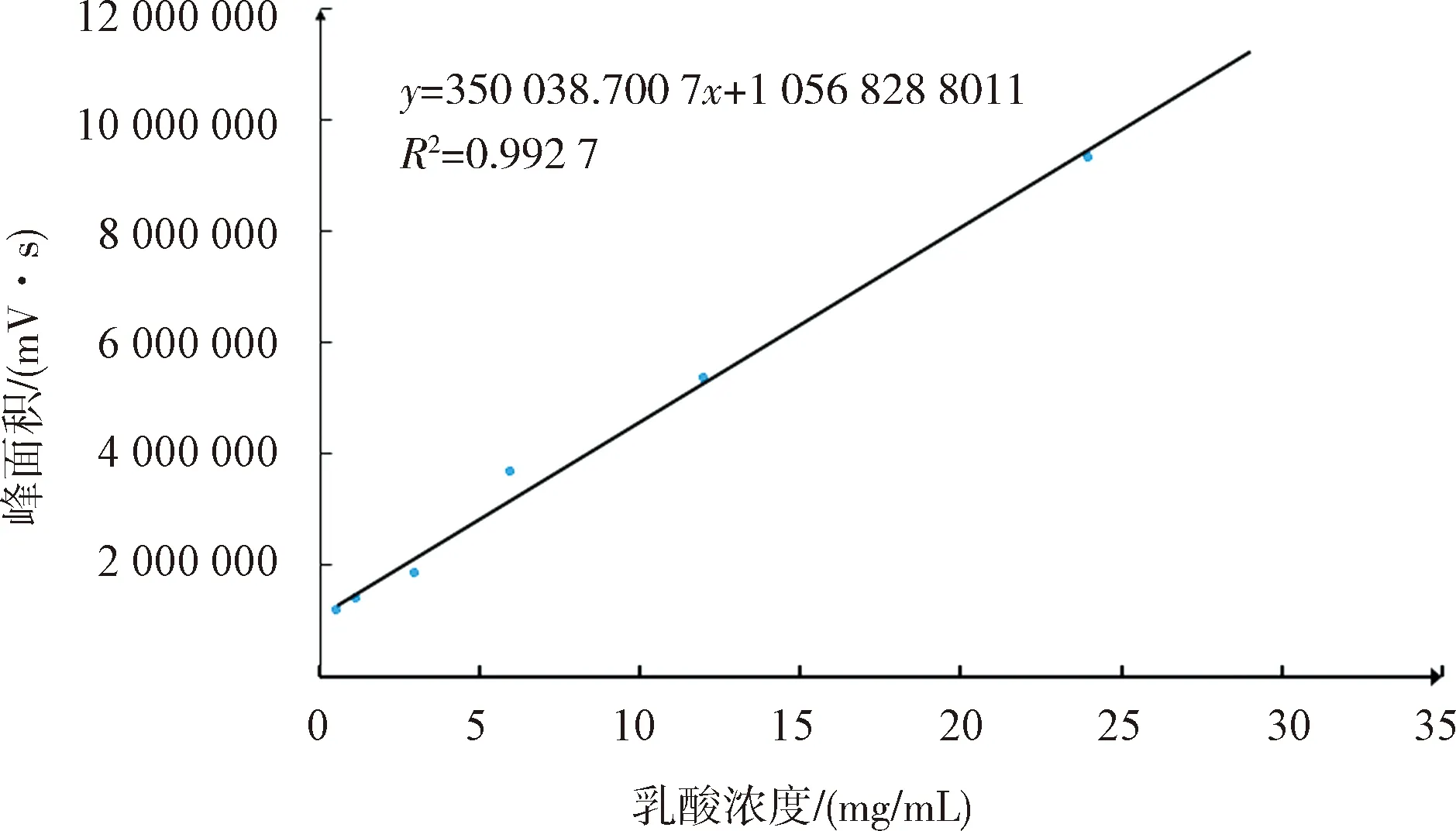
图2 乳酸标准曲线Fig.2 Standard curve of lactic acid
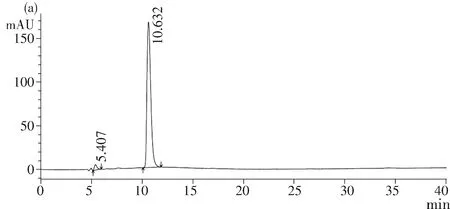
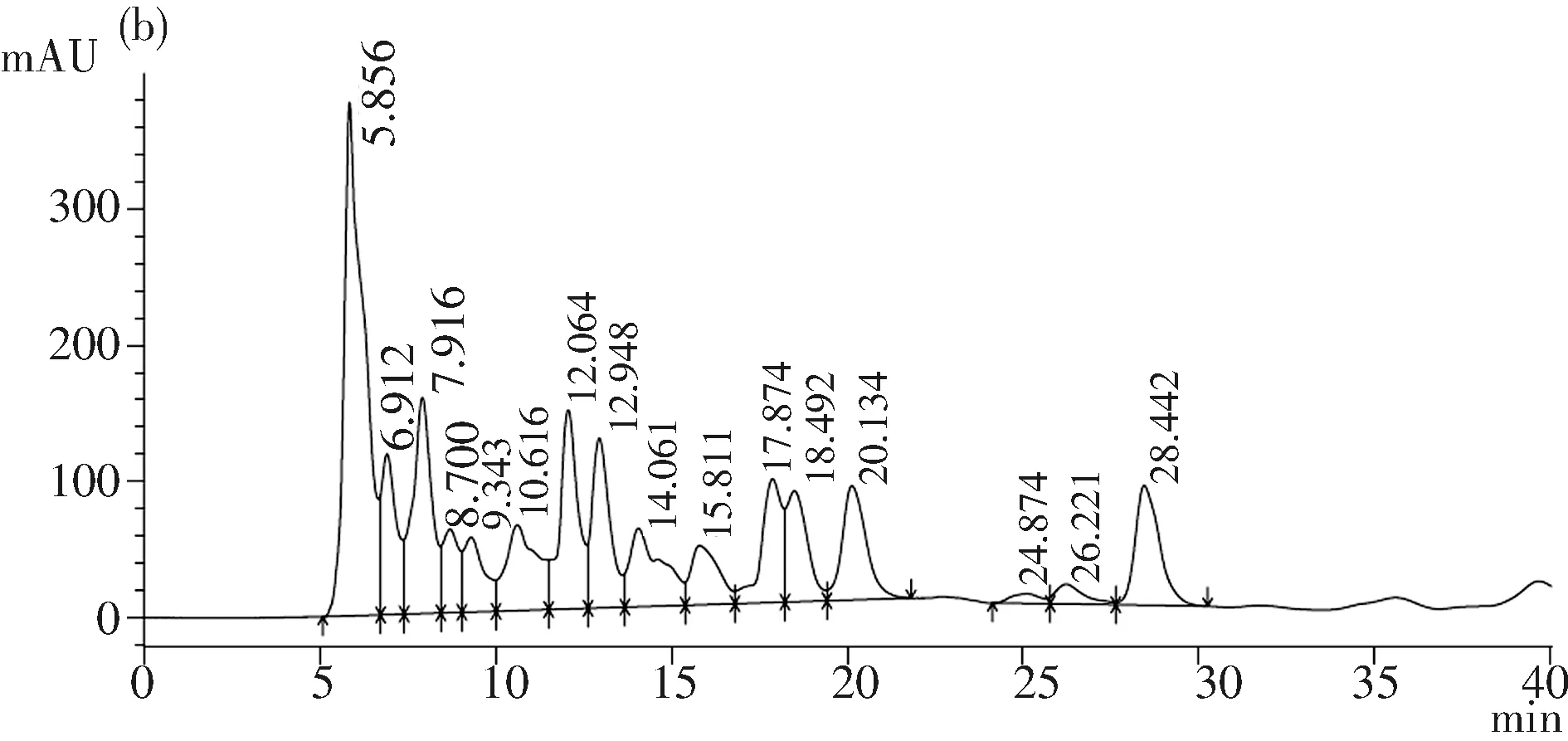

图3 HPLC 检测乳酸
3.3 胞外多糖含量测定
以葡萄糖浓度做横坐标(X轴),吸光度A490 nm做纵坐标(Y轴)绘制标准曲线,标准曲线为y=1.913x+0.013 6,R2=0.99,在0~1.4 mg/mL范围内具有较好的线性关系(见图4).利用苯酚-硫酸法测定发酵液中粗胞外多糖,将其稀释40倍,重复3次测定平均吸光光度值为0.356,则带入公式XQ产粗胞外多糖的浓度为7.16 mg/mL.
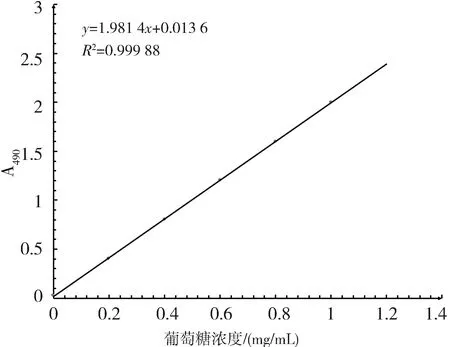
图4 葡萄糖标准曲线Fig.4 Standard curve of glucose
流速为1 mL/min时,仅有去离子水、0.1 mol/L NaCl水溶液中有多糖存在.其洗脱峰为图5,DEAE将粗胞外多糖分为E1和E2两个峰.由于DEAE是通过多糖组分中带有的电荷来筛分多糖,因酸性多糖比中性多糖所带电荷多,所以采用NaCl浓度梯度梯度增大的方式进行洗脱进而分离酸性多糖[10].E1组分不与DEAE结合,推测为中性多糖;E2与DEAE结合,可通过NaCl洗脱,带有电荷,推测为酸性多糖.
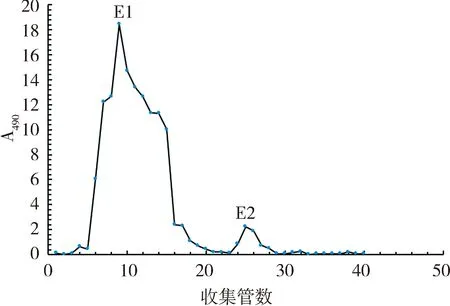
图5 胞外多糖DEAE层析洗脱曲线
3.5 体外抑菌实验
图6可以看出,XQ发酵液仅对肠炎沙门氏菌有抑制效果,粗胞外多糖对肠炎沙门氏菌、大肠杆菌、金黄色葡萄球菌均有抑制效果,且对大肠杆菌抑制效果最强,对肠炎沙门氏菌抑制作用最弱.
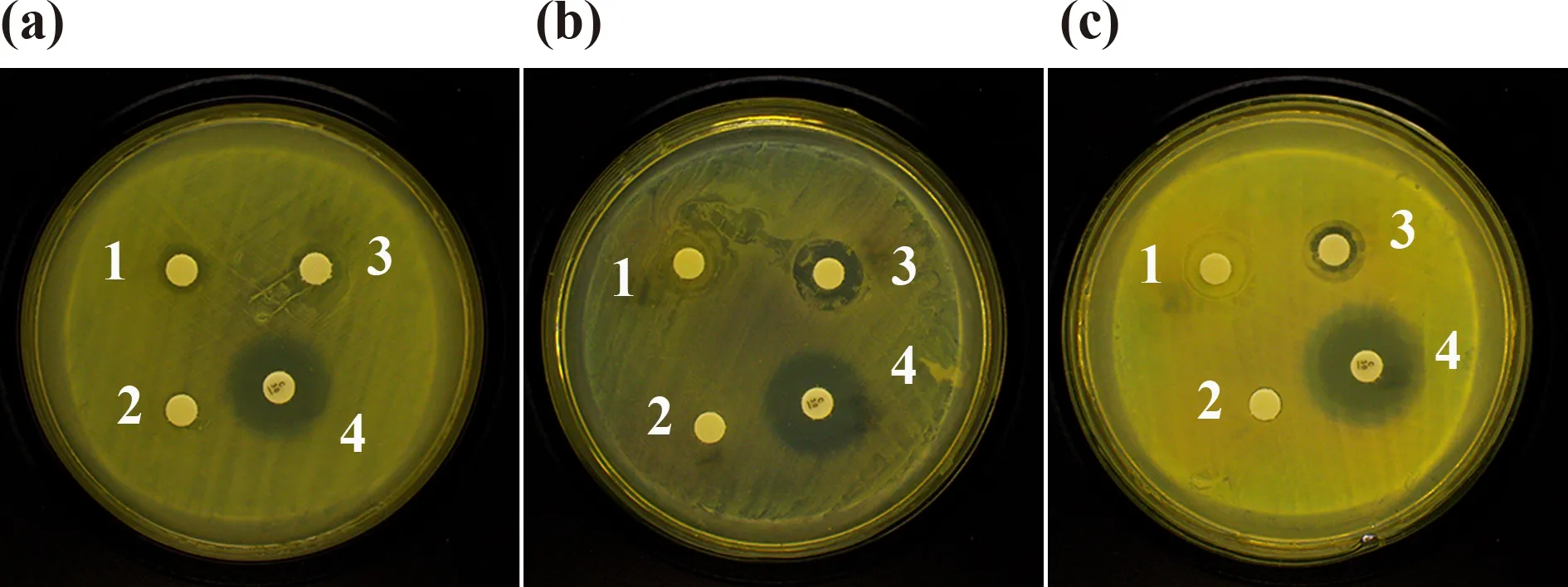
图6 抑菌实验
3.6 胞外多糖的抗氧化活性
3.6.1 羟自由基清除活性 胞外多糖E1、E2的羟自由基清除活性结果见图7(a).羟自由基清除活性随着浓度升高而增加,且E2显著高于E1;在浓度为10 mg/mL时,E1和E2其羟自由基清除率为3.24%和84.58%.
3.6.2 DPPH自由基清除活性 胞外多糖E1、E2的DPPH自由基的清除活性的结果见图7(b).清除活性随着浓度的增加而增加.在浓度为10 mg/mL时,E1和E2的DPPH自由基的清除率为26.07%和47.03%,具有中等的DPPH自由基清除活性.
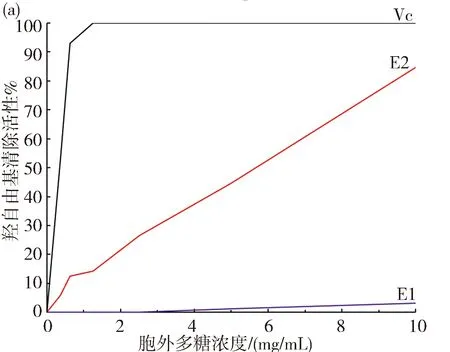
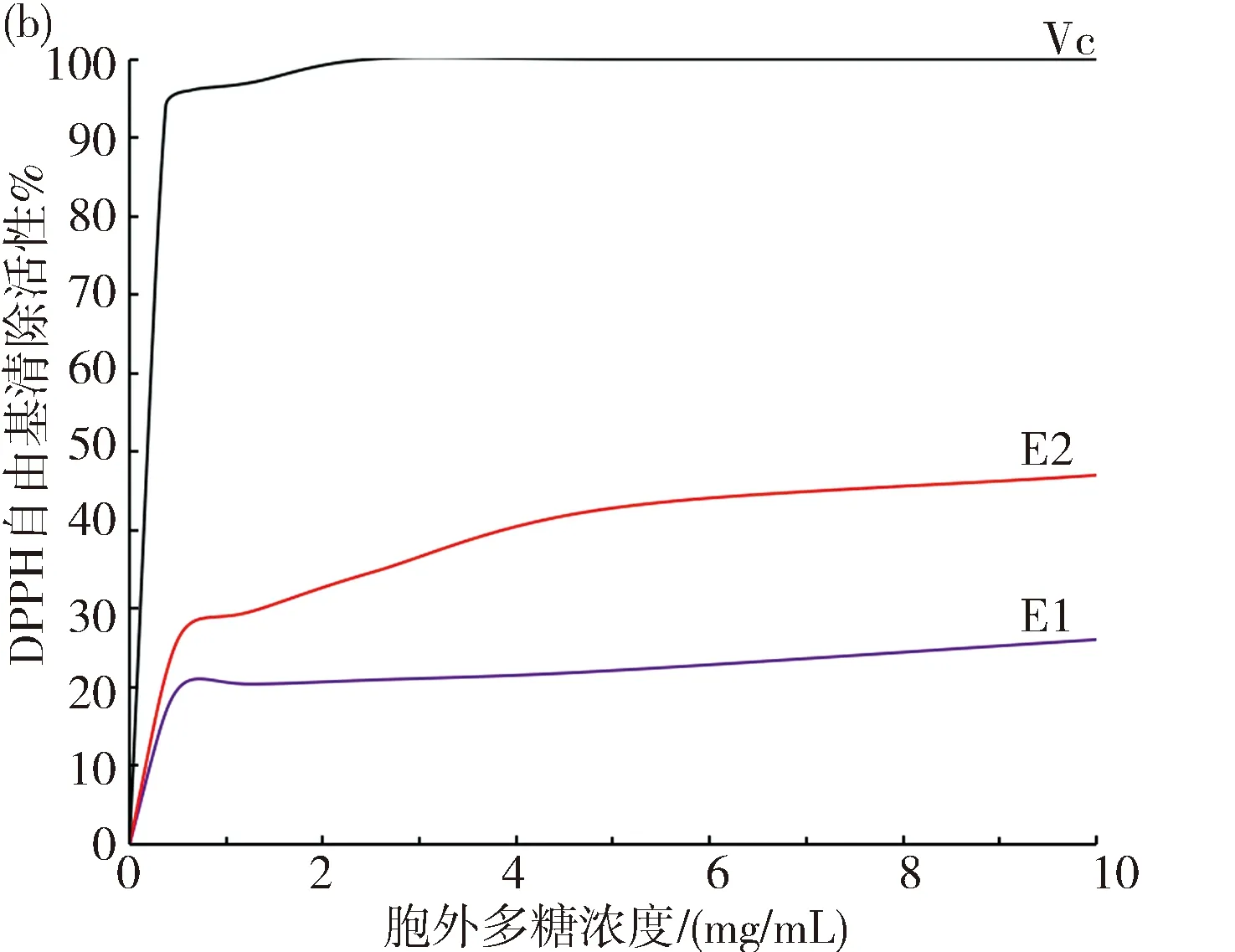
图7 胞外多糖的抗氧化性
3.7 抗肿瘤活性
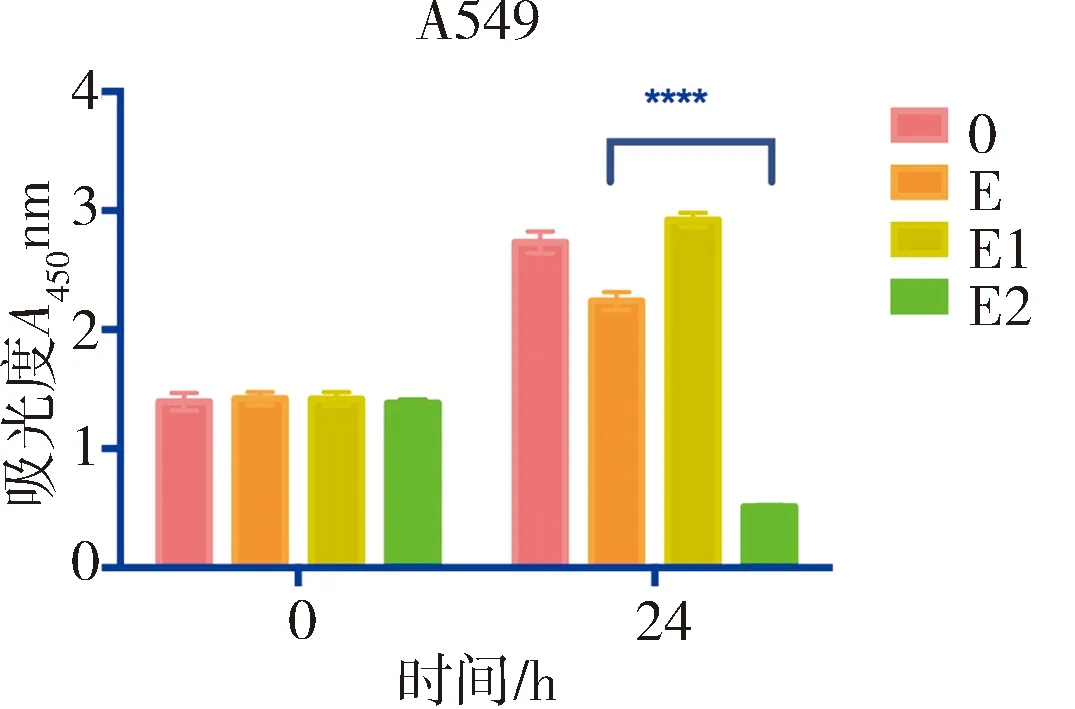
在本试验中,通过CCK-8的方法测定了胞外多糖对A549和HepG2细胞系的体外细胞毒性试验.加入胞外多糖浓度为4 mg/mL时,E2对A549细胞的生长抑制率为81.30%,培养HepG2细胞时加入胞外多糖浓度为6 mg/mL,E2对HepG2细胞的生长抑制率为53.40%.胞外多糖E2对癌细胞系A549和HepG2细胞具有潜在的细胞毒性试验.E1未显示抑制肿瘤细胞生长的作用.
3.8 耐受性实验
XQ具有良好的耐受性,在酸性、胃蛋白酶、胰蛋白酶和胆盐特定条件下3 h相对存活率分别为82.51%、82.6%、89.15%和72.09%.
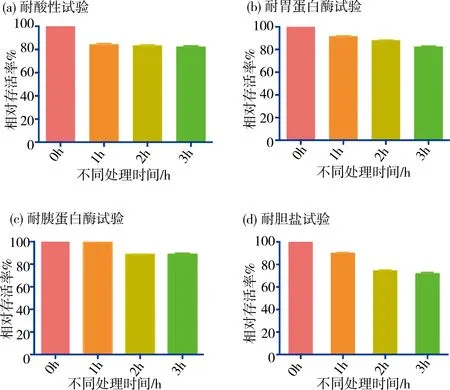
图9 XQ耐受性实验Fig.9 Tolerance experiment of XQ
3.9 药敏实验
根据抑菌圈直径的大小判断敏感性高低.由表1可知XQ作为格兰氏阳性菌对常见的革兰氏阳性菌抗生素(庆大霉素、四环素、万古霉素、环丙沙星、红霉素、氯霉素)均敏感;对革兰氏阴性菌抗生素氨曲南不敏感.说明XQ几乎没有潜在的药物抗性基因,在应用于生产中具有安全性.
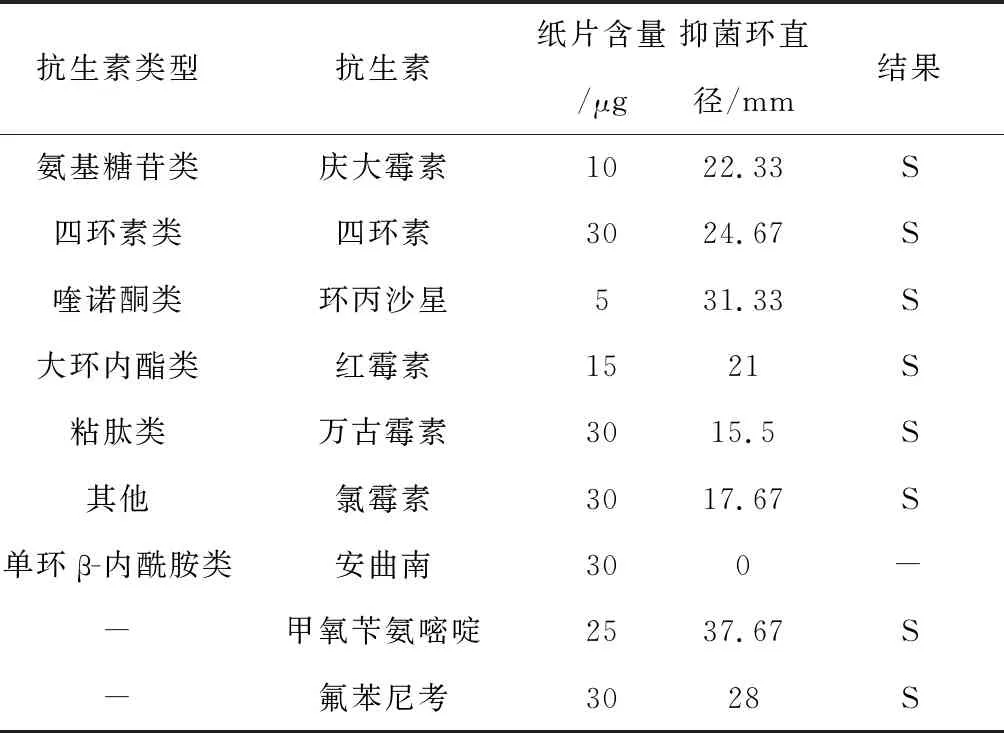
表1 XQ药敏实验
3.10 溶血实验
溶血性是其致病性的一个外在表现形式,是衡量毒力的重要指标.见图10,XQ不溶血,对照组为粘质沙雷氏菌溶血,说明XQ在溶血性方面具有安全性.
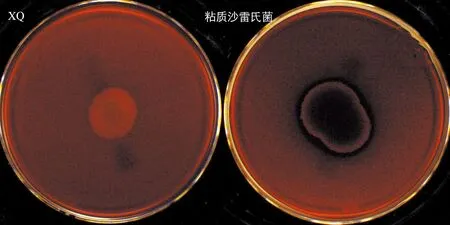
图10 溶血实验Fig.10 Hemolysis test
在食品相关领域,益生菌用于食品是全球趋势,其主要应用于提供一些除传统营养元素外的其它可促进健康的成分.但如何筛选和评估益生菌的价值是业内学者一直在探索的问题[19].而益生菌在体内共生环境下,通过分泌相关的代谢产物改变人体局部的条件而产生利好有初步的研究和认识,如有机酸或多糖等物质.
由于大多数病原体不能在低pH值下生长[20].有机酸的分泌,如乳酸,可降低胃肠道的pH使其成为不利于病原体生长的环境,同时有机酸对病原菌的代谢和毒素的产生也有影响,进而起到预防疾病的作用[21].
胞外多糖具有多种生理功能,但天然胞外多糖的产量并不高.与动植物胞外多糖相比微生物胞外多糖具有很多优点,其生产周期短,不受季节、地理和环境因素的影响,且原料丰富,成本相对较低,可在人工控制的条件下进行大规模工业生产,对环境无污染,其产量也相对较高,因此微生物胞外多糖具有很强的市场竞争力和广阔的前景发展[22].
现有研究中大部分乳酸菌胞外多糖的产量偏低(低于1g/L)[23-24],Lactobacillussp. Ca6产胞外多糖最大产量为2.4 mg/mL[25],而我们筛选的这株乳酸芽孢杆菌XQ胞外多糖产量为7.16 mg/mL,可节省高昂纯化成本,因此XQ是具有开发优势的.有报道称来自不同微生物的胞外多糖混合物具有更好的DPPH清除能力[26-27],这一点可为今后配制更好的DPPH清除能力胞外多糖混合物提供组分来源.
胞外多糖的抗肿瘤活性也备受关注.在本研究中,E2对癌细胞系A549和HepG2细胞具有细胞毒性.浓度为4 mg/mL时,对A549细胞的生长抑制率为81.30%,浓度为6 mg/mL,对HepG2细胞的生长抑制率为53.40%.
E1未表现出肿瘤抑制作用,但作为中性多糖依然具有重要价值.Speciale等人[28]发现双歧杆菌双歧杆菌PRI1可产生四种不同化学结构的中性多糖混合物,同时发现不同化学结构的中性多糖在调节宿主与细菌相互作用中具有不同的作用,推测中性多糖混合物可根据结构差异调节宿主免疫力,从而增强免疫力或诱导免疫耐受.中性多糖可以促进某些乳酸菌的生长.Zeng等人[29]从CistanchedeserticolaYC Ma获得了中性多糖CDA-0.05,可以显著促进三种拟杆菌(B.thetaiotaomicron,B.ovatus和B.fragilis)的生长;此外,CDA-0.05还可以促进某些益生菌的生长,例如干酪乳杆菌,植物乳杆菌和路透乳杆菌.中性多糖可能还具有抗病毒的作用.Li等人[30]从DendrobiumnobileLindl分离出的中性多糖DNPE6(4),具有抗TMV和抗CMV活性.
综上,从四川怀远发酵米糕作坊环境中分离出的短小芽孢杆菌(XQ),高产胞外多糖及乳酸.对常见食源性病原菌沙门氏菌、金黄色葡萄球菌、大肠杆菌具有抑制作用;产生的胞外多糖具备羟自由基清除活性和DPPH自由基的清除活性,并能抑制肿瘤生长.在模拟胃肠道耐受性实验中对胰蛋白酶、胃蛋白酶和胆盐均具有良好耐受性.对常用抗生素无耐药性,溶血试验阴性,具有生物安全性.表明XQ可作为一种潜在的益生菌.
