黄单胞杆菌胞外多糖对核桃生理代谢的影响1)
2020-05-29王丽毛鑫谯天敏朱天辉李姝江
王丽 毛鑫 谯天敏 朱天辉 李姝江
(四川农业大学,温江,611130)
核桃(Juglansregia)主要分布在东亚、中亚、西亚、南亚、欧洲和美国等地[1],是世界重要的油料树种。我国核桃种植资源丰富,种植范围极广,黑龙江、辽宁、湖北、陕西、云南、四川等22省市均有分布,其主要产区在四川、云南、陕西等省。核桃含丰富的不饱和脂肪酸及锌、钾、铁、维生素、泛酸等营养物质,具有温肺定喘、润肠通便的功效[2-3]。随着核桃种植面积的增加,核桃病虫害的发生越来越频繁[4-5]。经研究报道显示,在河北、山东、山西、辽宁、河南、江苏、浙江、四川、云南、山西、甘肃等省核桃产区核桃病虫害发病严重[6-7]。核桃黑斑病是核桃生产中的主要病害之一,对核桃的叶、芽、枝和果实都有一定的危害[8]。目前,对核桃黑斑病的研究主要集中在病原菌分离、发生特点、防治措施等方面[4-6],对核桃黄单胞杆菌(Xanthomonascampestris)胞外多糖致病性的研究较少,因而关于致病细菌胞外多糖对核桃黑斑病有何作用是值得探索和研究的一个问题。本研究利用分离鉴定出的核桃黄单胞杆菌为试验菌株,进行胞外多糖的提取。将提取出的粗多糖配制成不同质量浓度,分别作用于健康和感病的核桃植株上,观察其发病规律,测定其对核桃生理代谢的影响,从而确定胞外多糖对核桃黑斑病的影响,探究其致病机理。
1 材料与方法
1.1 供试菌株及培养基
核桃黑斑病病原菌黄单胞杆菌由四川农业大学林木病理实验室分离并保存。菌株活化及振荡培养采用NA固体培养基(蛋白胨5~10 g,牛肉膏3 g,氯化钠5 g,琼脂15 g,蒸馏水1 L,pH调到7.0)及NA液体培养基(蛋白胨5~10 g,牛肉膏3 g,氯化钠5 g,蒸馏水1 L,pH调到7.0)。胞外粗多糖制备采用发酵培养基(玉米粉40.00 g,蛋白胨2.00 g,碳酸钙3.00 g,磷酸氢二钾5.00 g,硫酸镁0.50 g,硫酸亚铁0.25 g,柠檬酸0.25 g,蒸馏水定容至1 L,pH调节至7.0)。
1.2 胞外粗多糖的制备
将黄单胞杆菌接种于NA平板上活化12 h,挑取单菌落接种至装有50 mL NA培养基的250 mL锥形瓶中,30 ℃、200 r·min-1振荡培养36 h,收集菌液按体积分数1%比例接入发酵培养基中,相同条件下培养72 h。收集发酵液,10 000 r·min-1离心15 min,取上清液加入3倍体积的体积分数95%乙醇,4 ℃静置12 h,低温冷冻离心,收集沉淀,干燥后再次溶解于蒸馏水中,加入1/4体积的Sevag试剂,混合后剧烈震荡20 min,分层除去下层有机相,上层液体,10 000 r·min-1离心15 min,除去变性蛋白质,脱蛋白重复2~3次,在无蛋白沉淀溶液中加入超过2倍体积的体积分数95%乙醇,静置4 h后,倾倒部分上清液,余下混合液于10 000 r·min-1离心15 min,弃上清液,收集多糖沉淀,烘干备用。
1.3 胞外粗多糖致病性检测
采用针刺法,取生长良好、健康的核桃叶片,消毒处理后分别喷施1.5、3.0、5.0 g·L-1的胞外粗多糖溶液于叶片表面,每2 h喷施1次,共3次,以清水处理作为空白对照,每处理设3个重复。处理叶片置于培养皿中,保湿培养3 d,观察并记录叶片的发病症状。
1.4 胞外粗多糖处理后核桃叶片生理指标测定
采用盆栽试验,用蒸馏水配制质量浓度为0.5、1.5、3.0、5.0 g·L-1的胞外多糖溶液,分别对长势相同的核桃苗进行喷施,并以清水作为对照(CK1)。每个质量浓度处理5株核桃苗,重复3次。同时,选取2组生长基本保持一致的核桃植株分别接种黄单胞杆菌。接种24 h后,处理组分别喷施质量浓度为0.5、1.5、3.0、5.0 g·L-1的胞外多糖溶液,另一组作为空白对照(CK2)。喷施胞外多糖溶液后0、1、3、5、7 d分别采集核桃叶片测定相关生理指标,每个指标重复3次。电导率测定使用DDS-11A型直读式电导仪:相对电导率=处理电导率/煮沸电导率×100%;丙二醛(MDA)质量摩尔浓度测定采用硫代巴比妥酸(TBA)比色法;游离脯氨酸质量分数测定采用茚三酮显色法;超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)光还原法;过氧化物酶(POD)活性测定采用愈创木酚氧化法[9]。
1.5 数据分析与处理
应用Excel 2010和SPSS 20.0分析处理试验数据并制图。采用单因素方差分析和最小显著性差异(LSD)分析各组数据的差异性。
2 结果与分析
2.1 胞外粗多糖的致病性
培养3 d后,对照组的核桃叶片生长良好,喷施不同质量浓度胞外多糖的核桃叶片,出现病斑、萎焉症状。胞外多糖质量浓度为0.5 g·L-1时,核桃叶片表面出现零星病斑,随着处理质量浓度的增加,叶片表面的病斑开始扩大且蔓延。当质量浓度为5.0 g·L-1时,病斑面积覆盖整个叶片的80%左右,叶片出现枯黄萎焉等症状(图1)。可见,将胞外多糖作用于核桃叶片,会使叶片表现相应症状,随着质量浓度的增加,其症状也呈现加重趋势。
2.2 胞外粗多糖对核桃叶片细胞膜透性的影响
由表1可见,处理后3~7 d,健康植株和感病植株各处理组叶片细胞的电导率随处理质量浓度增加而增高,不同质量浓度梯度的电导率也随着处理时间的增加而呈上升趋势,并显著高于对照组(CK1),表现出叶片细胞电导率同处理时间、处理质量浓度呈正相关关系,表明喷施胞外多糖会对核桃叶片细胞的膜系统造成损伤。相比于健康植株处理组,感病植株在同一处理水平的电导率更高,细胞膜受损伤程度更大,对照组(CK2)的电导率也有一定程度的提高,但这是由于细胞内和细胞外水势差异的影响造成的,与其他质量浓度处理组相比上升幅度不大。
2.3 胞外粗多糖对核桃叶片MDA质量摩尔浓度的影响
由表2可见,用胞外多糖溶液处理健康核桃和感病核桃后,叶片中MDA质量摩尔浓度均明显高于对照,表明胞外多糖溶液处理的核桃细胞膜脂过氧化水平和膜损伤程度较高。相同处理时间,MDA质量摩尔浓度随处理质量浓度增加而升高。在处理前5 d内,随处理时间延长,MDA质量摩尔浓度增加,二者呈正相关关系,到第7天,其质量摩尔浓度较第5天有所下降,但仍显著高于对照组。健康核桃和感病核桃的MDA质量摩尔浓度均在5.0 g·L-1处理5 d时最高,但感病核桃叶片MDA质量摩尔浓度高于健康核桃且上升更快。
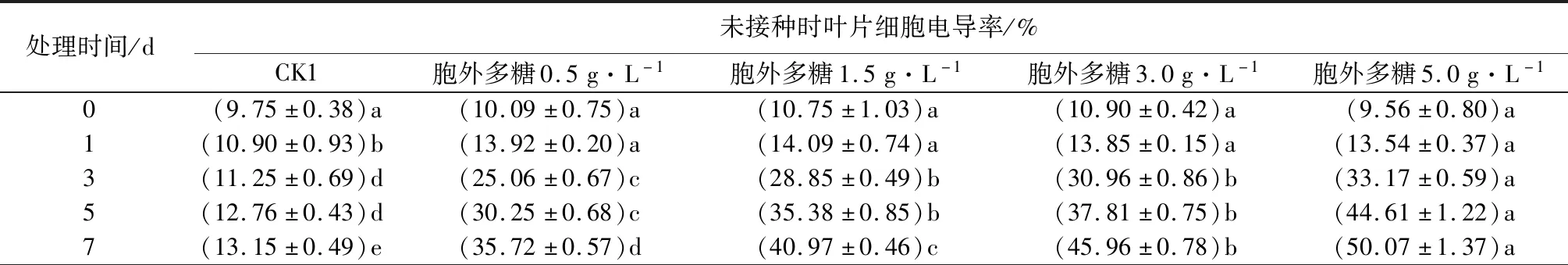
表1 黄单胞杆菌胞外多糖对核桃叶片细胞电导率的影响
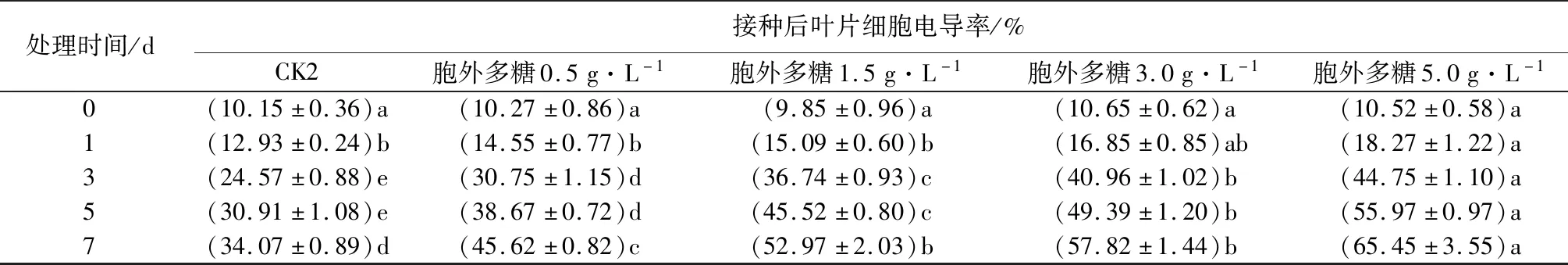
处理时间/d接种后叶片细胞电导率/%CK2胞外多糖0.5g·L-1胞外多糖1.5g·L-1胞外多糖3.0g·L-1胞外多糖5.0g·L-10(10.15±0.36)a(10.27±0.86)a(9.85±0.96)a(10.65±0.62)a(10.52±0.58)a1(12.93±0.24)b(14.55±0.77)b(15.09±0.60)b(16.85±0.85)ab(18.27±1.22)a3(24.57±0.88)e(30.75±1.15)d(36.74±0.93)c(40.96±1.02)b(44.75±1.10)a5(30.91±1.08)e(38.67±0.72)d(45.52±0.80)c(49.39±1.20)b(55.97±0.97)a7(34.07±0.89)d(45.62±0.82)c(52.97±2.03)b(57.82±1.44)b(65.45±3.55)a
注:表中数据为平均值±标准误,数据后同列不同小写字母表示不同时间处理间差异显著(P<0.05)。
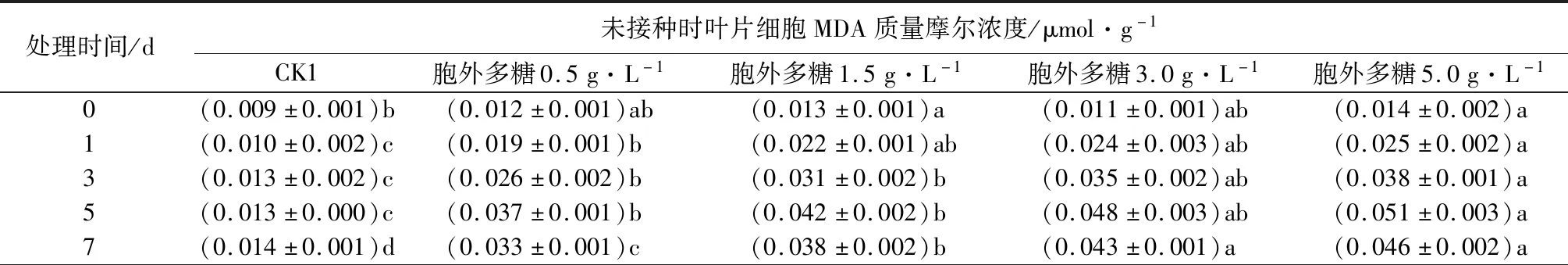
表2 黄单胞杆菌胞外多糖对核桃叶片细胞MDA质量摩尔浓度的影响
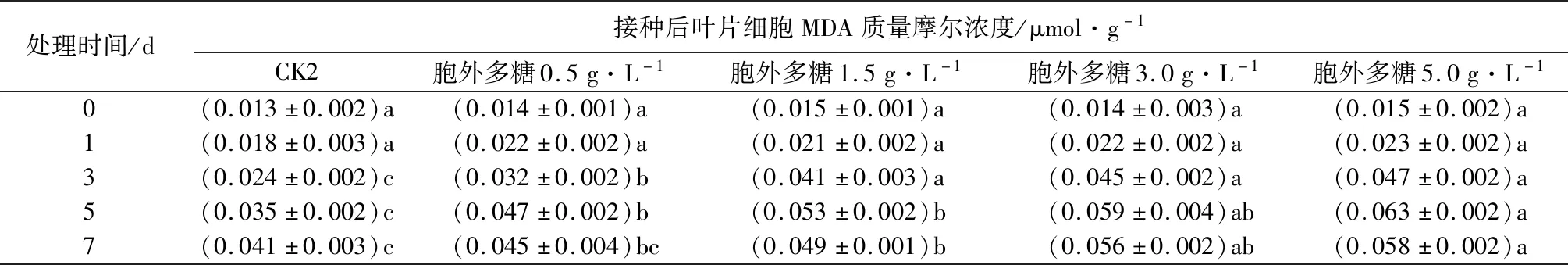
处理时间/d接种后叶片细胞MDA质量摩尔浓度/μmol·g-1CK2胞外多糖0.5g·L-1胞外多糖1.5g·L-1胞外多糖3.0g·L-1胞外多糖5.0g·L-10(0.013±0.002)a(0.014±0.001)a(0.015±0.001)a(0.014±0.003)a(0.015±0.002)a1(0.018±0.003)a(0.022±0.002)a(0.021±0.002)a(0.022±0.002)a(0.023±0.002)a3(0.024±0.002)c(0.032±0.002)b(0.041±0.003)a(0.045±0.002)a(0.047±0.002)a5(0.035±0.002)c(0.047±0.002)b(0.053±0.002)b(0.059±0.004)ab(0.063±0.002)a7(0.041±0.003)c(0.045±0.004)bc(0.049±0.001)b(0.056±0.002)ab(0.058±0.002)a
注:表中数据为平均值±标准误,数据后同列不同小写字母表示不同时间处理间差异显著(P<0.05)。
2.4 胞外粗多糖对核桃叶片游离脯氨酸质量分数的影响
由表3可见,不同质量浓度胞外多糖溶液处理核桃叶片后,各组游离脯氨酸质量分数呈上升趋势,且均高于对照。同一水平上,在0.5~3.0 g·L-1时,游离脯氨酸质量分数随胞外粗多糖质量浓度上升而增加,两处理组均在质量浓度为3.0 g·L-1、处理7 d时,叶片细胞脯氨酸质量分数达到峰值,感病核桃高于健康核桃。当质量浓度提高到5.0 g·L-1时,两处理组游离脯氨酸质量分数开始下降,这说明在核桃可以忍受的胞外多糖质量浓度范围内,游离脯氨酸质量分数有一定程度的增加,但超过了这个质量浓度范围,由于细胞器溶解等生理生化反应,核桃可能失去原有的组织功能,导致游离脯氨酸质量分数急剧下降。
2.5 胞外粗多糖对核桃叶片SOD酶活性的影响
由表4可见,不同质量浓度胞外多糖溶液处理后,核桃叶片中的SOD活性较对照显著上升,处理0~5 d,活性随处理时间增加而升高,第5天后开始下降。不同质量浓度的胞外多糖溶液与对照组相比,SOD活性差异显著。同一时间段,在质量浓度为0.5~3.0 g·L-1时,SOD活性随胞外粗多糖质量浓度上升而增加,质量浓度为3.0 g·L-1、处理5 d时,2个处理组细胞中SOD活性达最大值,分别为457.13、507.18 U·g-1,较相同处理时间内对照组高103.07%、38.05%。当胞外多糖溶液质量浓度增加到5.0 g·L-1时,SOD活性逐渐降低,表明核桃叶片中的SOD活性和抗病性随病害严重程度的增加而增加,但当胞外多糖质量浓度过高时,SOD酶系统失去功能,会使酶损伤,导致其活性降低。
2.6 胞外粗多糖对核桃叶片POD酶活性的影响
由表5可知,不同质量浓度胞外粗多糖处理下,各处理组细胞内POD活性均显著高于对照组。同一质量浓度作用下,随着处理时间的增加,POD活性呈先上升再下降的趋势。相同处理时间内,当质量浓度从0.5 g·L-1增加到3.0 g·L-1时,细胞内POD活性随着质量浓度的增加而上升,但当处理质量浓度增加到5.0 g·L-1L时,POD活性开始下降。质量浓度为3.0 g·L-1、处理5d时,叶片中POD活性达到峰值,分别为684.359、756.18 U·g-1,比对照组高217.26%、40.88%。这表明核桃叶片在发病过程中生理活动旺盛,具有一定的抗性,但当胞外多糖质量浓度达到相应阈值后,POD活性不再提高反而下降,说明植物的机体组织可能已经遭到破坏。
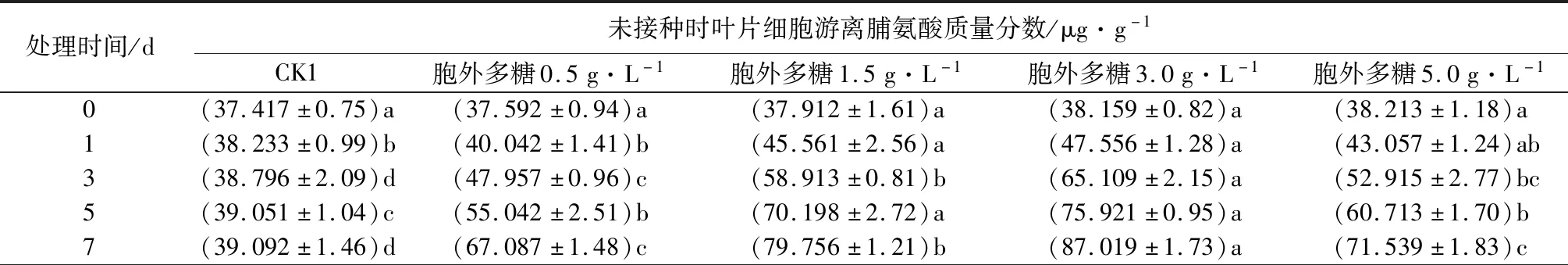
表3 黄单胞杆菌胞外多糖对核桃叶片细胞游离脯氨酸质量分数的影响
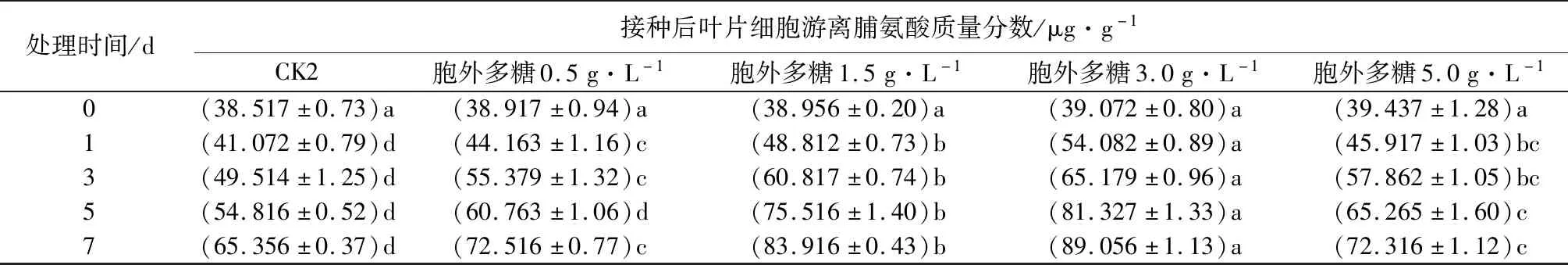
处理时间/d接种后叶片细胞游离脯氨酸质量分数/μg·g-1CK2胞外多糖0.5g·L-1胞外多糖1.5g·L-1胞外多糖3.0g·L-1胞外多糖5.0g·L-10(38.517±0.73)a(38.917±0.94)a(38.956±0.20)a(39.072±0.80)a(39.437±1.28)a1(41.072±0.79)d(44.163±1.16)c(48.812±0.73)b(54.082±0.89)a(45.917±1.03)bc3(49.514±1.25)d(55.379±1.32)c(60.817±0.74)b(65.179±0.96)a(57.862±1.05)bc5(54.816±0.52)d(60.763±1.06)d(75.516±1.40)b(81.327±1.33)a(65.265±1.60)c7(65.356±0.37)d(72.516±0.77)c(83.916±0.43)b(89.056±1.13)a(72.316±1.12)c
注:表中数据为平均值±标准误,数据后同列不同小写字母表示不同时间处理间差异显著(P<0.05)。
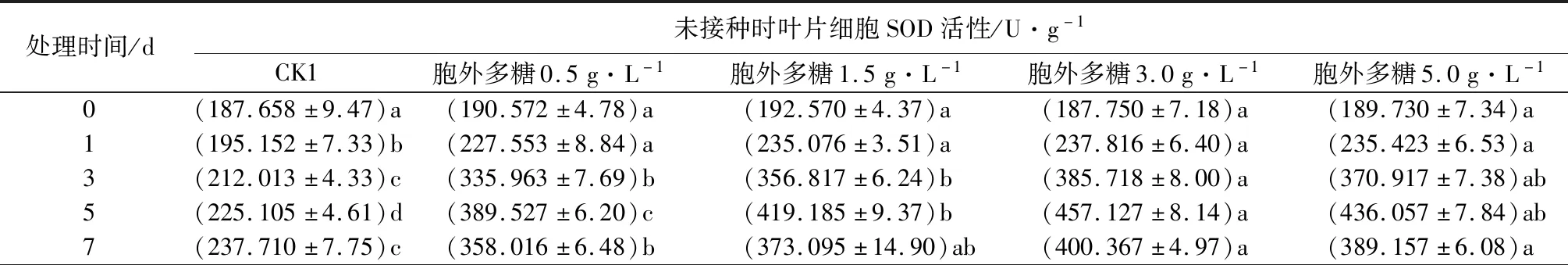
表4 黄单胞杆菌胞外多糖对核桃叶片细胞SOD活性的影响
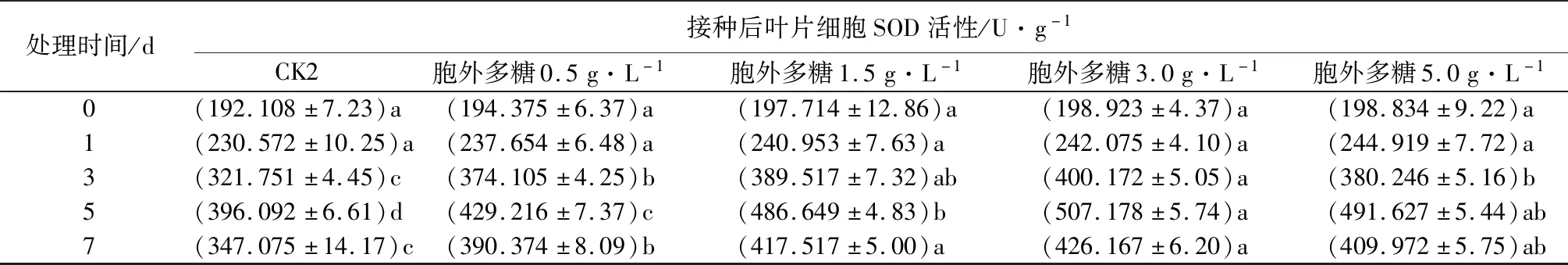
处理时间/d接种后叶片细胞SOD活性/U·g-1CK2胞外多糖0.5g·L-1胞外多糖1.5g·L-1胞外多糖3.0g·L-1胞外多糖5.0g·L-10(192.108±7.23)a(194.375±6.37)a(197.714±12.86)a(198.923±4.37)a(198.834±9.22)a1(230.572±10.25)a(237.654±6.48)a(240.953±7.63)a(242.075±4.10)a(244.919±7.72)a3(321.751±4.45)c(374.105±4.25)b(389.517±7.32)ab(400.172±5.05)a(380.246±5.16)b5(396.092±6.61)d(429.216±7.37)c(486.649±4.83)b(507.178±5.74)a(491.627±5.44)ab7(347.075±14.17)c(390.374±8.09)b(417.517±5.00)a(426.167±6.20)a(409.972±5.75)ab
注:表中数据为平均值±标准误,数据后同列不同小写字母表示不同时间处理间差异显著(P<0.05)。
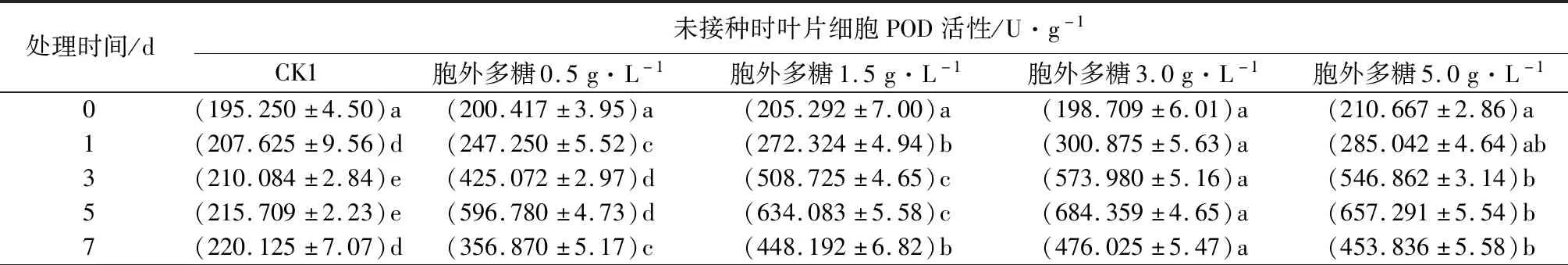
表5 黄单胞杆菌胞外多糖对核桃叶片细胞POD活性的影响
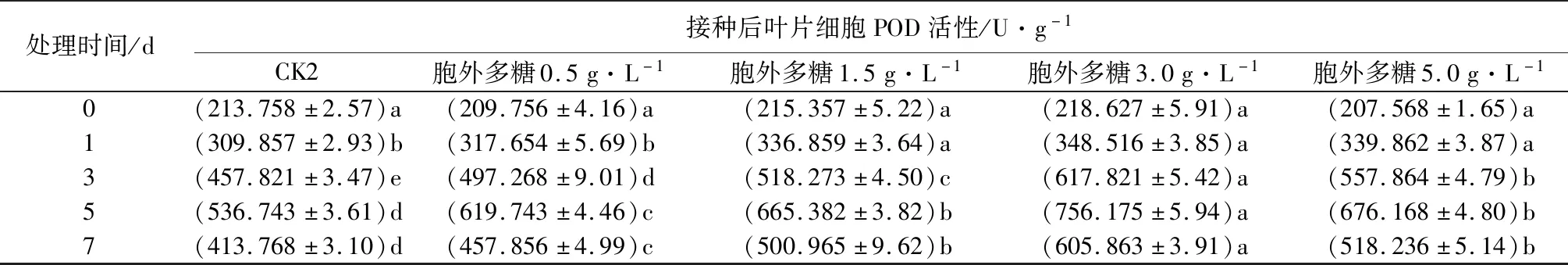
处理时间/d接种后叶片细胞POD活性/U·g-1CK2胞外多糖0.5g·L-1胞外多糖1.5g·L-1胞外多糖3.0g·L-1胞外多糖5.0g·L-10(213.758±2.57)a(209.756±4.16)a(215.357±5.22)a(218.627±5.91)a(207.568±1.65)a1(309.857±2.93)b(317.654±5.69)b(336.859±3.64)a(348.516±3.85)a(339.862±3.87)a3(457.821±3.47)e(497.268±9.01)d(518.273±4.50)c(617.821±5.42)a(557.864±4.79)b5(536.743±3.61)d(619.743±4.46)c(665.382±3.82)b(756.175±5.94)a(676.168±4.80)b7(413.768±3.10)d(457.856±4.99)c(500.965±9.62)b(605.863±3.91)a(518.236±5.14)b
注:表中数据为平均值±标准误,数据后同列不同小写字母表示不同时间处理间差异显著(P<0.05)。
3 结论与讨论
植物病原细菌产生的胞外多糖属于次级代谢产物,相关研究表明,胞外多糖是重要的致病因子,对病害的发生起着重要作用,可以对寄主的生理生化代谢、酶系统活性及核酸代谢等产生显著地影响[10-13]。本研究用胞外多糖溶液分别处理健康和感病的核桃叶片,通过分析相关生理生化指标,从而确定了其致病性。
本研究中,用胞外粗多糖溶液处理后,核桃叶片的细胞膜系统受损伤,导致透性改变、电解质外渗、电导率增加,且细胞中MDA质量摩尔浓度上升,这与张婷等[14]、李小琴等[15]的研究结果一致。此外,接种黑斑病的核桃叶片经胞外多糖溶液处理后,其电导率及MDA质量摩尔浓度增长较对照组更快,证明胞外多糖溶液加速了细胞电解质外渗,提高了电导率,导致细胞膜损伤加重。在逆境胁迫下,大多数植物均会积累大量的脯氨酸,以适应在逆境条件下植物细胞内外渗透压的变化,使植物具有一定的抗性和保护作用[16-18]。本研究结果显示,经过胞外粗多糖溶液处理游离脯氨酸质量分数上升,表明核桃叶片具有一定的抗胁迫能力。该结果同王勇等[19-21]研究结果一致。本研究所提取的黄单胞杆菌胞外粗多糖尚未纯化为单一多糖,除单一多糖外还含有蛋白等成分。据前人研究结果推测粗多糖提取液中主要致病因子为多糖成分[22],此推测有待进一步分离纯化胞外粗多糖成分后进行验证。
综上,核桃黄单胞杆菌胞外多糖质量浓度在一定程度上能够影响核桃机体的正常生理指标,从而揭示了胞外多糖具有致病性,这同李群良、陈小强等人的研究[32-33]相符。但其确切的致病因子及成分还有待研究和验证。
