高原缺氧对氯沙坦钾代谢动力学的影响※
2021-12-29朱俊博段雅彬杨建鑫刘贵琴顾文琦喇林立李向阳
周 杨,朱俊博,,段雅彬,杨建鑫,白 雪,刘贵琴,王 倩,顾文琦,喇林立,李向阳,3*
(1.青海大学医学部,青海 西宁 810001;2.青海大学高原医学研究中心,青海 西宁 810001;3.青海大学三江源生态与高原农牧业国家重点实验室,青海 西宁 810016)
氯沙坦钾(losartan potassium)口服吸收良好,在人体内主要由肝药酶CYP2C9(大鼠为CYP2C11)代谢为5-羧酸型活性代谢产物氯沙坦羧酸(EXP 3174),由于代谢产物氯沙坦羧酸是比氯沙坦钾更强的AT1受体拮抗剂且具有更长的半衰期,其形成对于氯沙坦钾的药理活性至关重要[1,2]。目前,氯沙坦钾的高原用药方案与平原别无二致。但基础研究发现,许多药物在高原地区的药物代谢动力学特征会发生变化。现通过相关研究,明确高原缺氧对氯沙坦钾的代谢动力学是否存在影响。
1.材料与方法
1.1 实验试剂
氯沙坦钾对照品(上海麦克林生化科技有限公司,纯度:99 %,批号:C10103850),氯沙坦羧酸对照品(北京百灵威科技有限公司,纯度:98%,批号:LH80T01),厄贝沙坦对照品(中国食品药品检定研究院,纯度:100%,批号:100607-201804),甲醇(美国Fisher Chemical试剂公司,纯度:色谱醇,批号:205347)。
1.2 实验仪器
AU2700自动生化分析仪(日本奥林巴斯株式会社),MX-S可调式涡旋混匀仪(北京大龙兴创实验仪器股份公司),XFA6100自动血细胞分析仪(南昌普朗医用设备有限公司),Eclipse Ci-L型正置白光拍照显微镜(日本尼康株式会社),Ultimate 3000超高效液相色谱仪(美国Thermo Fisher Scientific公司),Q Exactive Focus静电场轨道阱高分辨质谱仪(美国Thermo Fisher Scientific公司),Centrifuge 5418型离心机(德国Eppendorf生命科学公司),ME204E型电子天平(上海梅特勒—托利多仪器有限公司)。
1.3 实验动物
72只SPF级雄性SD大鼠(180 ~220g)购于西安交通大学医学院实验动物中心,许可证号:SCXK(陕)2018-001。大鼠常规饲养于陕西西安和青海果洛玛多地区。动物实验严格遵循青海大学医学院医学伦理委员会(批准号:2017-15)的规定。
1.4 实验动物分组及造模方法
大鼠随机分为常氧组[P,在陕西西安(海拔390m,大气氧分压20kPa)常规饲养]、急性缺氧组[AH,将常氧组大鼠运送至玛多(海拔4300m,大气氧分压12.5kPa)后常规饲养3d]、慢性缺氧组(CH,将常氧组大鼠运送至玛多后常规饲养30d)、慢性缺氧返回常氧组(CH-P,将常氧组大鼠运送至玛多后常规饲养30d,之后返回西安常规饲养7d)。每组各18只,10只用于取材,测定生理生化指标及做组织病理学切片;8只用于单次给药后做药物代谢动力学实验。
1.5 生理生化指标测定、组织形态观察及药物代谢动力学研究方法
各组随机取10只大鼠,用20%乌拉坦溶液麻醉,于腹主静脉取全血,用自动血细胞分析仪测定白细胞(WBC)、血红蛋白(HGB)、红细胞(RBC)等血常规指标;同时分离血清,置自动生物化学分析仪测定谷丙转氨酶(ALT)、谷草转氨酶(AST)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)等生化指标。
取各组大鼠心、肺、肝、肾组织(避免机械性损伤及挤压),固定在4%多聚甲醛溶液中,用由低到高浓度的无水乙醇进行洗涤并脱水,用二甲苯做透明处理2 h后转入石蜡溶液中,置温箱过夜,用苏木精—伊红溶液染色后脱水,以中性树脂封片,在显微镜下观察病理变化。
取各组剩余8只大鼠,禁食12 h后称重并灌胃(10.0mg·kg-1,氯沙坦钾),并在给药后0.083、0.250、0.500和1、2、3、4、6、8、12、24 h 时间点从大鼠眼眶后静脉丛取血0.3 mL置含有抗凝剂的离心管中离心(4000r·min-1,12min),用移液枪吸取离心液上层血浆于另一离心管,置-20 ℃冰箱保存。
1.6 液质测定条件
1.6.1 色谱条件
色谱柱:Hypersil GOLD C18(2.1mm×50mm,1.9μm);柱温:30 ℃;进样盘温度:20 ℃。
流动相:A相为 0.1%甲酸水;B相为甲醇。
梯度洗脱:0~3 min,B相保持10%不变;3~8 min,B相10%~90%;8~10 min,B相保持90%不变;10~14 min,B相90%~10%。
流速:0.3 mL/min。
进样量:4 μL。
1.6.2 质谱条件
采用多反应离子监测模式(MRM),做正离子模式扫描,扫描范围m/z:150~2000,分辨率:70 000。
离子源为加热电喷雾离子源(HESI),其参数如下,离子喷雾电压:3 000 V;离子源温度:300 ℃;离子传输管温度:350 ℃;鞘气流速:40 arb;辅助气流速:10 arb;吹扫气流速:1 arb;喷雾电压:3.5 kv。
氯沙坦钾、氯沙坦羧酸、厄贝沙坦的提取离子质荷比[M+H]+(m/z)分别为461.1253、437.1487、429.2397。
1.7 标准样品和质控样品制备方法
称取氯沙坦钾和氯沙坦羧酸对照品各两份,将其溶于甲醇中,混匀(涡旋),获得两份质量浓度均为1.00 mg·mL-1的氯沙坦钾和氯沙坦羧酸母液,一份用于配制系列浓度的工作溶液,一份用于配制不同浓度的质控溶液。精密量取氯沙坦钾和氯沙坦羧酸的母液,用甲醇稀释获得氯沙坦钾和氯沙坦羧酸质量浓度分别为0.20/0.02、0.50/0.20、1.00/2.00、2.00/10.00、10.00/20.00、20.00/40.00、40.00/80.00、80.00/120.00 μg·mL-1的系列工作溶液以及浓度为0.20/0.02、0.40/0.04、35.00/60.00、60.00/90.00 μg·mL-1的系列质控溶液。取大鼠空白血浆,将上述系列工作溶液和质控溶液稀释,获得血浆浓度分别为10.0/1.0、25.0/10.0、50.0/100.0、100.0/500.0、500.0/1 000.0、1 000.0/2 000.0、2 000.0/4 000.0、4 000.0/6 000.0 ng·mL-1的标准系列样品以及浓度为定量下限和低、中、高四种浓度的质控样品,其浓度分别为10.0/1.0、20.0/2.0、1 750.0/3 000.0、3 000.0/4 500.0 ng·mL-1。精密称取厄贝沙坦对照品,用甲醇稀释并定容,制得浓度为1.00 mg·mL-1的内标母液,将该母液继续稀释,得浓度为100.0 ng·mL-1的内标工作溶液。
1.8 血浆样品处理方法
吸取100.0 μL血浆样品,加入50.0 μL内标工作液和300.0 μL甲醇,涡旋30 s,离心(12000r·min-1)10 min,取上清液过0.22 μm的有机系滤膜,取过滤液4.0 μL用于UPLC-MS测定。
1.9 方法学考察方案
参照2020年版中国药典生物样品定量分析方法验证指导原则[3],以及美国食品药品监督管理局颁布的相关指导原则[4],对建立的UPLC-MS分析法从以下6个方面进行考察。
1.9.1 选择性
取6只大鼠的空白血浆混合样本、含内标的血浆样本、含氯沙坦钾及氯沙坦羧酸的血浆样本以及大鼠给药1 h后的血浆样品。将以上样本处理后按“1.6.1”及“1.6.2”项下所示条件进样,提取离子色谱图。结果表明,空白血浆中的内源性物质响应值较低,不成峰型,不干扰待测物的测定,具体色谱图见图1。
1.9.2 标准曲线
取标准系列样品按照“1.8”项下所示方法处理后进样并提取离子色谱图,以每个待测物理论浓度为横坐标,待测物与内标的峰面积比值为纵坐标绘制标准曲线。结果表明,氯沙坦钾和代谢物氯沙坦羧酸在10.0~4 000.0 ng·mL-1和1.0~ 6 000.0 ng·mL-1内的线性范围良好,其标准曲线方程分别为Y=1.0×10-5X+1.0×10-4(R2=0.999 9,氯沙坦钾);Y=1.1×10-3X+1.3×10-2(R2=0.999 6,氯沙坦羧酸)。
1.9.3 精密度和准确度
取氯沙坦钾及氯沙坦羧酸定量下限和低、中、高浓度四种质控样品,按“1.8”项下所示方法操作,每一浓度分析5个样本,连续测定3个分析批次,以此计算待测物的批内、批间精密度和准确度。结果显示,各浓度水平氯沙坦钾及氯沙坦羧酸质控样品的批内精密度(RSD)均小于 11.71 %,批间精密度均小于14.43 %,准确度(RE)均处于-8.89%~6.34%之间。质控样品的批内和批间的精密度和准确度均符合生物样品测定相关要求。
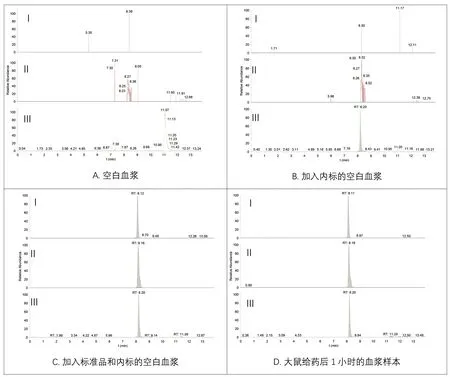
图1 氯沙坦钾(Ⅰ)、EXP 3174(Ⅱ)和厄贝沙坦(Ⅲ)大鼠血浆中的典型色谱图
1.9.4 基质效应
在6只大鼠的空白混合血浆中加入甲醇进行蛋白沉淀处理,向上清液中分别加入待测物低、高浓度对照质控溶液,使得氯沙坦钾的最终浓度分别为20.0、4 000.0 ng·mL-1,氯沙坦羧酸的最终浓度分别为2.0、6 000.0 ng·mL-1,其余按“1.8”项下所示方法操作。另取水代替空白基质进行相同操作。结果显示,氯沙坦钾低、高浓度的基质因子RSD值分别为7.86%、4.13%;氯沙坦羧酸低、高浓度的基质因子RSD值分别为1.88%、4.10%。在本实验所选测定条件下,基质效应的影响可忽略不计。
1.9.5 回收率
取低、中、高三个浓度的质控样品,按“1.8”项下所示方法操作,每个浓度分析6个样本。另取低、中、高三个浓度的质控溶液,加入经甲醇蛋白沉淀过的空白基质上清液和内标工作液,同样每个浓度分析6个样本。将同一浓度两种处理方法的待测物的峰面积与内标的峰面积比值相除,即得回收率。结果表明,低、中、高浓度的氯沙坦钾质控样品回收率分别为104.95%、95.13%、101.78%,回收率精密度均不大于8.99%;低、中、高浓度的氯沙坦羧酸质控样品回收率分别为96.89%、92.35% 、101.06%,回收率精密度均不大于3.49%。本实验所选处理方法回收率高、重现性好。
1.9.6 稳定性
用空白血浆配制低、高两个浓度的质控样品,其浓度与基质效应的质控样品相同。样品按“1.8”项下所示方法操作,每个浓度分析6个样本。考察质控样品于室温下放置8 h,在20 ℃自动进样盘放置24 h,于-20 ℃下反复冻融3次后氯沙坦钾和氯沙坦羧酸的稳定性。结果表明,氯沙坦钾及氯沙坦羧酸血浆样品的RE值均在-12.64%~11.86%之间,RSD值均不大于10.50%。氯沙坦钾及氯沙坦羧酸血浆样品在本实验设定的储存条件下稳定性良好,满足测定要求。
1.10 统计学方法

2.结果
2.1 生理生化指标测定结果
大鼠主要血常规指标测定结果见表1。结果显示,与P组比,AH、CH、CH-P组的HGB分别升高了11.59%、38.62%、24.86%,HCT分别降低了34.56%、23.36%、18.89%,MCV分别降低了28.24%、29.89%、36.37%,MPV分别降低了29.56%、22.22%、15.11%。与P组比,AH、CH组RBC分别升高了9.32%、27.27%,CH-P组降低了8.62%;AH组的WBC增加了51.81%,CH组的PLT减少了19.60%。其他生理指标无显著变化。

表1 高原低氧对大鼠血常规的影响
大鼠主要生化指标测定结果见表2。结果表明,与P组比,AH、CH、CH-P组的ALB分别升高了39.41%、30.34%、24.77%,A/G分别升高了168.70%、114.96%、107.44%,GLU分别升高了58.75%、96.65%、66.50%,LDL分别升高了114.77%、87.02%、93.05%。另外,与P组比,AH、CH、CH-P组的ALT分别降低了58.25%、51.32%、48.74%,AST分别降低了61.13%、58.00%、47.95%,TP分别降低了13.74%、11.41%、13.98%,GLO分别降低了48.27%、38.43%、39.15%,TC分别降低了17.64%、22.21%、80.44%。相比于P组,AH、CH组的HDL分别升高了92.76%、72.70%,UREA分别降低了25.61%、33.62%,TG分别降低了41.68%、17.60%,CH-P组的TG升高了8.97%。
表2 高原低氧对大鼠生化指标的影响
2.2 组织病理学观察情况
2.2.1 高原缺氧对心肌组织的影响
高原缺氧对大鼠心脏组织会造成局部微小损伤。HE染色结果显示,P组大鼠心肌实质着色均匀,心肌细胞分界清楚,走形一致,心肌细胞横纹清楚,明、暗相间;未见明显间质异常;未见明显的炎性改变。AH组大鼠出现局部间质毛细血管淤血,偶见炎性细胞浸润小灶。CH组大鼠出现广泛间质毛细血管淤血。CH-P组大鼠局部心尖处轻微损伤,心肌纤维松解,正常结构消失,横纹消失,纤维细胞增生。具体情形如图2所示。

图2 缺氧对大鼠心肌组织的影响(200×)
2.2.2 高原缺氧对肾脏组织的影响
高原缺氧对大鼠肾脏也会造成一定损伤。HE染色结果显示,P组大鼠皮质、髓质分界明显;皮质中肾小球分布均匀,肾小球中细胞数量以及基质均匀,肾小管上皮细胞圆润、饱满,刷状缘排列整齐规则,髓质未见明显异常;泌尿小管之间的结缔组织为肾间质,未见明显结缔组织增生,未见明显的炎性改变。AH组大鼠局部间质毛细血管出现扩张。CH组大鼠间质中有较多的毛细血管出现扩张或淤血现象。CH-P组大鼠间质中有较多的毛细血管出现扩张。具体情形如图3所示。

图3 缺氧对大鼠肾脏组织的影响(200×)
2.2.3 高原缺氧对肝脏组织的影响
缺氧组大鼠肝脏组织病变情况较为明显。HE染色结果显示,P组大鼠被膜完整,肝小叶结构清晰,肝板排列规则、整齐,肝细胞圆润、饱满,无明显炎性改变。AH组大鼠少量肝细胞脂肪发生变性,胞质中可见微小的圆形空泡;汇管区少量胆管细胞增生;肝小叶中偶见炎性细胞点状浸润。CH组大鼠较多肝细胞出现空泡变性,胞质中可见大小不一的水泡。CH-P组大鼠个别肝细胞胞质中可见小的圆形脂肪空泡。具体情形如图4所示。

图4 缺氧对大鼠肝脏组织的影响(200×)
2.2.4 高原缺氧对肺脏组织的影响
大鼠肺脏组织在低氧条件下存在病理学改变。HE染色结果显示,P组大鼠组织被膜完整,气道粘膜上皮未见明显异常,整体肺泡壁无明显增厚,无明显炎性浸润。AH组大鼠气道腔中多见较多分泌物;较大范围的肺泡壁增厚(程度不同),肺泡腔狭窄,上皮细胞和纤维细胞增生。CH组大鼠少部分气道腔中可见分泌物;大范围的肺泡壁增厚(轻中度),上皮细胞和纤维细胞增生,巨噬细胞数量变多,局部肺泡腔消失,可见少量小动脉炎性细胞包绕。CH-P组大鼠较多肺泡壁增厚(轻度),肺泡腔狭窄,上皮细胞和纤维细胞增生,血管周围可见炎性细胞包绕。具体情形如图5所示。

图5 缺氧对大鼠肺脏组织的影响(200×)
2.3 药物代谢动力学测定结果
P组、AH组、CH组、CH-P组的平均血药浓度—时间曲线图见图6~7。与氯沙坦钾P组比,氯沙坦钾AH、CH组的AUC0-t分别降低了40.13%、54.49%;MRT0-t分别降低了10.20%、15.00%;Cmax分别降低了57.18%、58.56%;t1/2分别降低了17.53%、21.65%;ke分别升高了20.83%、29.17%;Vd分别升高了21.54%、58.85%;CL分别升高了43.75%、87.50%。另外,相比氯沙坦钾P组,CH-P组的t1/2升高了44.33%、Ke降低了25.00%。相较于P组,两缺氧组的药物代谢动力学参数变化趋势一致,主要表现为t1/2缩短、CL、Vd升高以及AUC降低,CH-P组的AUC、CL、Vd、t1/2变化趋势与缺氧组相反,具体参数变化情况见表3。
表3 高原低氧对氯沙坦钾药代动力学参数的影响

图6 四组氯沙坦钾血浆浓度-时间曲线

图7 四组EXP 3174血浆浓度-时间曲线
与氯沙坦羧酸P组比,氯沙坦羧酸AH、CH组的AUC0-t分别降低了43.32%、53.94%;MRT0-t分别降低了19.14%、20.22%;Cmax分别降低了37.62%、45.31%;CL分别升高了57.02%、101.65%。另外,相比于氯沙坦羧酸P组,CH-P组的t1/2升高了38.28%,CL、Vd、ke等参数降低,但无显著性差异。与氯沙坦钾一致,氯沙坦羧酸缺氧组药物代谢动力学参数发生变化,主要表现为CL升高以及AUC、MRT降低,具体参数变化情况见表4。
表4 高原低氧对EXP 3174 药代动力学参数的影响
3.讨论
本研究结果显示,急性和慢性缺氧组大鼠的WBC数均升高,提示机体可能会在缺氧条件下产生应激反应,从而促使炎症反应的发生。与课题组前期研究不一致的是[5],模拟低氧造模使大鼠机体内WBC数目降低,反而显示出机体在模拟低氧条件下免疫功能出现负面调节情况。这可能是由于模拟低氧与现场缺氧的差异以及低氧造模时间的长短引起的不同,其原因有待进一步研究。机体进入低氧环境中会增加供氧能力从而满足原本的耗氧需求。与文献报道一致的是[6],本研究中发现缺氧导致HGB含量增高,可能是由于在低氧环境中,体内血红素浓度升高,从而运输更多的氧气来应对氧化应激。另外,大鼠从长期缺氧地区再次返回平原地区后,其血常规指标较缺氧组虽有所回调但仍与平原区差异较大,提示缺氧环境对机体生理及机体功能影响深远。
药物在机体内的代谢和排泄与肝肾功能密切相关。结果表明,与P组比,除CH-P组的UREA与HDL外,其余各组所有指标均有显著性差异,且慢性缺氧返回常氧组的变化趋势与两缺氧组一致,说明缺氧对大鼠的血脂、肝肾功能存在显著影响。肝脏是药物代谢主要器官,在高原缺氧条件下,肝功能的异常会对肝药酶的活力和转运体的功能产生影响,从而改变药物在体内的代谢特征[7]。与罗冰锋[8]等的研究不一致的是,本研究发现缺氧组ALT、AST均显著降低,其原因仍有待进一步阐释。肾功能指标显示进入高原后UREA水平下降,说明进入高原后药物的排泄能力会受到显著影响,导致不良反应的风险增加。不仅如此,缺氧组大鼠伴随着GLU水平升高,其TG、CHOL水平降低。
病理结果显示,P组大鼠各脏器组织结构正常、清晰,无明显的炎性改变。缺氧组大鼠肺脏组织出现不同程度增厚且肝脏组织少量肝细胞脂肪发生变性,心肌、肾脏组织均出现细微损伤。高海拔环境中,各脏器相对缺氧,产生大量的活性氧物质,导致脏器细胞损伤,出现微循环障碍[9],同时由于机体的抗氧化功能下降,肝损伤、急性肾衰竭等多种疾病的发生几率大大增加[10]。另外,机体经过长期缺氧后返回平原地区仍见其心、肝、肺、肾组织有轻微损伤,如心肌纤维松解,肝细胞胞质中仍存在圆形脂肪空泡,肺泡血管周围仍可见炎性细胞包绕等。提示从缺氧环境回到平原地区后,机体仍存在一定程度的损伤,在用药时需要将机体的实际情况纳入到考虑范畴之中。
近年来,高原缺氧对机体药物代谢动力学的影响备受关注。大鼠进入高原地区后,部分药物吸收速率减慢且吸收程度降低,如芍药苷和罗红霉素[11]等,本研究结果与其一致,主要表现为AUC、Cmax降低,Tmax延长。药物与血浆蛋白结合后无法通过毛细血管,只有游离型药物才能通过屏障,完成代谢和排泄。ALB作为与药物结合的主要蛋白,其数值的变化会影响药物浓度[5]。氯沙坦钾的蛋白结合率在常氧情况下已经超过98%。因此,当体内药量未曾发生改变的情况下,ALB数变化对血浆蛋白结合率的影响程度犹未可知。另外,低氧条件下,药物血浆蛋白结合率是否会受到影响也需进一步探讨。肝、肾是药物的消除器官,高原缺氧条件下,肝肾器官的损伤会导致药物t1/2及ke值异常。研究发现缺氧使氯沙坦钾Vd升高,且t1/2缩短,因此CL升高,消除加快。另外,大鼠体内CYP2C11是氯沙坦钾的主要代谢酶,该酶在低氧条件下的mRNA活性及表达会直接影响氯沙坦钾的代谢情况,目前大鼠体内的CYP2C11在缺氧条件下的表达变化存在争议,需进一步研究证实[7]。此外,代谢产物EXP 3174在缺氧条件下同样表现为AUC、Cmax降低,t1/2缩短,CL及Vd升高,从而证实了氯沙坦钾在高原缺氧环境下口服吸收减慢、程度降低、消除加快这一结论。
目前针对高原缺氧对机体药物代谢动力学影响的研究主要集中于机体进入缺氧状态后药物代谢及排泄的变化。本研究在此基础上,将缺氧大鼠运回平原地区并进行实验。发现相比缺氧组大鼠,其药物代谢动力学参数特征的变化有所回落,但与P组大鼠相比仍有差异,主要表现在MRT及t1/2延长,提示CH-P组大鼠消除减慢。此现象出现的机制仍就可能与代谢酶活性和表达的改变,以及其核受体[12,13]和细胞因子[14]的调节相关,具体原因需进一步研究探讨。
