STAT3、STAT5A、RUNDC3B候选基因多态性与西藏世居人群高原红细胞增多症的易感性※
2021-12-29刘丽军张致英杨雪林渠敬锋马福才马利锋康龙丽
张 寒,陈 辉,刘丽军,张致英,杨雪林,渠敬锋,马福才,马利锋,康龙丽*
(1.西藏民族大学医学部高原相关疾病分子遗传机制与干预研究省级重点实验室,陕西 咸阳 712082;2.西藏民族大学医学部环境与疾病相关基因研究高校重点实验室,陕西 咸阳 712082;3.西藏自治区第二人民医院,西藏 拉萨 850000)
高原人群长期处于高原低压低氧环境,会发生特有的慢性高原病(Chronic mountain sickness,CMS)——高原红细胞增多症(high altitude polycythemia,HAPC)[1]调研发现,同一海拔地区西藏世居人群HAPC发病率显著低于移居汉族人群,且女性患病率(1.9%)低于男性(3.4%)[2]。西藏世居人群可能存在高海拔低氧环境的适应基因,以抵抗HAPC的发生。目前,已有多篇文献认为高原人群HAPC的发病与基因位点的变异有关,包括PPP1R2P1、SENP1、ANP32D、PIK3CD、EPAS1等[3,4,5]。结合现有文献报道和课题组前期小样本测序研究结果[6],筛选出西藏世居人群发生HAPC可能的候选基因STAT3、STAT5A、RUNDC3B。本研究采取目标区域靶向测序技术,探讨STAT3、STAT5A、RUNDC3B候选基因多态性与西藏世居人群HAPC易感性的相关关系,为HAPC的遗传机制研究提供依据。
1.对象与方法
1.1 研究对象
根据“青海标准”[1],选择同一时段在西藏民族大学附属医院及西藏自治区第二人民医院就诊的西藏世居者,并根据性别进行分组研究。纳入及排除标准:①男性Hb≥21 g/dL,女性Hb≥19 g/dL;②长期居住在3 650米以上的高原地区;③排除真性和假性以及其他继发性红细胞增多症。
两所医院共招募927名长期居住于3 650米以上无血缘关系的志愿者,其中HAPC患者567例(男性455例,女性112例),纳入病例组;同期匹配健康对照者360例(男性248例,女性112例),纳入对照组。研究内容符合《赫尔辛基宣言》规定并经西藏民族大学医学部伦理委员会批准。
1.2 DNA提取方法
采集3 mL外周血液样本,置于含有乙二胺四乙酸(ethylene diamine tetraaceticacid,EDTA)抗凝的真空采血管中。使用血液基因组DNA提取试剂盒(Tiangen Biotech Co.,Ltd,Beijing,China)按照标准程序分离提取血液基因组DNA样品。DNA纯度和质量通过Nanodrop One分光光度计(Thermo Fisher Scientific Inc.,USA,A260/A280为1.7~2.0)和1.5%琼脂糖凝胶电泳方法确认:电泳条带清晰可见,无明显降解,且无RNA污染。合格样本置-20 ℃冰箱贮存备用。
1.3 基因分型方法
根据目标STAT3、STAT5A、RUNDC3B基因设计高质量的测序引物,以DNA样品基因组为模板,进行多重PCR扩增。反应采用11个循环数的PCR程序,尽可能降低PCR的倾向性。使用Illumina Hiseq(Illumina,CA,USA)平台,以2×150 bp的双端测序模式进行高通量测序,获得基因测序数据。在567例HAPC组和360例对照组中,目的区域95%以上被覆盖,STAT3、STAT5A、RUNDC3B基因的显著相关基因型变异被分型。
1.4 统计学方法
使用SPSS v 26.0软件处理数据。为降低关联分析中的假阳性概率,以最小等位基因频率(minor allele frequency,MAF)≥0.05为筛选标准,采用哈-温平衡(Hardy-Weinberg equilibrium,HWE)法进行SNP质量控制。SNP位点的关联分析采用Pearson卡方检验/Fisher精确检验,并在遗传模型中使用Plink v 2.0软件进行非条件logistic回归分析。多态性位点之间在遗传过程中可能出现连锁不平衡关系,使用 Haploview v 4.2软件[7](https://sourceforge.net/projects/haploview/)进行连锁不平衡(linkage disequilibrium,LD)分析,以此获得存在较强关联性的单倍型域。使用GTEx数据库(https://www.gtexportal.org/home)对显著差异位点进行分析。统计学意义定义为P<0.05。
2.结果
2.1 HWE检验与MAF分布
所有样本最终共检测到11个SNPs位点,SNP位点在对照组中均符合HWE检验(均HWE-P>0.05)。以单个位点为单位,比较各SNP位点的基本信息,见表1。

表1 候选基因SNPs位点基本信息
2.2 遗传模型下SNPs位点与HAPC的关系分析
尽管候选基因SNPs位点在等位基因频率上没有统计学差异,但在遗传模型上分析了筛选出STAT3基因rs2293152位点基因型频率和HAPC发病风险的相关性,发现在隐性模型下,STAT3基因rs2293152位点可能与HAPC患病风险降低有关,携带基因型“G/G”个体的患病风险是携带基因型“C/C-C/G”的0.67倍(OR=0.67,95%CI=0.46-0.97,P=0.035),但该位点经过FDR校正或Bonferroni校正后,差异无统计学差异(PFDR=0.842,PBonferroni=1.000),见表2。其余SNP位点在遗传模型中没有显示出与HAPC风险相关的显著性差异。

表2 STAT3基因rs2293152位点与HAPC风险相关性分析
2.3 连锁不平衡分析与单倍型构建
连锁不平衡分析表明,RUNDC3B、STAT3、STAT5A基因SNPs位点均分别构成了1个单倍型域,表现出显著的连锁不平衡,见图1。然而,HAPC组和对照组之间每个单倍型域的单倍型频率间没有显著性差异。
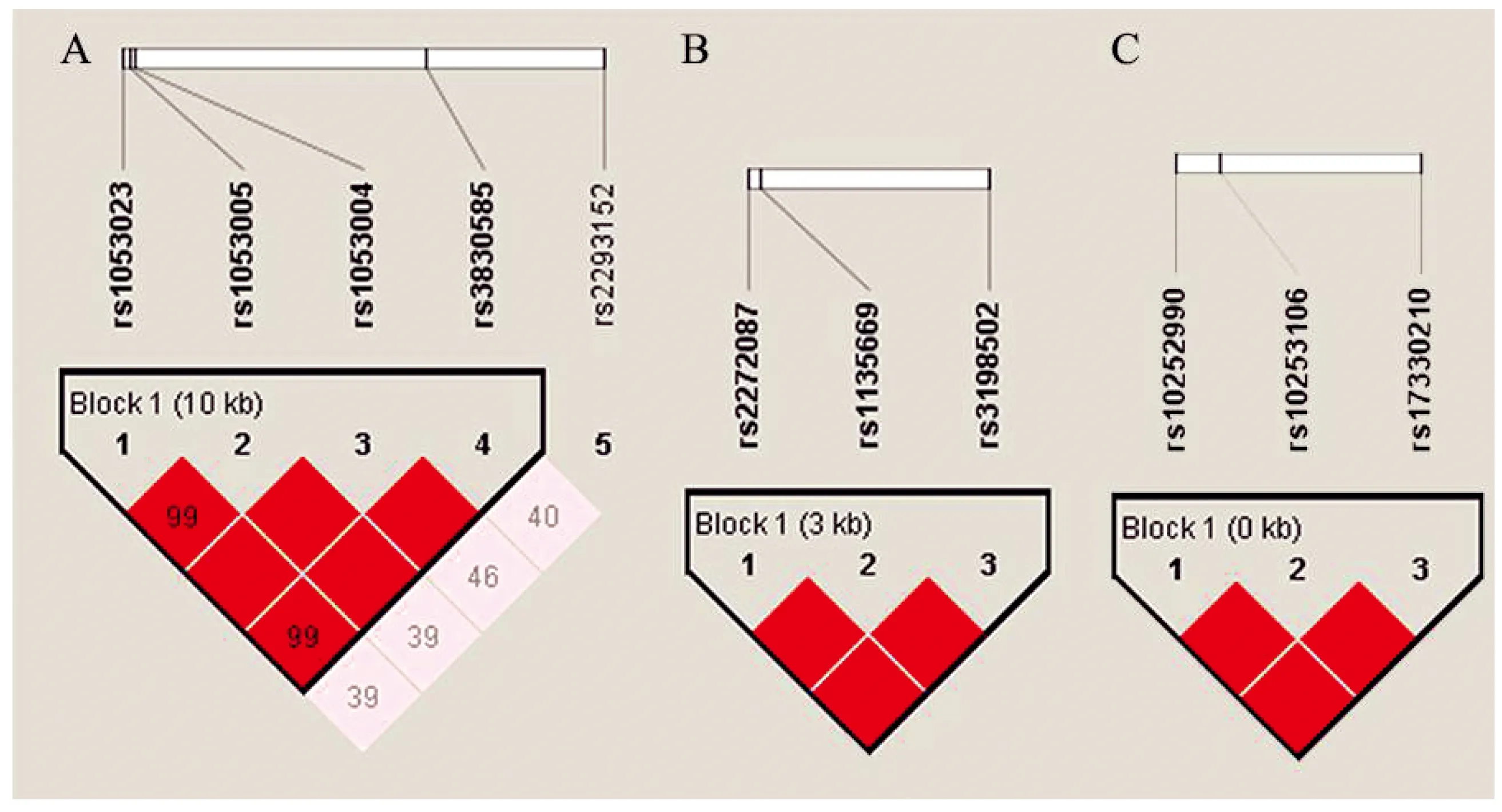
(A)STAT3基因;(B)STAT5A基因;(C)RUNDC3B基因
2.4 性别分层分析
按照受试对象的性别进行分层,HAPC病例组中男性455例、女性112例;同期匹配的健康对照组中男性248例、女性112例。进行遗传模型分析、连锁不平衡分析以及单倍型构建,探究候选基因STAT3、STAT5A、RUNDC3B在性别分层后对HAPC的不同影响。结果显示,各候选基因SNP位点在性别分层后无具有统计学意义的显著性差异。
2.5 GTEx数据库分析
通过GTEx数据库分析,观察到STAT3基因rs2293152位点“GG”基因型在健康人的心脏左心室(P=5.86e-3)及垂体(P=3e-2)中的表达存在差异,见图2。

图2 STAT3基因rs2293152位点在GTEx数据库的表达图谱
3.讨论
现代生物化学技术的发展使很多复杂疾病的遗传机制得到进一步阐明。HAPC是一种在高海拔地区特发的慢性高原疾病,与高原低氧低压环境密切相关,但同一高海拔地区人群的发病率却存在差异,说明遗传因素可能发挥一定作用。本研究对STAT3、STAT5A和RUNDC3B基因采用目标区域靶向测序,并对测序结果做进一步统计学分析,发现STAT3基因rs2293152位点的“GG”基因型在隐性模型下能降低HAPC的患病风险,而STAT5A和RUNDC3B基因的多态性与HAPC患病风险可能无关。
造血过程中,各种细胞因子和生长因子在细胞周期检查点中起着至关重要的作用。信号转导和转录激活因子(STAT)蛋白是一个由7个成员(STAT1~4,STAT5A/B和STAT6)组成的细胞质转录因子家族。每一个家族成员在信号转导方面都具有独特的功能,在调节细胞对不同类型细胞因子的反应方面扮演着重要角色[8]。人类STAT3基因位于染色体17q21.2区域,发生功能获得性突变时会使患者表现为红细胞生成障碍,引起血影蛋白缺乏症,最终可能导致重度难治性溶血性贫血[9]。携带STAT3基因突变在同时患有纯红细胞再生障碍性贫血和T细胞大颗粒淋巴细胞性白血病的病人中很常见。靶向敲除STAT3基因的小鼠血液表型与过早衰老和骨髓增生性肿瘤(如红系异常增生、贫血等)疾病的表型相似[10]。非磷酸化的STAT3具有促进肺癌细胞异染色质形成、体外抑制细胞增殖以及抑制小鼠异种移植物中肿瘤生长的功能[11]。造血系统中STAT3具有内在的抗炎活性,能保护造血干细胞和祖细胞对抗炎症和不适当的基因表达反应,对维持血液细胞谱系平衡至关重要[12]。缺氧条件下,细胞通过STAT3信号通路促进间充质干细胞成骨分化和骨质缺损愈合,下调STAT3通路可抑制人骨肉瘤细胞的生长并诱导其凋亡[13]。此外,许多研究者认为铁的失调与多种疾病有关,铁可以通过激活CDK1/JAK1/STAT3信号通路引起肿瘤细胞过度增殖。巨噬细胞分泌因子通过STAT3信号诱导肝细胞内铁调素的表达增加[14]。
内脂素能影响血脂代谢调节,与缺氧、炎症及血管增生等多种病理因素有着紧密联系。Kaliora A等[15]研究发现,携带STAT3 rs2293152 G等位基因能导致内脂素(visfatin)水平显著增加,对脂肪性肝病患者产生有益影响。在本研究中,我们发现STAT3基因rs2293152位点的“GG”基因型在隐性模型下能降低HAPC的患病风险。我们推测HAPC患者内脂素水平可能也发生了一定变化,从而在缺氧环境中起到部分保护性作用。另一方面,STAT3基因rs2293152的具体作用机制尚不完全明确,对亚洲人群中的Meta分析显示,STAT3基因rs2293152位点在隐性模型中与多种癌症的发生有显著性关联(OR=1.19,95%CI=1.02-1.38)[16]。GTEx数据库显示,STAT3基因rs2293152位点“GG”基因型在左心室和垂体中的表达存在差异,该位点可能间接影响左心室射血分数,导致血容量发生一定变化,从而影响血氧含量。而垂体能调节雌激素分泌,雌激素在慢性缺氧条件下对红细胞生成的调节有重大影响[17],这种影响对HAPC可能发挥某种遏制作用。
当促红细胞生成素与其受体结合时,受体相关JAK2信号通路会激活STAT5,使应激性红系组细胞增殖与分化[18]。STAT5A/B是一个紧密相关的染色体并列基因编码,这两种蛋白在正常的造血过程中都起着重要作用。其中STAT5A的磷酸化水平决定了红细胞生成的速率,进而调节红细胞生成,对造血干细胞的增殖和转化起到一定的调节作用[19]。此外,STAT5A可以促进增殖蛋白的产生和释放,刺激内皮细胞迁移,促进血管生成[20]。这种STAT5A效应可能参与了HAPC相关血管生成功能通路的激活。本研究暂未发现STAT5A基因与HAPC患病风险显著相关的SNP位点,其原因可能是STAT5的高度活化虽然主要导致红细胞生成,但这种效应的持续性或较为短暂。RUNDC3B基因编码Rap2互作蛋白-9,其功能尚不明确,在正常的睾丸、肾上腺和大脑中呈高水平表达,而在正常乳腺中则呈低水平表达[21]。RUNDC3B基因的表达水平与孕激素的表达水平呈显著正相关[22],乳腺恶性上皮细胞RUNDC3B的活化随侵袭性表型的进展而增加[21],这种过表达与乳腺恶性肿瘤预后不良相关。此外,RUNDC3B基因位于ABCB1基因的扩增子区域,由ABCB1基因的互补DNA链转录而来,可能干扰ABCB1基因启动子调控的交替调控[23]。本研究发现的RUNDC3B基因SNPs与HAPC患病风险不相关,这可能是由于RUNDC3B基因恰好位于ABCB1基因的特殊位置,ABCB1基因削弱或抵消了前者促进红细胞生成的作用。
综上所述,STAT3基因rs2293152位点可能作为保护因素,参与西藏世居高原人群HAPC发生过程,对HAPC的发展起到一定的遏制性作用。
