血栓性抗磷脂综合征7例回顾性分析
2021-12-29尹园园任慧玲
尹园园 ,任慧玲
(河北医科大学第三医院 神经内科, 河北 石家庄 050051)
抗磷脂综合征(antiphospholipid syndrome, APS)是一种全身性疾病,临床特征是广泛的血栓形成和与持续存在的抗磷脂抗体(antiphospholipid antibodies, aPL)相关的产科并发症[1]。诊断APS的实验室标准包括抗心磷脂抗体(anticardiolipin antibodies, aCL)、抗β2-糖蛋白I抗体(β2glyco-protein I, β2-GPI)和(或)狼疮抗凝剂(lupus anticoagulant, LA)的存在[2]。APS可以独立发生,称为原发性APS,也可以发生在另一种自身免疫性疾病的背景下,最常见的是系统性红斑狼疮(systemic lupus erythematosus, SLE)[3]。一些研究表明,每年每10万人中会新增5例APS患者,每10万人中有40~50例APS患者[4]。10%的健康献血者aPL呈阳性,1%的LA呈阳性,而1年后只有不到1%的人测试阳性。在健康人身上很难发现高危的aPL,所以APS的诊断需要严格定义临床事件和aPL阳性[5]。
APS是获得性血栓最常见的原因,约占50岁以下人群发生下肢静脉血栓的10%~15%,脑血管意外的1/3[6]。血栓性APS也是年轻人发生血栓事件的常见病因。本文回顾了7例血栓性APS患者临床表现和治疗经过,并整理分析了血栓性APS的相关文献,以增加对该病的诊断,治疗及预后的认识。
1 资料与方法
1.1病例选择 选择 2019年1月至 2020 年11月收治的河北医科大学第三医院血栓性APS患者7例,诊断符合2006年Sapporo最新APS诊断标准:至少同时符合1条临床诊断标准和1条实验室诊断标准,前者包括临床出现血管栓塞或病态妊娠事件;后者包括2次或2次以上(每次间隔至少12周)血浆LA阳性,血清或血浆aCL、抗β2-GPI阳性。男4例,女3例,年龄26~ 64岁,平均39.25岁;病程为2 d~ 3年,病程中位数为1.5年。
1.2方法 回顾性分析7例患者的首诊科室、既往史、临床表现、血清aPL及相关指标、神经影像学检查、超声等相关辅助检查,治疗及预后。
2 结 果
2.1临床特点 7例患者中,急性起病(≤1个月)2例,亚急性起病(1~3个月)2例,慢性起病(≥3个月)3例。既往有脑梗死2例,偏头痛1例,下肢深静脉血栓1例,SLE 2例,强直性脊柱炎1例, 干燥综合征1例。4例为下肢动静脉血栓形成,3例为脑梗死,其中2例行颅脑CT、DWI及 MRA检查,见表1,图1~2。

表1 7例血栓性APS的临床特点
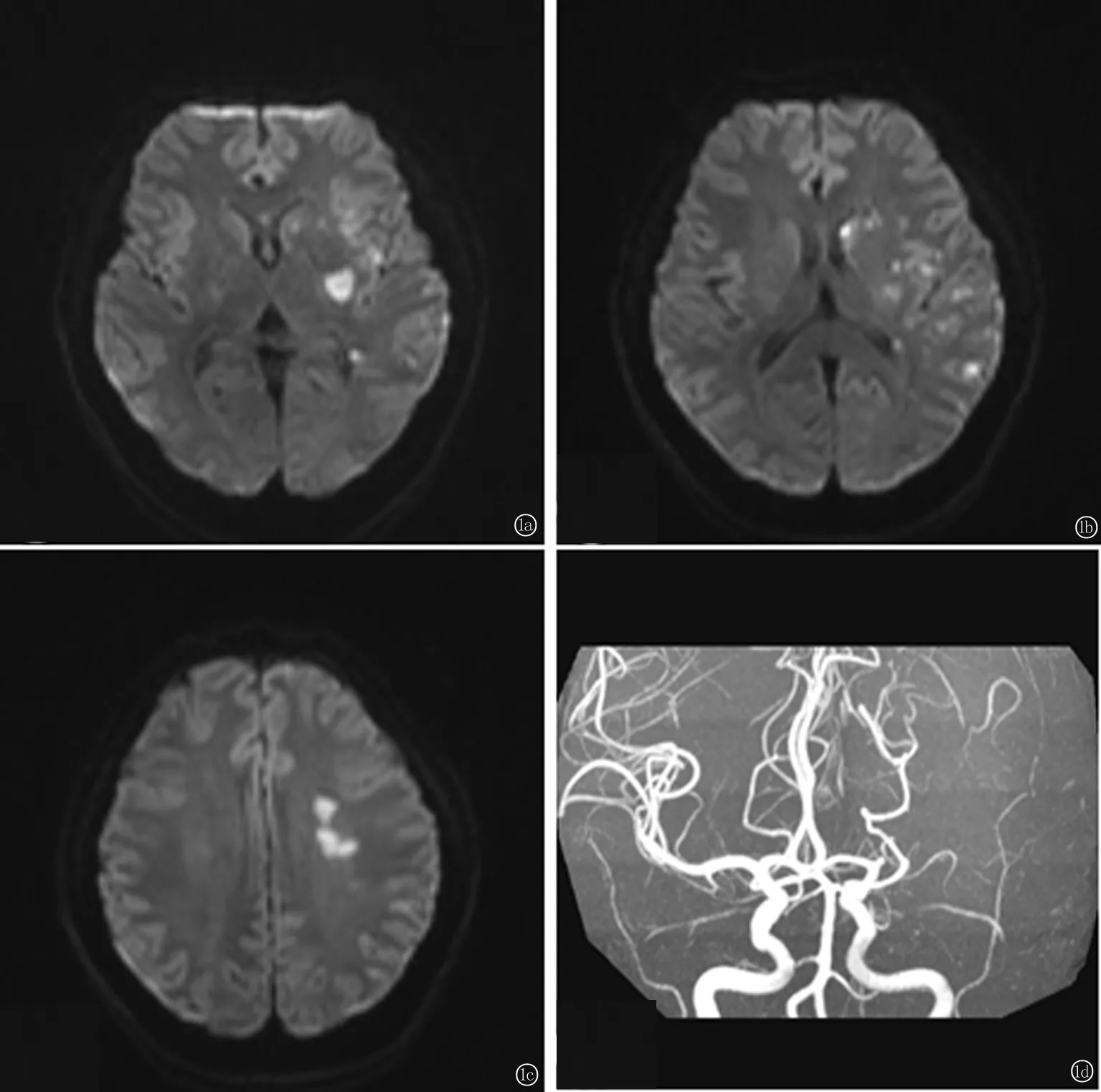
图1 血栓性APS患者(30岁,男性)神经影像学检查 a~c:颅脑DWI示左侧顶叶、尾状核头、侧脑室体旁可见高信号;d:头颅MRA检查结果示左侧大脑中动脉重度狭窄
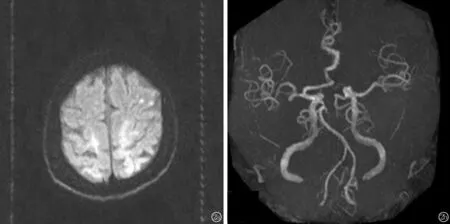
图2 血栓性APS患者(64岁,女性)神经影像学检查 a:颅脑DWI示左侧顶叶;b:头颅MRA检查结果示动脉硬化
2.2aPL及治疗 7例患者均行aCL、抗β2GPI及LA检测,5例三项均升高, 2例一项升高。具体治疗及转归见表2。

表2 7例血栓性APS生化、影像学特点及治疗转归
3 讨 论
血栓性APS可以累及从动脉到静脉,从大血管到微血管的各级血管,所以本研究中的7例血栓性APS的患者,临床表现多样,首诊于血管外科,免疫风湿科等多个临床科室。我们应在某些情况下考虑到APS的存在并做aPL的检查,从而早期诊断,避免灾害性APS的发生,见表3。APS的病因包括自身免疫性疾病、肿瘤、感染和炎性反应等,在自身免疫性疾病中,尤其是SLE,但只有1/3的患者最终会出现血栓性APS[7]。文献报道SLE合并APS的发生率为20%~50%[3]。本组7例患者中有2例为SLE继发APS。
国外有研究结果显示,APS患者中血栓发生率最高的是深静脉血栓,占31.7%,脑梗死发生率为13.1%[8]。本文回顾分析了7例以动脉和静脉血栓为表现的APS, 下肢深静脉血栓发生率高,其次是脑梗死。aPL是针对凝血活化和补体活化而活化或受损的内皮细胞、单核细胞、血小板和中性粒细胞的致病性抗体。动脉粥样硬化和aPL介导的T细胞反应被认为是动脉血栓形成的原因。斯洛文尼亚的一项单中心前瞻性研究发现,aPL是脑血管事件、高脂血症以及动脉高血压的独立危险因素[9]。持续阳性的aPL与脑血管事件之间存在显著关联。两项纵向随访研究证实,aPL 3种抗体均为阳性与血栓形成风险增加有很强的相关性[10-11]。研究表明aPL通过[12]:①干扰内源性抗凝机制(破坏膜联蛋白A5的抗凝屏障,抑制蛋白C途径,抑制抗凝血酶);②血小板的结合和激活;③诱导内皮细胞中黏附分子和组织因子的表达;④激活补体级联,从而导致血栓前状态。本组7例患者中有5例aPL 3种抗体均为阳性,2例为下肢深静脉血栓形成,1例为下肢动脉血栓形成,2例为颅内动脉血栓形成。

表3 抗磷脂抗体检测
血栓性APS可累及动脉、静脉及微血管,微血管闭塞作为APS的表现较少受到重视。它们通常是严重的、快速进行性的灾难性APS的一部分,也可能发生在孤立的和更慢性的表现中[13]。灾难性APS的特征是快速进展(几天到几周)的多器官衰竭,以及由于广泛的小血管血栓形成而导致的高相关病死率[14]。本组1例患者1周内病情进展极快,累及肾脏、心脏、肺以及脑,并且aPL 3种抗体均为阳性,考虑可能为灾难性APS(图2),该患者颅脑MRA未见明显狭窄,由于患者病情严重未进行DSA检查。本组7例患者中有1例累及大脑中动脉(图1)。一项研究中提到在55例APS患者中,其中25例患有缺血性卒中,最常见的闭塞部位是大脑中动脉(31%)[15]。Ricarte等[12]提到APS的神经影像异常有脑梗死、脑白质高信号以及脑萎缩。有关APS脑梗死影像特征没有太多报道,此后需要大量样本去探索。
欧洲抗风湿病联盟建议,无论是原发性还是继发性,对aPL阳性患者的管理首选以患者为中心筛选高危aPL患者,包括aPL三重阳性、LA、持续高APL滴度、血栓性和(或)产科APS病史、其他自身免疫性疾病如系统性红斑狼疮的存在以及传统心血管危险因素的共存。其次是一级预防,严格控制心血管危险因素、静脉血栓形成危险因素的筛选和处理以及在高危情况下使用低分子肝素,如手术、住院、长时间制动和产褥期。针对血栓性APS患者的一级预防,对于无症状的高危aPL携带者(不符合任何血管或产科APS分类标准),有或没有传统危险因素,推荐使用小剂量阿司匹林(low dose aspirin, LDA)每天75~100 mg预防性治疗。再次为二级预防,若APS患者第一次发生静脉血栓:建议使用目标INR为2~3的维生素K拮抗剂(vitamin k antagonist,VKA)治疗。若APS发生第一次动脉血栓形成的患者中:推荐使用INR 3~4的VKA治疗或VKA(INR2~3)加(LDA)治疗。在使用INR为2~3的VKA治疗(有很好的依从性) ,但仍反复发生血栓者可以考虑将INR目标提高到3~4,加用LDA或改用低分子肝素(low molecular weight heparin,LMWH),见图3。
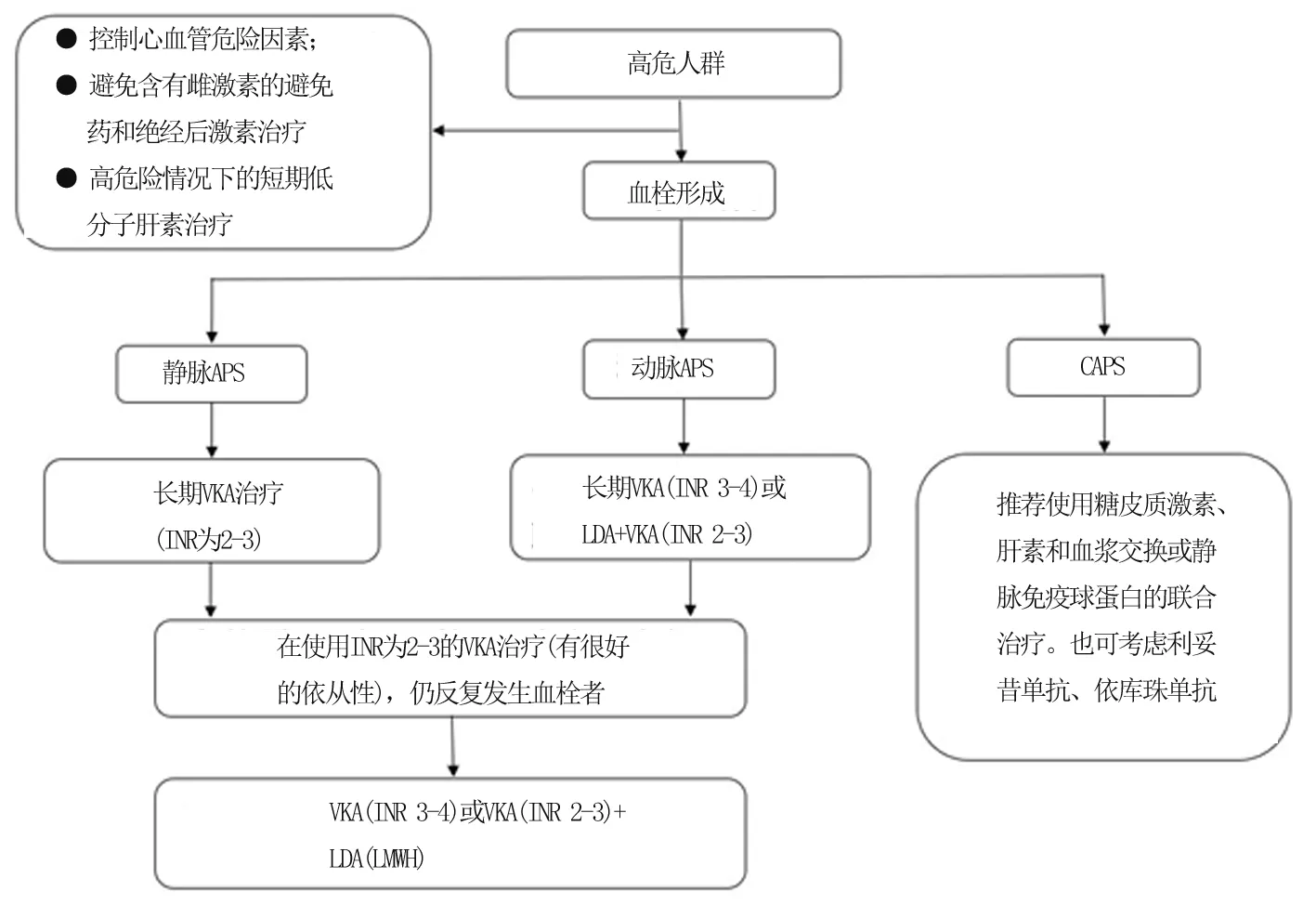
图3 高危人群血栓性APS治疗原则[18] 注: INR: international normalized ratio, 国际标准化比率;LDA: low dose aspirin, 小剂量阿司匹林;LMWH: low molecular weight heparin, 低分子肝素;VKA: vitamin k antagonist, 维生素K拮抗剂
直接口服抗凝剂(direct oral anticoagulant, DOAC)已迅速成为VKA的诱人替代品,常用的DOAC有达比加群,利伐沙班。与VKA相比,DOAC的主要优势在于其固定剂量的给药方案,更快速和可预测的抗凝反应,不需要实验室监测凝血试验,减少重大出血和颅内出血,以及更少的药物-药物和药物-食品相互作用[16]。目前针对利伐沙班是否是治疗APS中VKA的有效和安全的替代品,研究者开展了3项随机对照试验。根据试验结果,欧洲药品管理局建议不要对APS患者使用DOAC,特别是对那些三重阳性的患者。欧洲抗风湿病联盟也建议不要在三重阳性的APS患者中使用利伐沙班[17]。
本研究中1例患者因为病情迅速进展,累及到脑、肾、肺,全血细胞下降而诊断为可能灾难性APS,患者除了应用常规抗凝治疗外,而使用激素冲击治疗。根据欧洲抗风湿病联盟成人APS治疗建议对于灾难性APS治疗,推荐使用糖皮质激素、肝素和血浆交换或静脉免疫球蛋白的联合治疗。也可考虑利妥昔单抗、依库珠单抗[17]。2例LA阳性的APS应用利伐沙班。
血栓性APS的特点是静脉、动脉或微血管血栓形成,是一类异质性很强的疾病。脑循环是最常受影响的动脉领域,血栓性APS的治疗应该评估血栓的风险,分层治疗。
