癌症疼痛患者阿片类药物剂量计算的临床推荐
2021-12-29赵阳昱张程亮谢永忠褚倩
赵阳昱,张程亮,谢永忠,褚倩
(1.黄山市人民医院药剂科,黄山 245000;2.华中科技大学同济医学院附属同济医院药学部,武汉 430030;3.华中科技大学同济医学院附属同济医院肿瘤中心,武汉 430030)
疼痛是肿瘤患者最常见的并发症之一,从生理、心理等多个方面给患者带来痛苦。阿片类药物具有镇痛作用强、用药剂量无天花板效应的特点,目前已成为肿瘤患者中、重度疼痛的一线治疗药物。大多数患者单药治疗即可达到满意的疗效,但是仍然有20%~25%的患者并不能得到有效的疼痛缓解[1-2]。由于晚期肿瘤患者病情复杂,阿片类药物存在较大的个体差异和不良反应,在实际应用过程中需要根据病情制定个体化给药方案,以获得镇痛效果好、不良反应小的最佳治疗效果。其中,阿片类药物在临床中根据不同情况进行剂量计算或调整是医师和药师在癌症疼痛(简称癌痛)规范化治疗中的常规且非常重要的工作[3]。目前临床上常用的阿片类药物剂量计算包括初始给药剂量滴定,爆发痛药物剂量计算,不同阿片类药物之间的剂量换算,肝、肾功能不全患者的给药剂量调整等。笔者就阿片类药物在不同的治疗方案中如何选择合适的剂量进行综述。
1 阿片常规治疗的剂量计算
根据WHO的推荐,阿片类药物作为中、重度癌痛患者的疼痛治疗应当遵循首选口服给药、缓释制剂为基础按时给药、即释制剂控制爆发性疼痛、根据疼痛的控制情况个体化调整给药剂量的治疗原则。其中涉及到的常规剂量计算如下。
1.1阿片滴定 由于阿片类药物存在较大的个体差异,因此需要通过滴定来确定未耐受/耐受患者的最佳给药剂量。FDA对阿片类药物耐受的定义为:口服吗啡60 mg·d-1或羟考酮30 mg·d-1,每小时芬太尼透皮贴剂25 μg,或使用等剂量的其他阿片类药物,持续1周或更长时间即为阿片类药物耐受[4-5]。短效阿片类药物滴定法推荐:对于阿片类药物未耐受患者,口服即释吗啡5~10 mg;对于阿片类药物耐受患者,口服前24 h给药总剂量的10%~20%,并在给药后60 min评估疗效和不良反应,计算出有效控制疼痛所需服用阿片类药物的24 h总量,根据需要再转换为缓控释制剂。
短效阿片类药物滴定法滴定过程较繁琐,滴定周期较长,欧洲姑息治疗学会发布的《欧洲癌痛阿片类药物治疗镇痛指南》[6]推荐吗啡、羟考酮的短、长效制剂均可用于滴定,张力[7]和梁军[8]等结合临床经验制订了以缓释吗啡10~30 mg,或缓释羟考酮10~20 mg(中度疼痛10 mg,重度疼痛20 mg)为背景的阿片类药物未耐受患者滴定方案,取得了满意效果。对于阿片类药物耐受患者,则推荐直接将前24 h阿片类药物总剂量换算等效剂量缓释吗啡或缓释羟考酮,分成2份,每12 h给药。
1.2爆发痛药物剂量 癌症爆发痛(breakthrough cancer pain,BTcP)在肿瘤患者中发生率高,为40%~80%[9],目前国际上并无统一的定义,2009年英国和爱尔兰姑息医学协会的观点被普遍认可,其认为BTcP是基础疼痛控制充分、稳定的癌痛患者自发或由触发因素(可预料或不可预料)引起的短暂疼痛加重[10]。BTcP具有疼痛强度高、不可预测的特点,应尽早给予速效阿片类药物,目前常用的速效阿片类药物有口服吗啡即释片,静脉给药制剂和新型速效阿片类药物(rapid-onset opioids,ROOs)。口服吗啡即释片30~40 min开始产生镇痛效应,1 h达到最大镇痛效果,镇痛持续3~4 h,超前给药可以有效降低事件性BTcP的发生率。但典型的自发性BTcP达峰时间数分钟,疼痛持续30~60 min,疼痛的病程与口服吗啡即释片的药动学和药效学并不符合,此时选择静脉制剂或ROOs控制效果更佳。BTcP的口服或静脉药物用量建议为每日阿片类药物总量的10%~20%,如果24 h爆发痛次数>3次,需增加背景痛的药物剂量[11]。
ROOs是基于芬太尼的黏膜制剂,起效迅速,镇痛效果强,符合BTcP的发作特点。临床研究发现ROOs临床疗效优于阿片类口服制剂,在治疗BTcP时患者满意程度高,36%患者在给药5 min内疼痛控制,68%患者在给药10 min内疼痛控制,95%患者在给药15 min内疼痛控制[12-13]。但由于临床研究有限,ROOs的起始给药剂量尚存争议,推荐从小剂量开始,通过滴定达到治疗剂量。不同ROOs的释药特性和作用特点见表1,临床医务人员可根据不同剂型特点选择合适的药物并根据上述爆发痛剂量确定原则进而确定剂量。
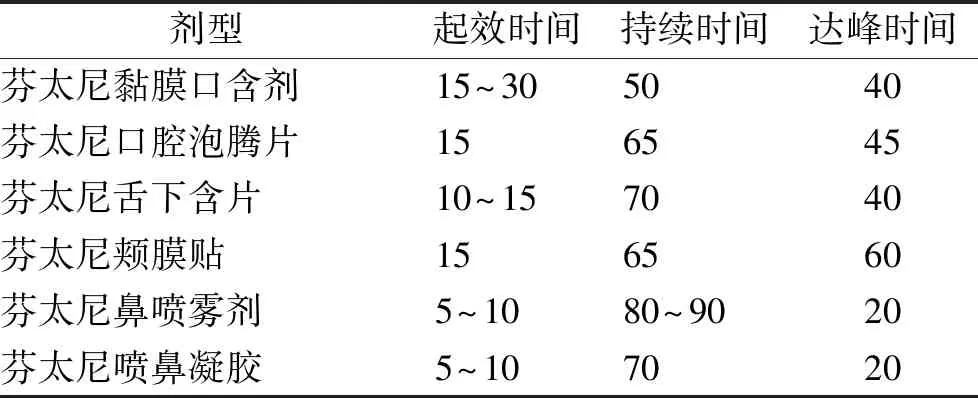
表1 不同ROOs的药物特性 Tab.1 Drug characteristics of different ROOs min
1.3阿片减量 随着化学治疗(化疗)、靶向治疗、免疫治疗等各种抗癌技术和镇痛药物临床治疗的不断进步,越来越多的患者在治疗中病情得到缓解,疼痛亦得到有效控制,但癌痛治疗中阿片依赖问题依然突出。 AHMED等[14]研究发现,逐渐停药法可有效降低阿片依赖的发生率。美国疼痛医学学会推荐[15]每天减少日剂量的10%,每3~5 d减少日剂量的20%,每周减少日剂量25%,直至日剂量相当于口服吗啡30 mg的药量,继续服用2 d后即可停药。美国退伍军人事务管理局于2003年提出的递减方案[16]则区分了短效阿片类药物和长效阿片类药物,短效阿片类药物每3~7 d减少剂量的10%,长效阿片类药物每天降低20%~50%直至日剂量为45 mg·d-1,然后每2~5 d减少15 mg,直至停药。
2 阿片类药物剂量转换
2.1不同阿片类药物之间剂量换算 当疼痛或毒副作用使得患者无法维持某种阿片药物治疗时,更换阿片种类或者剂型是一种更好的选择。理论上从一种阿片类药物转换为另一种阿片类药物需要重新滴定,但是从临床治疗的便利性出发,目前最常采用的转换方法仍然是以吗啡为参照,通过不同阿片类药物与吗啡进行等效镇痛剂量换算。等效剂量的换算从一些采用快速滴定方案的交叉性研究结果中获得,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)《成人癌痛临床指南(2020.V1版)》[17]基于此提供了不同阿片类药物口服及肠外给药的等效剂量以及相对效能换算表,见表2。此方法清晰明了,换算公式简洁,被广泛用于阿片药物之间的剂量换算。
然而,阿片类药物在个体间存在较大的差异性,例如硫酸吗啡的个体生物利用度差异范围为15%~64%。不同药物之间的换算也并非一个固定比例,研究发现口服吗啡与羟考酮的等效转换比例可能为(1:1)~(2:1)[18-19];BRUERA等[20]研究发现,吗啡与美沙酮之间比例为(1:1)~(4:1)。因此,表2与阿片类药物临床实际转换间所取得的效果难免存在差异,在临床实际进行阿片类药物转换应用中,需要结合患者自身情况实施个体化评估和剂量调整。此外,考虑到阿片类药物的不完全交叉耐药性,当需要通过阿片转换使疼痛得到有效控制时,应减量25%~50%。如果之前的阿片剂量无效,可给予100%的等效镇痛剂量或加量25%[17]。
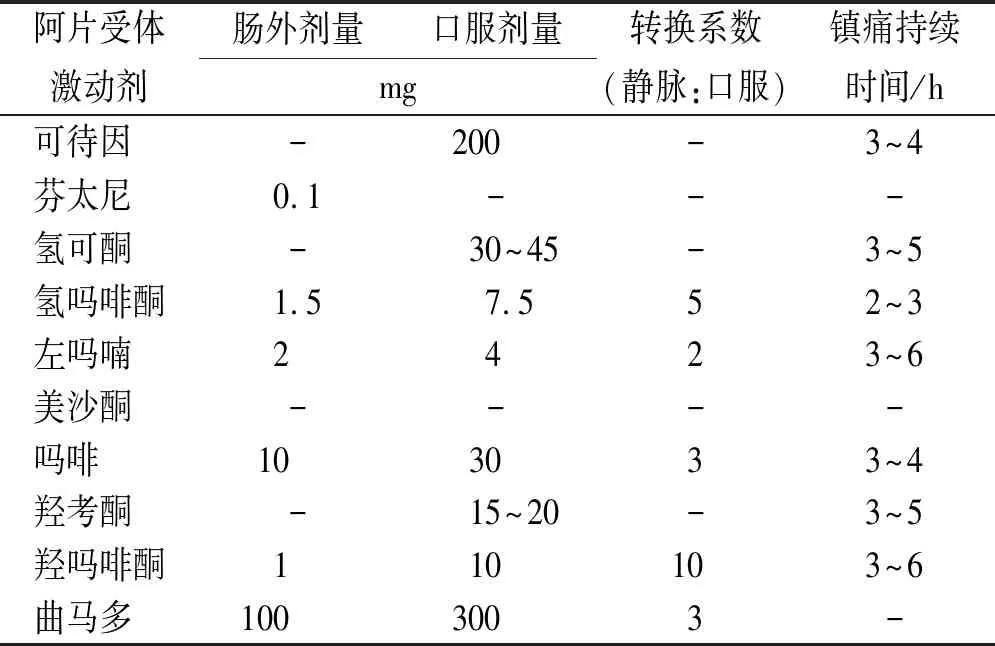
表2 不同阿片类药物口服及肠外给药的等效剂量以及相对效能换算 Tab.2 Conversion of equivalent doses and relative efficacy of different opioids for oral and parenteral administration
2.2不同阿片类药物剂型的剂量换算 临床上常用的阿片类药物剂型包括即释剂型,缓释剂型如吗啡缓释片、羟考酮缓释片和芬太尼透皮贴剂以及阿片复方制剂。KLEPSTAD等[21]研究发现,吗啡即释片与吗啡缓释片在轻中度癌痛患者的镇痛治疗效果上无明显差异。MUCC-LORUSSO等[22]的研究结果表明,吗啡控释片与羟考酮控释片显示出了相似的镇痛效应和便捷度。起始使用即释阿片类药物进行滴定的癌痛患者,24 h后即可转换为等效剂量的口服缓释阿片类药物。因此,目前对于吗啡和羟考酮即释和缓释口服剂型,临床认为剂量可等同。然而,在治疗应用中需注意部分缓释剂型具有独特的镇痛特征,如羟考酮控释片具有双相释放,双相吸收的特点(38%即释,62%缓释),因此既能迅速控制疼痛,也能持续缓解疼痛。
当临床上给予阿片类药物联合非甾体类药物镇痛治疗时,所有的非甾体类药物参照日最大剂量等效于5~10 mg口服吗啡剂量进行换算[23]。氨酚羟考酮(羟考酮5 mg:对乙酰氨基酚325 mg)是临床上较为常见的一种阿片类复方制剂,理论上氨酚羟考酮转化为其他阿片类药物需要重新滴定,但临床上有观点认为对乙酰氨基酚325 mg可以等效为口服吗啡3.25 mg,因此氨酚羟考酮可以等效为口服吗啡10.75~13.25 mg,或口服羟考酮6~9 mg[24]。
芬太尼透皮贴剂与其他阿片的剂量换算是临床癌痛患者药物治疗的重要工作,虽然该药说明书里给出了芬太尼透皮贴剂与吗啡的等效镇痛换算剂量,但通过7年临床应用的随访观察发现,至少有一半使用了说明书推荐换算剂量的患者,口服吗啡转换为芬太尼透皮贴剂时镇痛剂量不足,而从芬太尼透皮贴剂转换为口服吗啡时镇痛剂量过高[25]。因此,NCCN(2020.V1)指南推荐不同阿片类药物通过等效剂量转换为吗啡,再根据200 mg·d-1口服吗啡=100 μg·h-1芬太尼透皮贴剂的比率进行换算[17]。
3 肝、肾功能不全患者的阿片类药物剂量计算
许多阿片类物质通过肝脏氧化或葡萄糖醛酸化代谢,葡萄糖醛酸化是发生在肝脏内的一种解毒途径,葡萄糖醛酸与底物结合产生水溶性的代谢产物从体内排泄[26]。通过葡萄糖醛酸代谢的阿片类药物有吗啡、氢吗啡酮等,而芬太尼、曲马多、美沙酮等主要经细胞色素P450(CYP)酶系统代谢。当肝功能出现异常时由于首关作用的减少以及肝脏清除率的降低,口服阿片类药物的生物利用度显著增高[27],吗啡、氢吗啡酮等口服阿片类药物可能因药物蓄积,进而产生一系列神经毒副作用。 肝损伤患者使用阿片类药物的剂量调整见表3[28]。中、重度肝功能不全时,吗啡、羟考酮等阿片类药物应当禁用,芬太尼透皮贴剂是相对安全的选择,同时密切监测药物的不良反应[3]。
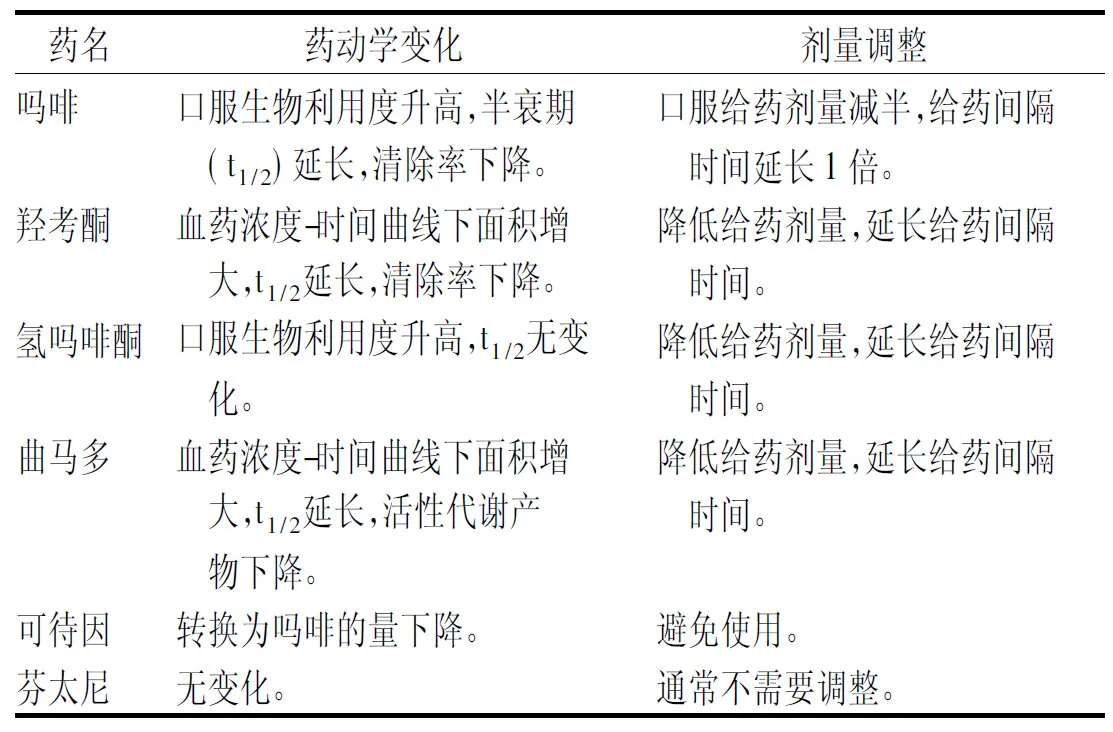
表3 轻度肝功能不全时阿片类药物的剂量调整 Tab.3 Dosage adjustment of opioids in the paitents with mild hepatic insufficiency
约60%肿瘤患者肌酐清除率(creatinine clearance rate,CCR)<90 mL·min-1,20%肿瘤患者CCR<60 mL·min-1[29]。肾功能不全会影响阿片类药物的消除并导致阿片类药物母体或代谢产物在体内蓄积,根据肾功能情况合理调整给药剂量可以在保证疗效的同时降低毒副作用。目前国际上最常用的是以肾小球滤过率数值为标准的慢性肾功能不全分级,根据肾功能分级,对阿片类药物进行剂量调整,见表4[30]。

表4 肾功能不全时阿片类药物给药剂量调整 Tab.4 Dosage adjustment of opioids in the paitents with renal insufficiency
4 结束语
尽管阿片类药物在临床的治疗使用已有很长时间,但如何准确合理地给药仍然有待更多的临床研究。NCCN指南提供了详细的阿片类药物滴定和爆发痛治疗原则,对肿瘤患者的阿片类药物维持治疗提供重要参考依据。欧洲姑息治疗学会推荐长效阿片类药物可以直接滴定,简化了滴定的步骤,为临床快速滴定带来了极大的便利。然而由于患者在长期接受阿片类药物治疗中逐步产生的药物耐受性,以及治疗过程中出现的药物不良反应,单一阿片类药物剂量滴定并不能满足绝大多数患者的疼痛治疗,此时需要进行阿片类药物转换。上述的一些阿片剂量计算方法在临床被广泛应用和推广,取得了一定的效果。但值得注意的是,阿片类药物转换治疗的成功率仅为40%~80%[12]。由于相应的循证医学依据较少,特别是在面对复杂的临床治疗背景下,目前并无一个绝对统一的阿片类药物转换剂量标准[31]。临床医师或者药师需要认识到阿片类药物之间的转换率不应仅仅是一个公式计算,还应该进行更全面的评估,包括评估临床症状、疼痛原因、不良反应强度、合并疾病和药物相互作用,并排除任何可能会限制药物疗效的其他因素[32],例如糖皮质激素的使用可能会导致阿片类药物的转换率下降,肾衰竭患者使用亲水性的阿片类药物,可能需要更高的转换比率[33]。同时还需注意,因阿片类药物不良反应不耐受进行的阿片转换,可能需要较低的转换率,而因疼痛难以控制进行阿片转换时,可能需要更高的转换率[6]。此外,不同的疼痛类型也会影响阿片类药物的转换效果,相比于复杂性癌痛,急性癌痛患者接受阿片药物转换治疗效果更好[34-35]。当患者出现痛觉过敏时,增加原阿片类药物给药剂量并不能提高镇痛效果,相反会增加药物的不良反应,此时阿片药物转换是最适合的治疗方案[36]。同样对于合并有神经病理性疼痛的癌痛患者,通过阿片药物转换也可能难以达到满意的疗效,此时应考虑联合用药[37]。
综上所述,阿片类药物的个体化剂量确定需要根据不同的镇痛阶段、不同药物或剂型、患者的病情和药物反应以及肝肾功能等综合考虑。目前临床主要依据癌痛相关指南推荐的阿片剂量滴定和调整方案。然而,该领域尚有待更多的大规模随机对照临床试验来充实循证医学证据,从而进一步完善阿片类药物在癌痛患者中的精准治疗。另外,由于临床病情变化的复杂多样,一些难治性癌痛仍缺乏准确的评估工具和治疗方案,也有待进一步研究,促进癌痛规范化治疗。
