次氯酸钠消毒剂对水体沉积物细菌群落的影响
2021-12-28苏静娴卫文锋郑晓婷张诗颖倪小婷
苏静娴 ,卫文锋 ,夏 如 ,郑晓婷 ,张诗颖 ,倪小婷 ,王 雨
(1.广州大学 大湾区环境研究院,广州 510006;2.广州大学 环境科学与工程学院,广州 510006)
目前全球范围内的新型冠状病毒肺炎疫情仍十分严峻[1],消毒作为切断病毒传播途径的重要手段,在疫情防控中发挥了重要作用[2]。含氯消毒剂溶于水后产生次氯酸,具有杀灭细菌、病毒、真菌、结核杆菌等微生物的特性,可用于公共空间的消毒[3]。然而,目前也存在消毒剂大量甚至过度使用的现象,可能导致残余的消毒剂经过雨水冲刷等方式流入排水管道、河流、湖泊等水体,对水体沉积物中的微生物生态系统造成影响[4]。
沉积物是河流生态系统的重要组成部分。沉积物孔隙水是污染释放的主要途径[5],其与上覆水之间存在着吸收和释放的动态平衡,可成为水体中污染物的源或汇[6]。当消毒剂进入水体中,消毒剂的杀菌作用可能会影响沉积物中微生物的群落结构[7]。沉积物中的微生物群落在水体自净过程中也发挥着重要的作用[8]。当沉积物中的微生物生态系统受到影响时,水体的自净能力也会随之改变。例如残余的含氯消毒剂流入可导致河流中硝化菌群的缺失,破坏水中氨氮-亚硝酸盐-硝酸盐的循环体系,降低水体自净能力,对水生环境与生态系统造成危害[9]。也有研究表明含氯消毒剂不仅能够杀死环境中的病毒、污水中的有害生物,还能够杀死水体中的有益生物,过度消毒会危害水生态环境[3]。类似研究也证实了含氯消毒剂进入水环境中后,反应生成消毒副产物,多种消毒副产物具有明确的细胞毒性和基因毒性以及潜在致癌作用等危害,同时消毒副产物可能进入底泥,可能会严重影响沉积物中微生物的群落结构[10]。例如2003年非典期间,由于过度消毒,台湾淡水河及其支流被倒入了大量漂白水等含氯消毒剂,导致含氯量过高,鱼群大量死亡,直到半年后才恢复正常,对河流生态系统产生了明显冲击[3]。然而,大部分此类研究的重点为水体环境和水质指标,针对消毒剂对沉积物中微生物群落结构与微生物生态的影响缺乏系统研究。
因此,本文针对消毒剂流入水体后,可能对沉积物中微生物群落造成的影响,通过采集潜在的受纳河涌与景观水体的沉积物样品,加入含氯消毒剂开展模拟实验,采用高通量测序技术分析消毒剂流入水体后对沉积物微生物群落造成的影响,以期对消毒剂的生态影响与规范使用提供科学参考。
1 材料与方法
1.1 样品采集
沉积物样品采集选择在广州市区开展。根据水体周边环境、水质状况及水体交替速率,本研究选择了广州大学城某河流、广州大学城中心湖及某住宅区景观水体进行沉积物样品采样,分别命名为River-1、Lake-1、Lake-2。采用重力式柱状沉积物采样器对水底淤泥处(0~10 cm)进行采样,采集完成后及时将沉积物装入无菌塑封袋中,并采集1.5 L水样于采样瓶中,冷藏保存运输,用于模拟实验与分子生物学分析。
1.2 理化指标测定
实验中分别测定了水体中的余氯含量、沉积物中的总磷(TP)、总氮(TN)、硝酸盐()、亚硝酸盐()和氨氮()含量。其中水样经0.45 μm混合纤维素滤膜过滤后,基于DPD(N,N-二乙基-1,4-苯二胺)比色法[11],选用余氯检测仪(陆恒LH-M900)测定其余氯值。沉积物经过2 mol/L的KCl溶液浸提后,沉积物与水比例为1∶5,TP的测定采用钼酸铵分光光度法,TN测定采用碱性过硫酸钾消解紫外分光光度法,-N的测定采用锌镉还原法,NO-2-N测定采用重氮-偶氮法,-N测定采用次溴酸钠氧化法[12]。
1.3 模拟实验设计
1.3.1 消毒剂浓度梯度设置
实验中的次氯酸钠消毒剂选用目前公共场所和家庭消毒最常用的84消毒剂开展模拟[3]。根据84消毒剂使用方法,使用前按照原液和水1∶29比例进行稀释。考虑到残余消毒剂在流入自然水体时会被再次稀释,因此,对消毒剂进行10倍、25倍、100倍的再次稀释,形成3个分组以及对照组,见表1。

表1 模拟实验消毒剂投加梯度设置Table 1 Setting of disinfectant dosing gradient in simulation experiment
1.3.2 实验阶段设置
模拟实验将设置两个阶段进行,第一个阶段分析消毒剂投加后对沉积物微生物群落的短期影响(42 h以内),第二个阶段分析消毒剂投加后对其的中长期影响(126 h以内)。
第一阶段一次性添加消毒剂后,摇晃使其混合均匀,随后从样品中抽取适量水样检测余氯含量变化至达到稳定阶段,同时采集沉积物样品进行分析。样品采集间隔为:添加消毒剂后的0 h、3 h、6 h、18 h和42 h。实验操作过程的0 h时段,指空白组与实验组分别添加等体积的纯水与消毒剂,混匀之后进行取样所得沉积物样品。第二阶段通过延长实验周期,并通过多次添加消毒剂,进一步分析余氯进入水体的变化情况以及沉积物细菌群落。实验周期根据余氯浓度变化达到平稳阶段进行确定,在该实验中从42 h延长至126 h,消毒剂添加和采样分析时间点为:3 h、6 h、18 h、30 h、54 h、78 h、102 h、126 h。
1.4 分子生物学检测
微生物多样性测序分析,包括DNA提取、PCR扩增及Illumina高通量测序,具体步骤为:冷冻保存的约0.25 g干重的沉积物样品经室温融化后,采用Power Soil® DNA Isolation Kit基因组DNA提取试剂盒(MoBio,USA)提取沉积物样品中的总DNA。PCR扩增采用细菌16S rRNA通用引物 338F(5′-ACTCCTACGGGAGGCAGCAG-3′) 和806R(5′-GGACTACHVGGGTWTCTAAT-3′),用超微量紫外分光光度计NanoVue Plus Spectropho⁃tometer(GE Healthcare,UK)确定DNA浓度。
PCR样品的Illumina高通量测序委托上海美吉生物医药科技有限公司(http://www.Majorbio.com)在Illumina Miseq PE300平台上完成。将Miseq测序得到的成对reads拼接为一条序列,并进行质控过滤,根据序列首尾的barcode和引物序列区分样点得到有效序列,校正序列方向,进行数据优化。优化后的序列用Usearch(vsesion7.0 http://drive5.com/uparse/)在97%的相似度下划分独立操作单元(OTU,operational taxonomic units)后,采用RDP classifie贝叶斯算法对OTU达标序列进行分类学分析,通过SILVA rRNA数据库(Release 128,https://www.arb-silva.de/)进行对比。
1.5 统计分析
基于半度量距离算法(Bray-Curtis)对样品进行置换方差分析(Permutational multivariate analy⁃sis of variance,PERMANOVA),分析不同分组因素对样品差异的解释度,并使用置换检验对划分的统计学意义进行不同分组间细菌群落组成的显著性分析,采用非度量多维尺度分析(NMDS)方法分析细菌群落组成结构随时间变化及添加消毒剂梯度浓度的显著性差异。使用HemI软件(Heat⁃map Illustrator,V1.0)绘制基于平均连接聚类(计算出的两个聚类之间的距离)和欧几里德距离(两组之间计算的距离)的细菌群落结构热图。其他图形绘制使用ORIGIN 9.0软件完成。
2 结果与讨论
2.1 沉积物营养盐特征
三个采样点沉积物中TN的浓度为1.79~3.19 mg/g,其中River-1浓度最高,达到3.19 mg/g,浓度最低的Lake-2为1.79 mg/g。沉积物中TP浓度为0.42~0.66 mg/g,其中Lake-1浓度最高,为0.66 mg/g,Lake-2浓度最低,为0.42 mg/g。沉积物中-N浓度为8.56~17.19 mg/kg,其中Lake-1的浓度最低,为8.56 mg/kg,River-1的浓度最高,是Lake-1的两倍,为17.19 mg/kg。沉积物中-N浓度为0.20~0.65 mg/kg,其中Lake-2的浓度最高,为0.65 mg/kg,River-1的浓度最低,为0.20 mg/kg。沉积物中NO-2-N浓度为0.04~0.12 mg/kg,Lake-1的浓度为0.12 mg/kg,Lake-2与River-1的浓度均为0.04 mg/kg,见表2。
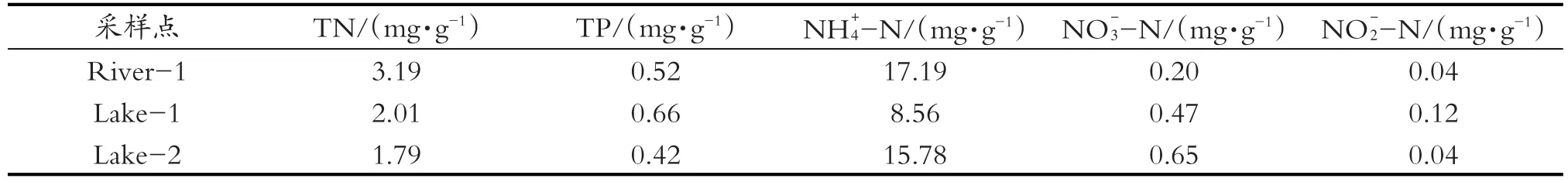
表2 三个采样点沉积物的营养盐含量情况Table 2 Nutrient content of sediments from three sampling sites
2.2 模拟过程余氯含量
第一阶段向模拟体系(420 mL)中添加1.56 mg/L(G1组)、0.64 mg/L(G2组)、0.16 mg/L(G3组)三个浓度梯度消毒剂20 mL,空白对照组添加相同体积纯水(CK组)。消毒剂添加后水体中的余氯浓度迅速下降,之后各个检测时间点所测得的余氯浓度基本保持平稳,Lake-2的余氯浓度为0.03~0.08 mg/L,Lake-1的余氯浓度为0~0.03 mg/L之间,River-1的余氯浓度处于0~0.03 mg/L之间。在Lake-2中,G1、G2、G3组水体的余氯含量在前3 h时段呈上升趋势,最高达0.08 mg/L,而后在3~6 h时段骤降至0.02 mg/L,并保持稳定。在Lake-1中,G1、G2组水体的余氯浓度在前3 h时段呈下降趋势,最低达0.01 mg/L,G3组的略微上升,而后在3~42 h时段大体保持平稳趋势。在River-1中,前18 h时段G1、G2、G3组水体的余氯浓度呈平缓下降后上升趋势,最高达0.5 mg/L,而后18~42 h缓慢下降至平稳。空白组余氯浓度变化趋势相对较平稳。如图1所示。
第二阶段的长期模拟通过延长实验周期(从42 h增至126 h),并且多次添加消毒剂,分析余氯进入系统的变化情况。在第二阶段中,三个地点模拟体系中的余氯波动范围分别为0.01~0.07 mg/L、0.01~0.05 mg/L和0~0.09 mg/L。每次添加消毒剂后,模拟体系中余氯含量迅速下降。例如Lake-1三组实验中,消毒剂添加后的余氯理论值为1.56 mg/L、0.64 mg/L和0.16 mg/L(不考虑余氯在体系中的消耗),而实际测量值仅为0.05、0.02、0.03 mg/L,实际值均远低于理论值,River-1和Lake-2组亦存在相同现象,且对照组与实验组呈现相似规律。如图1所示。
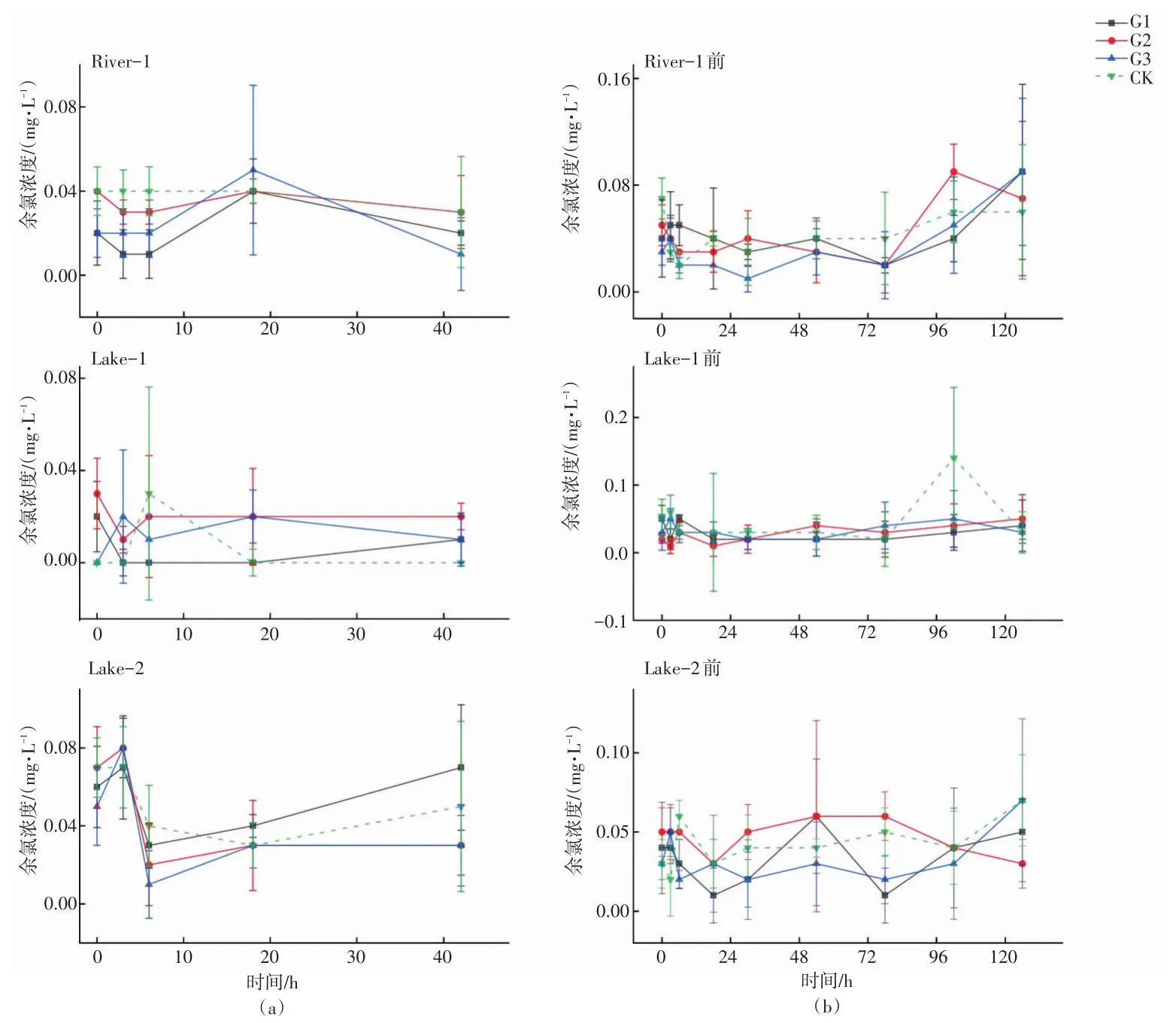
图1 模拟实验第一阶段(a)、第二阶段(b)余氯浓度变化情况Fig.1 The change of residual chlorine concentration in the first stage(a)and the second stage(b)of the simulate experiment
由第一、二阶段数据可知,一次性添加消毒剂后水体中的余氯值变化不明显,即使对水体多次添加了较高浓度的次氯酸钠消毒剂,其余氯浓度仍处于较低水平,添加后未出现余氯浓度突增的现象。余氯浓度平稳且较低可能是由于次氯酸钠进入水体之后稳定性差,易受光和H+催化发生氧化还原反应迅速降解[13]。其次,次氯酸钠或者余氯进入水体后,有可能被沉积物吸附,与腐殖质中微生物活动的代谢产物、沉积物中的氨基酸、蛋白质等有机物发生反应,并生成消毒副产物[14];另外,水体当中的NH3-N也会消耗部分余氯,有研究表明1 mg/LNH3-N理论上可消耗7.6 mg/L的游离氯,余氯浓度降低的同时水体中-N的含量也会随之下降[9]。
2.3 沉积物细菌群落结构
由于三组实验中余氯的变化呈现出相似规律,在沉积物细菌群落的分析中选择了River-1组进行了进一步分析。细菌群落结构的分析选择对River-1组添加消毒剂后的第一阶段初始Ⅰ-0(0 h)、第一阶段结束Ⅰ-42(42 h)和第二阶段初始Ⅱ-0(同第一阶段0 h)、中段Ⅱ-78(78 h)、结束Ⅱ-126(126 h)时的3个浓度梯度和1个对照组共16组沉积物样品进行分析,见图2。
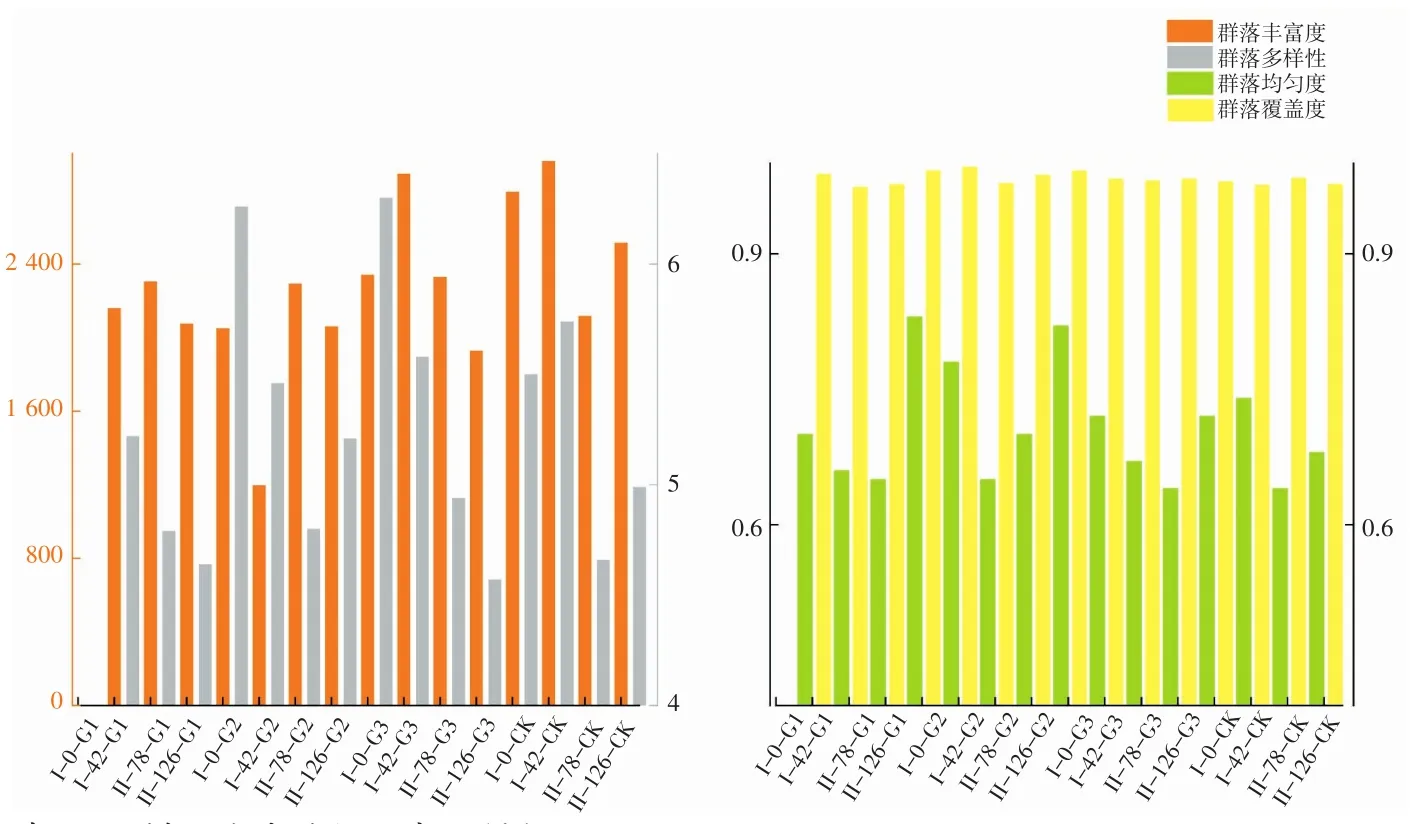
图2 基于97%相似度聚类的序列覆盖度和样品物种多样性指数Fig.2 Sequences coverage and biodiversity indices of samples based on 97% OTU clusters
2.3.1 细菌群落α多样性
α多样性指标包括群落多样性、群落丰富度、群落均匀度。根据所有样品中最低序列数(24 013条)进行抽平。所有样品的覆盖度都在97.4%以上,说明测序深度可以较好地反映沉积物中生物的多样性和群落特征。
第一阶段实验中,在0 h时段,首次投加消毒剂后实验组的群落多样性指数相对于空白组的较高;而在42 h时段,G2和G3组的群落多样性指数分别从6.26和6.30下降到5.46和5.58,CK组的则从5.50上升至5.74。同时,细菌群落多样性在不同浓度梯度中呈下降趋势,浓度相对较高的组的多样性下降得较快一些,例如G2组的群落多样性指数在42 h时段相比于0 h时段下降了0.80,G3组的群落多样性指数在42 h时段相比于0 h时段下降了0.72。实验组与空白组相比,实验组的样品群落的群落多样性、群落丰富度均低于空白组。
第二阶段实验中,在初始时段,首次投加消毒剂后实验组的群落多样性指数相对于空白组的较高。在中段,Ⅱ-78-G2组的群落多样性指数从6.26下降到5.21,Ⅱ-78-G3组的群落多样性指数下降到4.94,Ⅱ-78-CK组的为4.66。在模拟实验结束时,Ⅱ-126-G1组的群落多样性指数从4.79下降到4.64,Ⅱ-126-G2组的群落多样性指数从4.80上升到5.21,Ⅱ-126-G3组的群落多样性指数下降到4.57,Ⅱ-126-CK组的群落多样性指数为4.99。空白组在中后期的细菌群落多样性低于初始阶段。实验组与空白组的群落丰富度、群落均匀度相近,没有明显差异。
2.3.2 细菌群落组成分析
总共有20个科水平的细菌物种在水体沉积物中被发现,从科水平上可以看出,拟杆菌科(Bac⁃teroidaceae)、 厌氧绳菌科(Anaerolineaceae)、Smithellaceae是初始阶段的空白组细菌的三个优势科,其相对丰度分别为17.27%、8.17%和5.37%。在初次投加不同浓度的消毒剂后,初始阶段的实验组中相对丰度较高的是红环菌科(Rhodocyclace⁃ae)、丛毛单胞菌科(Comamonadaceae)和厌氧绳菌科;随着时间的增长和消毒剂的多次投加,实验组的相对丰度较高的是红环菌科、丛毛单胞菌科、Sulfurimonadaceae和周蝶菌科(Weeksellace⁃ae),空白组的优势科亦发生了更替,红环菌科成为优势菌科。
随着时间的增长和消毒剂的多次投加,三组实验组的群落结构趋于相近,红环菌科的相对丰度表现出逐渐上升的趋势。在126 h时间段的G1、G2、G3和CK四个组的沉积物中红环菌科的相对丰度较高,分别为23.75%、15.91%、24.25%和18.18%,是优势科。其他的细菌科,如厌氧绳菌科、Smithellaceae在后期各采样时间段中的相对丰度都较少,不再是优势种。在实验后期实验组与空白组的优势种相近,有可能是消毒剂在后期对细菌群落的影响降低,使各个实验组的群落组成受到模拟条件的影响趋于自然变化。
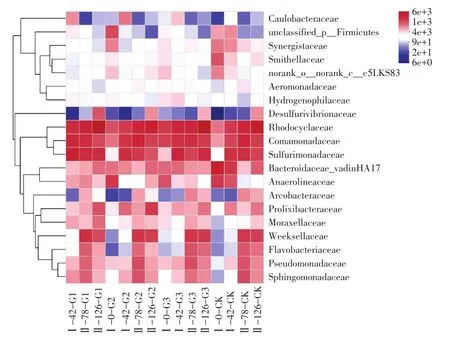
图3 相对丰度前二十科细菌群落组成热图Fig.3 Heatmap of bacterial community composition in the top 20 families of relative abundance
初始阶段的空白组优势科菌均属厌氧菌,厌氧绳菌科在产甲烷生物系统中,具有降解碳水化合物和其他细胞材料(如氨基酸)的作用[15],在实验后期,实验组与对照组的优势种相近,群落结构也十分相似,主要为红环菌科、丛毛单胞菌科、Sulfurimonadaceae和周蝶菌科,红环菌科可以利用不同的有机底物作碳源和电子供体进行厌氧光照生长[16],分解能力较强,适应缺氧甚至完全厌氧的环境条件[17]。有学者发现溶解氧的变化会影响细菌群落结构和生态功能,例如当水体处在缺氧状态时,丛毛单胞菌科会在群落中占据主导地位[18],由此说明消毒剂的投加在中、前期对细菌群落的新陈代谢、细菌生长有着显著的影响,可能抑制了产甲烷菌的生长,而有利于厌氧光照代谢的菌种的生长,因而使群落的优势种发生了更替。但在实验后期,实验环境条件对微生物群落造成的影响比消毒剂带来的更大,如光照、混匀过程及取样时对样品的搅拌等因素,使沉积物中细菌群落的生存环境发生改变进而造成更显著的影响。
细菌群落结构呈现出按照消毒剂投加时间分组聚类的趋势[PERMANOVA检验,P=0.001;图4(a)],在OTU水平上Ⅰ-0(初始)组和Ⅰ-42组的实验组均与其空白组的距离较远,且各自聚集为一组。说明Ⅰ-0组、Ⅰ-42组在添加消毒剂之后,其细菌群落结构发生了变化,可能是由于次氯酸钠具有强氧化性,在水中形成的次氯酸可与细胞壁发生作用,与蛋白质发生氧化作用而导致拟杆菌科、厌氧绳菌科等细菌死亡,使之不再是优势科[19];同时,含氯消毒剂对细菌繁殖体、病毒、真菌孢子及细菌芽孢都有强大的杀灭作用[20],对革兰氏阳性菌、革兰氏阴性菌、真菌、分支杆菌和厌氧菌均可达7个log值的杀灭率[21],消毒剂的投加迅速使拟杆菌科、厌氧绳菌科、Smithellace⁃ae等受影响阈值较低的菌体灭活,而分解能力较强,适应缺氧甚至完全厌氧环境条件的红环菌科、丛毛单胞菌科、Sulfurimonadaceae和周蝶菌科成了优势菌科。同时Ⅰ-0组与Ⅱ-78组和Ⅱ-126组的距离相差也较大,但是Ⅱ-78组与Ⅱ-126组分布已经较为接近,表明这两组的细菌群落组成较为类似,可能是由于实验周期时间较长,投加的不同浓度消毒剂的影响有限,沉积物生境的改变对细菌群落的影响比消毒剂带来的更加显著。
而细菌群落结构在不同浓度分组中未呈现聚类规律[PERMANOVA 检验,P=0.915;图 4(b)],过往实验结果显示,浓度为5.0 mg/L、10.0 mg/L、20.0 mg/L的消毒剂可有效灭菌,低浓度次氯酸钠(1.0 mg/L、2.5 mg/L、5.0 mg/L)在消毒初期对细菌有较强的刺激作用,但不影响模拟实验中微生物生态系统的恢复,而高浓度(10.0、20.0 mg/L)的消毒剂会对微生物生态系统造成严重破坏,且在消毒剂停止投加后也不能恢复[22],由此推测未呈现聚类规律可能是由于实验现有设置的浓度梯度对沉积物的影响有限,使之未能产生如中、前期的显著影响,也进一步说明了残余低浓度消毒剂对水体沉积物中细菌群落结构影响有限。
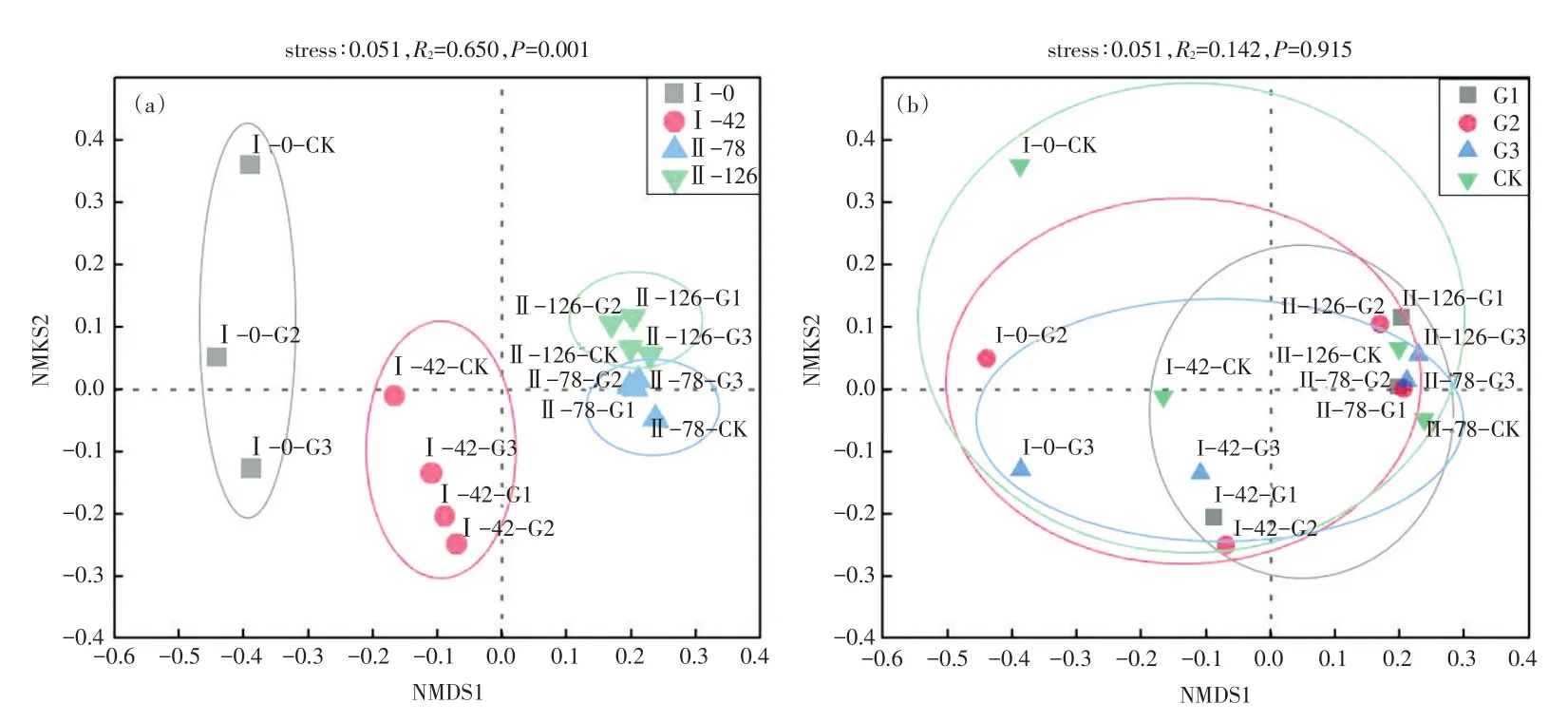
图4 基于非度量多维尺度分析不同时间段(a)和不同浓度梯度(b)水体细菌群落Fig.4 Non-metric multidimensional scale analysis of bacterial community in different time periods(a)and different concentra⁃tion gradients(b)
3 结论
1)沉积物的营养盐指标表明沉积物的理化特性均处于良好状态,无严重污染情况。多次添加较高浓度的次氯酸钠消毒剂进入水体中,其余氯浓度均处于较低水平,未出现余氯浓度突增的现象。
2)消毒剂的多次投加与周期长短是影响细菌群落多样性的关键因素,群落α多样性指数随时间呈现先上升后下降的趋势。
3)含氯消毒剂短期内在沉积物中没有明显的积累现象,但消毒剂的投加在中、前期仍对沉积物中的微生物群落造成了影响,会导致生物群落的多样性和丰富度减小并影响其群落的结构,使优势菌科由拟杆菌科、厌氧绳菌科、Smithellaceae变为红环菌科、丛毛单胞菌科、Sulfurimonadaceae和周蝶菌科。
