基于QbD理念的保健食品祛斑颗粒成型工艺研究
2021-12-27夏裕发
夏裕发
(1.漳州片仔癀药业股份有限公司,福建 漳州363000;2.福建省片仔癀天然医药研发企业重点实验室,福建 漳州363000)
质量源于设计(Quality by design,QbD)是基于充分的科学知识和质量风险管理,强调“以终为始”的科研方法,其核心是以预定目标产品质量概况(Quality target product profile,QTPP)为研发起点,在辨识产品关键质量属性(Critical quality attributes,CQAs)和关键工艺参数(Critical process parameters,CPPs)基础上,建立能满足产品性能且工艺稳定的设计空间[1-3]。QbD理念在制药等多个行业已被广泛应用,但少有基于QbD理念开发保健食品颗粒剂成型工艺的报道。本研究以QbD理念为指导,以具有袪黄褐斑保健功能的祛斑方(由丹参、当归、白芷、丹皮、香附等原料组成)提取膏为模型,根据保健食品法规要求和配方特点建立目标产品(祛斑颗粒)质量概况和产品关键质量属性,应用失效模型与影响分析法(the Failure mode and effects analysis,FMEA)辨识关键工艺参数,以成型率、溶化性、吸湿率、脆碎度、标志性成分含量等多指标[4-6]综合评价祛斑颗粒成型工艺,旨在为保健食品颗粒剂的成型工艺设计提供参考。
1 仪器与材料
1.1 仪器
e2695型高效液相色谱仪(waters公司,美国);KQ-300E型超声波清洗仪(昆山市超声仪器有限公司);电子分析天平(梅特勒-托利多仪器有限公司);HLSY-10B型快速搅拌制粒机(上海心意制药技术装备公司);YK60型摇摆式颗粒机(上海天祥健台制药机械有限公司);DHG-A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司)。
1.2 试药
袪斑方提取膏(自制,漳州片仔癀药业股份有限公司);丹酚酸B对照品(批号:111562-201514,中国食品药品检定研究院);甲醇、乙腈为色谱纯;水为超纯水;其余试剂为分析纯。
2 方法与结果
2.1 建立祛斑颗粒QTPP和CQAs
根据GB 16740-2014《食品安全国家标准·保健食品》及保健食品相关法规,结合祛斑方特点、拟开发产品食用量、食用方法等信息,进行前瞻性总结,建立祛斑颗粒的QTPP,见表1。根据表1祛斑颗粒的QTPP,结合前期研究经验和预实验,建立本产品的CQAs,见表2。
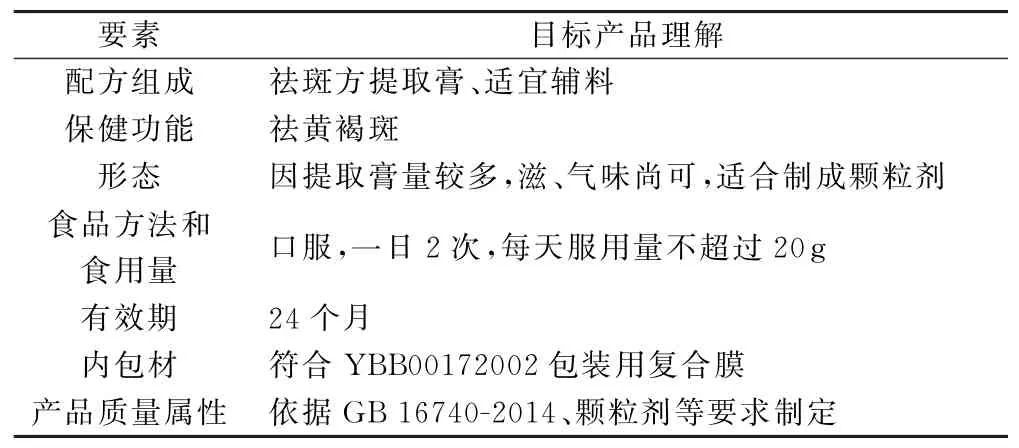
表1 祛斑颗粒QTPP

表2 祛斑颗粒CQAs
2.2 风险评估
由两位保健食品固体制剂研究员应用失效模型与影响分析(FMEA),从失效形式的严重度(S)、失效发生的概率(P)和可检测性(D)3个方面对祛斑颗粒成型过程中的影响因素进行风险评估,确定S、P与D的评价标准,并分别以1、2、3为 衡 量 值,最 后 以S、P、N值 的 乘 积 代 表 风 险 度(RPN),RPN<6且S≠3为低风险,6≤RPN<18为中风险,RPN≥18为高风险[3,7-8]。结果显示,辅料种类、用量以及干燥温度等影响袪斑颗粒的成型性、有效性的风险最大,属于高风险因素;而其他失效形式可以通过同一实验条件或多次平行实验控制风险,属于低风险因素。因此,可以对辅料种类、用量以及干燥温度进行研究和控制。评估结果见表3。

表3 颗粒成型过程风险评估
2.3 实验研究
2.3.1 祛斑颗粒的制备 根据实验设计,将祛斑方提取膏与辅料湿法混合制成软材,软材经摇摆式颗粒机(16目筛)制成湿颗粒,70℃干燥3 h,摇摆式颗粒机整粒(14目筛),混匀即得,待检。
2.3.2 评价指标的选择 制粒过程中,以颗粒成型率、吸湿率、溶化性、脆碎度等为指标,综合制软材、制粒情况以及颗粒冲泡后水液的口感、外观优选辅料种类和用量;在优选干燥温度时,增加标志性成分含量检测指标。
(1)成型率。参照《中国药典》0982粒度和粒度分布测定法[9],称取整粒后的颗粒约100 g(m1),采用双筛分法,使颗粒先后过1号筛、5号筛,取能过1号筛但不能过5号筛的颗粒,称量(m2)。
成型率计算公式:成型率=m2/m1×100%。
(2)吸湿率。参照《中国药典》9103药物引湿性试验指导原则[10],将干燥具塞玻璃称量瓶开盖,置于下部放有饱和氯化铵溶液的玻璃干燥器24 h,称定质量(m3),取袪斑颗粒平铺于称量瓶内,称定质量(m4)后置于干燥器内,于第24 h盖好称量瓶盖子,称定其质量(m5),计算吸湿率。
吸湿率计算公式:吸湿率=(m5-m4)/(m4-m3)×100%。
(3)溶化性。称取颗粒9g,加入70~75℃热水150 m L,使用磁力搅拌器匀速搅拌,记录颗粒全部溶化所需时间,允许溶液有轻微浑浊[5]。
(4)脆碎度。称取颗粒约25 g(m6),放入脆碎度测定仪转鼓内,设置转速为25 r/min,持续转动4 min,取出,过5号筛,称定通过5号筛颗粒重量(m7)[6]。
脆碎度计算公式:脆碎度=m7/m6×100%。
(5)标志性成分转移率的测定。色谱条件:填充剂为十八烷基硅烷键合硅胶;流动相为乙腈-0.1%磷酸(22∶78);柱温为25℃;流速为1 m L/min;检测波长为286 nm。对照品溶液、供试品溶液及阴性对照色谱,见图1、图2、图3。
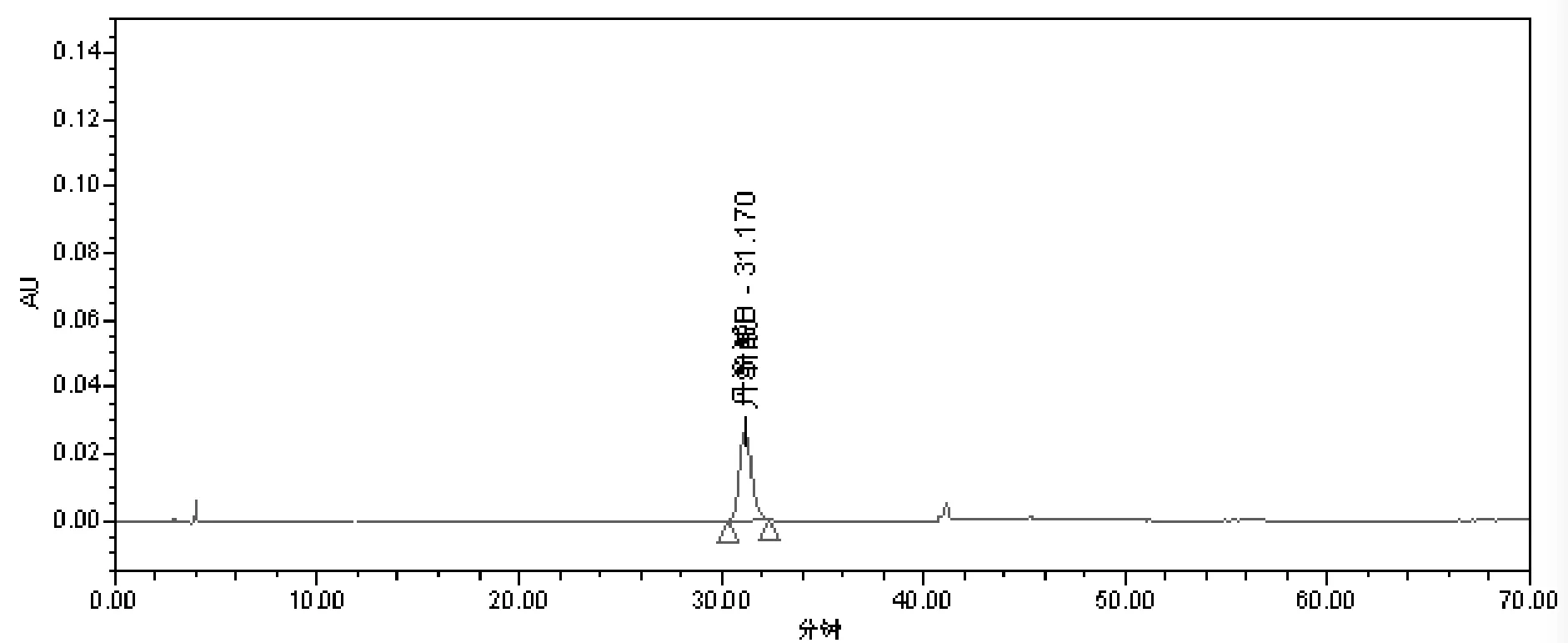
图1 丹酚酸B对照品HPLC色谱
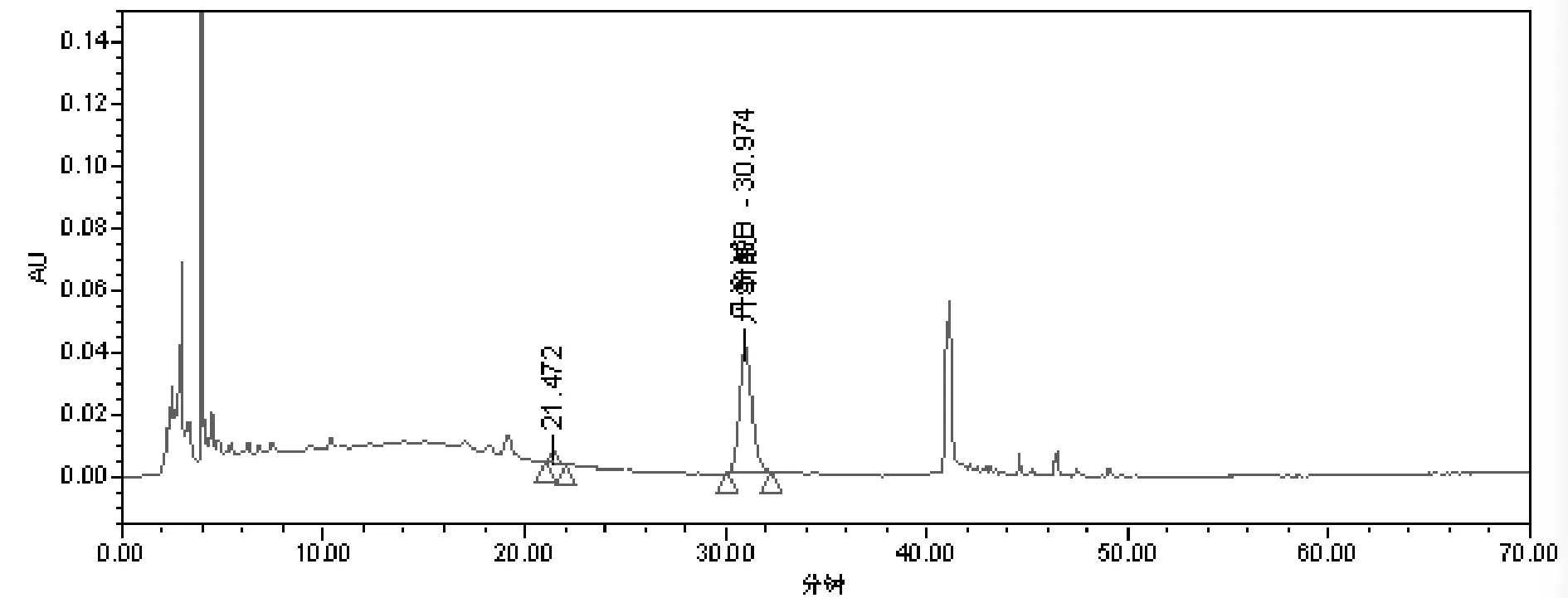
图2 供试品HPLC色谱
图3 缺丹参阴性样品HPLC色谱
对照品溶液的制备:取丹酚酸B对照品适量,精密称定,加80%甲醇溶液制成每1 m L含0.1 mg的溶液,即得。
供试品溶液的制备:取本品研细,取约1 g,精密称定,置具塞锥形瓶中,加入80%甲醇溶液25 m L,密塞,称定重量,超声处理(功率300 W,频率40 k Hz)30 min,放冷,用80%甲醇溶液补足减失的重量,摇匀,滤过,取续滤液,即得。
测定法:精密吸取对照品溶液与供试品溶液各10μL,注入液相色谱仪,测定。
2.4 结果与分析
2.4.1 辅料种类选择 颗粒剂常用辅料有蔗糖、糊精、可溶性淀粉、乳糖等,蔗糖口感佳,经济易得,早期开发的中药颗粒多以蔗糖搭配适量糊精作为辅料,但蔗糖具有较强的引湿性,且不太适合当前保健食品提倡的少糖、无糖理念;糊精、可溶性淀粉均是淀粉水解的产品,有很好的吸膏能力,但糊精、可溶性淀粉溶于热水后,水液透明度欠佳;可溶性淀粉的颗粒成型率高于糊精,而引湿性低于糊精[11];乳糖是常用的代糖辅料,性质稳定,无引湿性,有一定的甜度,溶化后的水液透明,中药无糖颗粒产品和中药配方颗粒多以乳糖为辅料,但单用乳糖作为辅料,颗粒成型率不足。因此本实验针对中药材提取膏量多质黏、易引湿的特点,和尽量保证袪斑颗粒冲泡后水液透明度,综合可溶性淀粉的吸膏能力和乳糖水溶液的透明性,选择可溶性淀粉与乳糖的混合物作为辅料。
2.4.2 辅料用量考察 按以下表4中辅料用量进行实验安排,按“2.3.1”项下方法进行制粒,观察不同辅料比例、用量对制软材、制粒情况、成型率、溶化性、吸湿率、脆碎度等的影响,结果见表4。结果显示,提取膏∶乳糖∶可溶性淀粉(2∶4∶2)时,软材适中,易制粒,且平衡了其他实验组颗粒成型率和溶解液外观,属于各实验组中工艺最优者。

表4 辅料用量考察实验结果
2.4.3 干燥温度考察 按上述优选的辅料配比制成湿颗粒,平均分成4份,分别置于温度为50℃、60℃、70℃、80℃的鼓风干燥箱中干燥,考察干燥温度对成型率、溶化性、吸湿率、脆碎度和丹酚酸B含量的影响,结果见表5。结果显示,干燥温度对颗粒的成型率、溶化性、吸湿性以及脆碎度影响不明显,高温会影响丹酚酸B的稳定性,因此干燥温度不宜高于70℃。
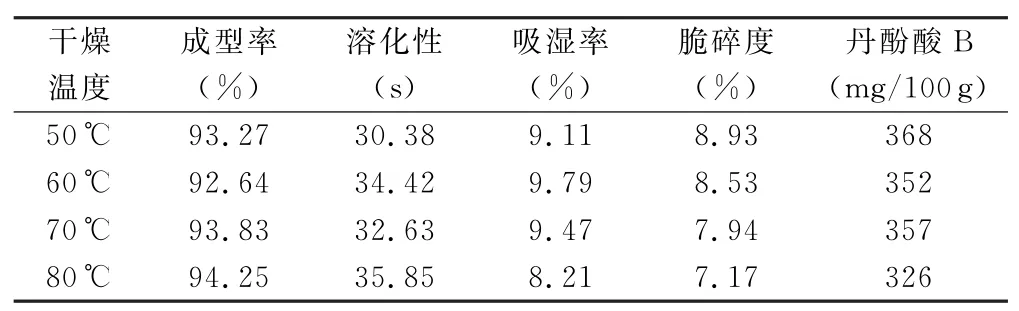
表5 干燥温度考察试验结果
2.4.4 成型工艺验证 取同一批次提取膏3份,按提取膏∶乳糖∶可溶性淀粉(2∶4∶2)称取乳糖、可溶性淀粉。将祛斑方提取膏与乳糖、可溶性淀粉湿法混合制成软材,软材经摇摆式颗粒机(16目筛)制成湿颗粒,70℃干燥水分低于3%,摇摆式颗粒机整粒(14目筛),混匀即得,待检。结果3批制粒过程顺利,成型率、溶化性等指标均符合预定要求,且批间没有显著差异,表明优选的配方工艺稳定、可行性较高。
3 讨论
祛斑方是由丹参、当归、白芷、丹皮、香附等组成,具有活血通经、疏肝理气、补血养血功效,主要针对胞宫失常、肝气郁结导致的黄褐斑设计。祛斑方提取膏是经70%乙醇提取、浓缩得到的提取膏,前期的大鼠、小鼠急性经口毒性试验结果显示安全无毒。本实验采用QbD理念,通过分析保健食品法规和祛斑方特点,以保健食品颗粒剂为预设的目标产品,在建立目标产品QTPP和CQAs的基础上,采用FMEA法对关键工艺变量进行风险评估,结合单因素考察,系统研究袪斑颗粒的成型工艺,并完成工艺验证。但颗粒成型不是本研究的重点,应用QbD理念有效开发目标产品才是本研究的目标,因此本研究并未使用复杂的星点设计等方法设计空间,而是通过直观的单因素考察,使颗粒满足目标产品要求,在一定程度上达到工艺最优。在筛选辅料时,考虑消费者的依从性,将颗粒的溶化性、外观、滋、气味、成型性等作为考察的主要指标;同时参考片剂“脆碎度”检查方法,模仿颗粒混合、分装、运输过程中的碰撞过程,保证上架产品粒度符合要求。祛斑方提取膏气味香,味淡,选用乳糖既能改善口感,又不需另添甜味剂,添加适量可溶性淀粉辅助乳糖提高祛斑颗粒成型率,两者联用能有效互补颗粒溶化性和成型性。本研究3批成型工艺验证结果显示,所用工艺制得的颗粒符合预设的目标产品,成型工艺稳定可行,为保健食品颗粒剂的成型工艺设计提供了参考依据。
