盐酸青藤碱在急性痛风大鼠体内的排泄动力学研究
2021-12-23何忠梅陈维佳
郑 爽,何忠梅,宗 颖,时 坤,2,陈维佳*,杜 锐,2*
(1.吉林农业大学中药材学院,吉林 长春 130118;2.吉林农业大学,动物生产及产品质量安全教育部重点实验室,吉林 长春 130118)
痛风是由于机体长期嘌呤代谢障碍,血尿酸水平增高,导致尿酸结晶沉积在关节及皮下组织,诱使炎症细胞聚集发生吞噬反应,吞噬细胞破裂释放出多种致炎致痛因子,表现为反复发作的关节红、肿、热、痛及痛风结石形成[1-4],近年来发病率不断上升,是最常见的关节炎形式之一[5-6]。目前,全世界对痛风的治疗效果不明显[7],临床常用的非甾体抗炎药、秋水仙碱等具有肝、肾、胃肠道毒性等诸多不良反应[8],故开发高效低毒的抗痛风中药新药势在必行[9]。
青风藤为防己科植物青藤Sinomeniumacutum(Thunb.)Rehd.et Wils.、毛青藤Sinomeniumacutum(Thunb)Rehd.et Wils.var.cinereumRehd.et Wils.的干燥藤茎[10],其主要成分青藤碱可通过抑制免疫、抗炎镇痛、诱导细胞凋亡、保护软骨等多种途径来治疗类风湿性关节炎[11]。为推动中药现代化,中药药代动力学成为近年来兴起的新领域[12],对青藤碱的相关研究已有不少报道,但尚未涉及该成分在急性痛风大鼠体内的排泄动力学。因此,本实验考察急性痛风大鼠尿液、粪便、胆汁中青藤碱随时间的排泄变化规律,以期为临床合理用药提供理论依据。
1 材料
1.1 仪器 Agilent 1260型高效液相色谱仪(美国安捷伦科技公司);5810R型台式高速离心机(美国贝克曼库尔特公司);BSA224S型电子分析天平(德国赛多利斯公司);DW-H型超低温冷冻存储箱(中科美菱低温科技有限责任公司);ZH-B6型代谢笼(安徽正华生物仪器设备有限公司);MX-F型漩涡混匀器(大龙兴创实验仪器有限公司);LC-DCY-12G型干式氮吹仪(上海力辰邦西仪器科技有限公司)。
1.2 试剂与药物 氧嗪酸钾(纯度≥99.7%,批号B22D9D78194)、黄嘌呤(纯度≥98%,批号A11A9M58302)、尿酸钠(纯度≥98%,批号S16N8I46625)、乌来糖(纯度≥98%,批号Z20J9Y64014)对照品(上海源叶生物有限公司);盐酸青藤碱对照品(纯度≥98%,大连美仑生物技术有限公司,批号J0102A);磷酸二氢钾对照品(纯度≥99.5%,上海阿拉丁生化科技股份有限公司,批号J1811174)。三氯甲烷、异丙醇(国药集团化学试剂有限公司);乙腈为色谱纯(美国 Fisher公司);水为娃哈哈纯净水。
1.3 动物 雄性Wistar大鼠,体质量(200±20)g,由长春市亿斯实验动物技术有限责任公司提供,动物生产许可证号SCXK(吉)-2015-0005。
2 方法
2.1 分组、造模与给药 将大鼠分成正常组6只、模型组12只,适应性喂养1周。模型组大鼠连续7 d腹腔注射造模药物(黄嘌呤与氧嗪酸钾按1∶1比例配比的60 mg/mL混合液)0.5 mL/100 g,每天2次,而正常组大鼠腹腔注射等体积生理盐水。第6天,2组大鼠右侧关节腔注射30 mg/mL尿酸钠100 μL[13],软尺测量大关节 2、4、6、8、10、12、24 h后的周长,计算关节肿胀率,公式为关节肿胀率=[(A-B)/B]×100%,其中A为注射尿酸钠后不同时间点的关节周长,B为未注射尿酸钠时的关节周长。
2.2 粪便、尿液排泄实验 将12只模型组大鼠置于代谢笼中适应环境,实验前12 h禁食不禁水,灌胃给予75 mg/kg盐酸青藤碱,在0~2、2~4、4~6、6~8、8~10、10~12、12~24、24~36、36~48、48 ~72 h收集尿液和粪便,准确测量前者体积及后者质量。
2.3 胆汁排泄实验 在粪便、尿液排泄实验后1 d,12只模型组大鼠禁食12 h,不禁水,20%乌来糖麻醉后将背部固定在手术台上,于上腹部作一小切口,分离胆管,插pe10聚乙烯管引流胆汁并收集,约1 h后灌胃给予75 mg/kg盐酸青藤碱,于0~2、2~4、4~6、6~8、8~10、10~12、12~24、24~36、36~48 h收集胆汁并记录体积,在-80 ℃下保存。实验中期,大鼠股静脉注射适量生理盐水以补充失去的体液,胆汁定量稀释后分析药物排泄量,计算累积排泄量和累积排泄率。
2.4 样品处理 取大鼠尿液0.1 mL,生理盐水稀释10倍后置于10 mL具塞试管中,加入氯仿-异丙醇混合液(4∶1)5 mL,超声提取15 min后3 000 r/min离心5 min,取有机层,在60 ℃水浴中氮流吹干,残渣用500 μL流动相溶解,取10 μL进样分析。同法处理大鼠胆汁。将大鼠粪便烘干后研成粉末,称取1 g,加入10 mL生理盐水混匀,取1 mL,剩余处理方法同尿液。
2.5 色谱条件 ACE5 C18色谱柱(4.6 mm×250 mm,5 μm);ZORBAX Eclipse XDC-C18保护柱(4.6 mm×12.5 mm,5 μm);流动相乙腈-0.01 mol/L磷酸二氢钾(10∶90)体积流量0.8 mL/min;柱温35 ℃;检测波长263 nm;进样量10 μL。
3 结果
3.1 关节肿胀率 如图1所示,模型组大鼠关节肿胀率在8~10 h达到最高,10 h后下降;正常组大鼠在24 h内未发生肿胀,即关节肿胀率为0。
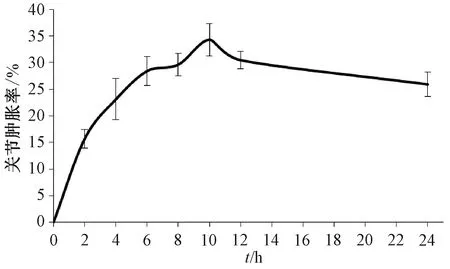
图1 不同时间点大鼠关节肿胀率Fig.1 Joint swelling rates of rats at different time points
3.2 方法学考察
3.2.1 线性关系考察 制备系列质量浓度盐酸青藤碱溶液,加入定量空白生物样品,配制8、9、10、15、20、25、30、40、50、60、70、80 μg/mL样品溶液,在“2.5”项色谱条件下进样测定。以盐酸青藤碱峰面积为纵坐标(Y),其质量浓度为横坐标(X)进行回归,结果见表1,可知该成分在尿液、粪便、胆汁中均呈良好的线性关系。
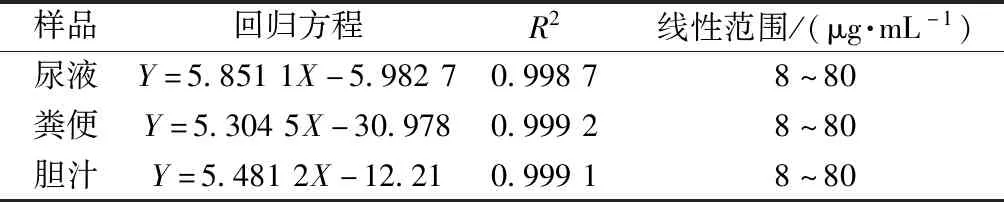
表1 盐酸青藤碱线性关系Tab.1 Linear relationships of sinomenine hydrochloride
3.2.2 专属性试验 取空白样品,按“2.4”项下方法处理,在“2.5”项色谱条件下进样测定,结果见图2,可知该方法专属性良好。
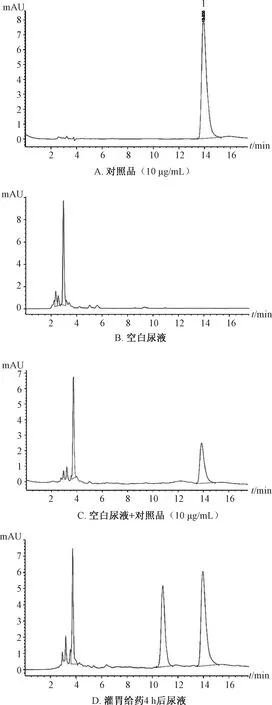
注:由于尿液、粪便、胆汁色谱图相似,故限于篇幅,本实验只提供尿液色谱图。1.盐酸青藤碱1.sinomenine hydrochloride图2 盐酸青藤碱HPLC色谱图Fig.2 HPLC chromatograms of sinomenine hydrochloride
3.2.3 精密度试验 制备盐酸青藤碱低、中、高质量浓度(9、40、80 μg/mL)的质控样品溶液各6份,在“2.5”项色谱条件下进样测定,同一天内计算日内精密度,连续5 d计算日间精密度,结果见表2,可知该方法精密度良好。

表2 盐酸青藤碱精密度试验结果(n=6)Tab.2 Results of precision tests for sinomenine hydrochloride (n=6)
3.2.4 稳定性试验 精密吸取对照品溶液适量,加入空白样品制成低、中、高质量浓度(9、40、80 μg/mL)的质控样品溶液各6份,按“2.4”项下方法处理,在“2.5”项色谱条件下进样测定,分别测定室温下24 h、反复冻融3次,-80 ℃下30 d的稳定性,结果见表3,可知该方法稳定性良好。

表3 盐酸青藤碱稳定性试验结果(n=6)Tab.3 Results of stability tests for sinomenine hydrochloride (n=6)
3.2.5 提取回收率试验 制备盐酸青藤碱低、中、高质量浓度(9、40、80 μg/mL)的质控样品溶液各6份,在“2.5”项色谱条件下进样测定,计算提取回收率,结果见表4。

表4 盐酸青藤碱提取回收率试验结果(n=6)Tab.4 Results of extraction recovery tests for sinomenine hydrochloride (n=6)
3.3 排泄动力学研究 正常组、模型组大鼠灌胃给予75 mg/kg盐酸青藤碱后,取不同时间段尿液、粪便、胆汁,在“2.5”项色谱条件下进样测定,计算排泄量,结果见表5,累积排泄量-时间曲线见图3,药动学参数见表6。
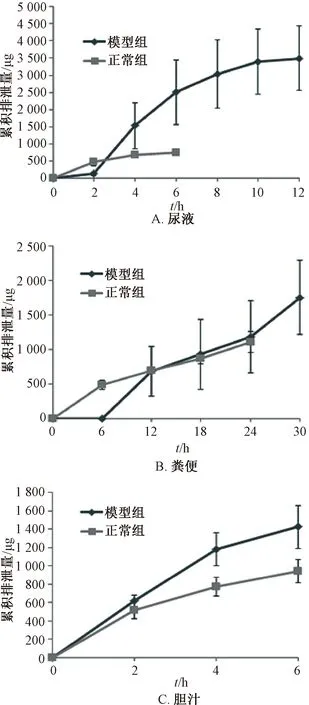
图3 盐酸青藤碱累积排泄量-时间曲线Fig.3 Accumulative excretion amount-time curves for sinomenine hydrochloride

表5 盐酸青藤碱含量测定结果(n=12) Tab.5 Results of content determination of sinomenine hydrochloride (n=12)

表6 盐酸青藤碱排泄动力学参数Tab.6 Excretion kinetic parameters for sinomenine hydrochloride n=12)
在尿液中,模型组大鼠于0~12 h检测出原型药物,累积排泄量占给药量的18.65%,其中71.65%是在前6 h排泄的,12 h后排泄很少,低于HPLC法测定盐酸青藤碱的检测线;正常组大鼠只在0~6 h检测出给药量3.93%的原型药物,与模型组比较,差异具有统计学意义(P<0.05);模型组T1/2长于正常组(P<0.05)。
在粪便中,模型组大鼠在0~6 h几乎检测不到盐酸青藤碱,6~30 h检测出给药量11.82%的原型药物;正常组大鼠在0~24 h检测出给药量6.13%的原型药物,与模型组比较,差异具有统计学意义(P<0.05);模型组T1/2短于正常组(P<0.05)。
在胆汁中,2组均在0~6 h检出原型药物,其中模型组累积排泄量占给药量的7.61%,而正常组占5.03%,2组比较,差异具有统计学意义(P<0.05);模型组T1/2短于正常组(P<0.05)。
4 讨论与结论
本实验采用腹腔注射黄嘌呤和氧嗪酸钾的方法促使大鼠体内嘌呤代谢紊乱,从而使血尿酸水平升高,获得更接近人体发病机制的急性痛风模型,结果发现灌胃给药后,少部分盐酸青藤碱以原型药通过粪便、尿液、胆汁排泄,而大部分在大鼠体内转化为其他形式。大鼠灌胃给予盐酸青藤碱后,模型组、正常组分别在12、6 h内的尿液中检出该成分,说明其尿排泄迅速,在肾脏不易蓄积;模型组盐酸青藤碱原型药物排泄量约为非模型组的6倍,推测可能是由于黄嘌呤、氧嗪酸钾腹腔注射引起大鼠肾损伤,影响盐酸青藤碱在体内的代谢转化。
研究表明,健康人群、痛风患者粪便上清液的代谢图谱存在明显差异,肠道菌群紊乱与痛风发病之间存在密切关系[14]。本实验发现,模型组大鼠粪便排泄量比正常组盐酸青藤碱排泄多,盐酸青藤碱在粪便中法人排泄速率也低于在尿液、胆汁中,推测肠道菌群异常可能使盐酸青藤碱在急性痛风大鼠体内的代谢转化过程受阻;盐酸青藤碱经胆汁排泄量较少,即不是主要排泄途径,并且模型组、正常组胆汁排泄量差异较小,提示急性痛风对该成分胆汁排泄无明显影响。
综上所述,本实验探讨了盐酸青藤碱在急性痛风大鼠体内的排泄特征,可为相关临床治疗和合理用药提供参考。
