刺芒柄花素对糖尿病肾病大鼠肾脏氧化应激损伤的作用及机制
2021-12-23张馨允郭启仓张景义
张馨允,郭启仓,张景义,许 颖
(1.河北省唐山市开滦总医院内分泌科,河北 唐山 063000;2.华北理工大学附属医院心胸血管外科,河北 唐山 063000)
糖尿病肾病是糖尿病患者死亡增加的主要原因,也是造成终末期肾病的常见原因[1],其病理特点是肾小球肥大、基底膜增厚、肾小球系膜扩张、肾小球硬化和间质纤维化[2]。氧化应激是糖尿病的重要致病因素,通过损伤胰岛β细胞和降低外周组织对胰岛素的敏感性,导致糖尿病的发生发展[3]。活性氧(ROS)作为细胞内信使,活化多种信号传导通路,间接导致组织和细胞的损伤,诱导糖尿病慢性并发症的发生如糖尿病肾病[4]。核因子E2相关因子2(Nrf2)在氧化应激防御系统中起着重要作用。在病理状态下,Nrf2从细胞质转移到细胞核,激活下游血红素氧合酶-1(HO-1)的表达,调节细胞内ROS水平以达到抗氧化作用。研究发现[5],激活Nrf2/HO-1信号通路能提高糖尿病肾病大鼠的抗氧化能力,说明Nrf2/HO-1信号通路介导的抗氧化在糖尿病肾病肾损伤中发挥肾保护作用。刺芒柄花素为红车轴草中主要的异黄酮类化合物,具有抗炎抗氧化作用。研究发现[6],刺芒柄花素通过抑制氧化应激和促炎因子水平对急性肾损伤大鼠的肾毒性起一定的预防作用。因此,本研究初步探讨刺芒柄花素对糖尿病肾病肾脏氧化应激损伤的保护作用及其潜在机制。
1 材料
1.1 动物 SPF级8周龄雄性SD大鼠75只,体质量(250±30)g,购自湖南斯莱克景达实验动物有限公司,实验动物使用许可证号SYXK(湘)2019~0017,在温度18~26 ℃、相对湿度40%~70%、光暗交替循环12 h/12 h下适应性饲养1周后进行实验。
1.2 试剂与药物 刺芒柄花素(纯度≥98%,批号CY180215,陕西慈缘生物技术有限公司)。链脲佐菌素(streptozocin,STZ,纯度≥98%,批号V900890,美国Sigma-Aldrich公司);血肌酐(批号MAK080)、血尿素氮(批号MAK006)检测试剂盒(美国Sigma-Aldrich公司);丙二醛(malondialdehyde,MDA,批号A003)、超氧化物歧化酶(superoxide dismutase,SOD,批号A001-3)检测试剂盒(南京建成生物工程研究所);谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px,批号BC1190)检测试剂盒(北京索莱宝科技有限公司);RIPA裂解液(批号P0013C)、ECL化学发光试剂(批号P0018S)和BCA蛋白分析试剂盒(批号P0012S)(上海碧云天生物技术有限公司);TRIzol试剂(批号15596026,美国Invitrogen Life Technologies公司);二氢乙锭荧光染液(批号sc-204724A,美国Santa Cruz公司);逆转录cDNA试剂盒(批号K1691,美国Thermo Fisher Scientific公司);荧光定量试剂盒[批号RR420 A,宝生物工程(大连)有限公司];一抗兔抗Nrf2(批号ab92946)、鼠抗HO-1(批号ab13248)、鼠抗β-actin(批号ab8226)和兔抗Histone H3(批号ab1791)抗体(英国Abcam公司)。
1.3 仪器 活力型血糖仪(瑞士罗氏公司);TBA-40FR全自动分析仪(日本东芝公司);Multiskan Sky 全波长酶标仪(美国Thermo Fisher Scientific公司);GelDoc XR凝胶成像仪(美国Bio-Rad公司);ABI 7500荧光定量PCR仪(美国Applied Biosystems公司);RM2235石蜡切片机(德国Leica公司);BX51荧光显微镜(日本Olympus公司)。
2 方法
2.1 造模、分组及给药 采用多次小剂量腹腔注射STZ(40 mg/kg)持续5 d[7]构建糖尿病大鼠模型,造模过程中出现死亡或造模不成功的予以补充或剔除,注射3 d后检测血糖,若浓度>16.7 mmol/L[8]则认定糖尿病模型建模成功,再继续定期检测血糖,剔除血糖缓解者并及时补充,4周后检测大24 h尿蛋白水平,若>20 mg[9],并且尿糖阳性,则认定糖尿病肾病模型建模成功。将造模大鼠随机分为模型组、二甲双胍组(100 mg/kg)、刺芒柄花素低剂量组(10 mg/kg)、刺芒柄花素高剂量组(40 mg/kg),每组15只,另选15只未经任何处理的大鼠作为正常对照组,给药组大鼠灌胃给予相应药物,正常对照组、模型组大鼠灌胃给予等体积生理盐水,每天1次,连续8周。治疗8周后收集大鼠24 h尿液,处死后采集肾脏组织和血液进行后续实验。
2.2 大鼠生化指标检测 收集各组大鼠24 h尿液,测定24 h尿微量白蛋白排泄率(MAER)。空腹尾静脉采血,采用血糖仪检测空腹血糖水平,肌酐(Scr)、尿素氮(BUN)试剂盒检测血清Scr、BUN水平,全自动分析仪检测血脂水平,包括总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)。
2.3 大鼠肾组织氧化指标检测 取冻存于液氮中的大鼠肾组织,预冷生理盐水制成10%组织匀浆后,按照试剂盒说明书检测MDA水平及SOD、GSH-Px活性。
2.4 过碘酸雪夫(PAS)染色 取大鼠左肾组织,去包膜后切一半,置于4%甲醛固定液中固定,常规石蜡切片,脱蜡至水后浸入高碘酸溶液中,室温孵育10 min,蒸馏水洗涤3次,室温晾干,滴加Schiff染液,室温孵育20 min,自来水冲洗5 min,苏木素染色10 min,自来水冲洗5 min,二甲苯透明,加入中性树胶封片,在显微镜下测量肾小球面积,计算肾小球基质相对面积,公式为相对面积=(肾小球基质面积/肾小球面积)×100%。
2.5 大鼠肾组织活性氧(ROS)检测 取固定好的大鼠肾组织,常规制备成石蜡切片,在室温下黑暗浸入10 μmol/L二氢乙啶(dihydroethidium,DHE)溶液中孵育20 min,PBS溶液洗涤3次后,在荧光显微镜下观察肾组织细胞中红色荧光,根据红色荧光强度可判断ROS水平的变化情况[10]。
2.6 RT-qPCR法检测大鼠肾组织Nrf2/HO-1 mRNA表达 取适量右肾组织,加入液氮研磨成碎块,使用TRIzol试剂制备组织匀浆提取总RNA,取1 μg,用PrimeScript RT酶混合液反转录成cDNA,在85 ℃下孵育5 s。引物序列Nrf2正向5′-CCATTTACGGAGACCCAC-3′,反向5′-CTTATTTCA ACGGCGAGT-3′;HO-1正向5′-CCTCACTGGC AGGAAATCATC-3′,反向5′-CCTCGTGGAGACGC TTTACATA-3′;β-actin正向5′-ATGAAGTGTGACG TTACGC-3′,反向5′-CCTAGAAGCATTTGCGGTGC AC-3′。采用ABI 7500实时PCR系统进行检测,反应条件为95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,循环40次,以β-actin为内参,2-ΔΔCT法计算目的基因表达的相对量。
2.7 Western blot法检测大鼠肾组织Nrf2/HO-1蛋白表达 取适量大鼠右肾组织至玻璃匀浆器中,每20 mg加入150 μL RIPA裂解液裂解组织抽提总蛋白,加入胞核提取缓冲液提取组织核蛋白,12 000 r/min离心15 min,收集上清液,BCA蛋白分析试剂盒检测蛋白质浓度,10% SDS-PAGE电泳分离蛋白,湿转到聚偏二氟乙烯膜上,在室温下用含5%脱脂奶粉的PBS溶液封闭1 h,加入一抗抗体Nrf2(1∶500)、HO-1(1∶1 000)、β-actin(1∶5 000)、Histone H3(1∶2 000),4 ℃过夜孵育,PBS溶液清洗3次,在室温下与辣根过氧化物酶结合的二级抗体孵育1 h,PBS溶液洗涤3次,增强化学发光液(ECL)显影,以目标条带、内参条带灰度值的比值为相对蛋白表达量,分别以β-actin、Histone H3为内参。

3 结果
3.1 刺芒柄花素对糖尿病肾病大鼠肾功能的影响 如表1所示,与正常对照组比较,模型组大鼠24 h尿液MAER、血清Scr和BUN水平升高(P<0.01);与模型组比较,刺芒柄花素高剂量组、二甲双胍组大鼠24 h尿液MAER、血清Scr和BUN水平降低(P<0.01),而刺芒柄花素低剂量组大鼠上述指标无明显变化(P>0.05)。
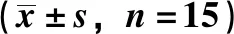
表1 刺芒柄花素对糖尿病肾病大鼠肾功能的影响Tab.1 Effects of formononetin on renal functions of rats with diabetic nephropathy n=15)
3.2 刺芒柄花素对糖尿病肾病大鼠血糖及血脂的影响 如表2所示,与正常对照组比较,模型组大鼠空腹血糖及血清TG、TC、LDL、HDL水平升高(P<0.01);与模型组比较,刺芒柄花素高剂量组、二甲双胍组大鼠空腹血糖及血清TG、TC、LDL、HDL水平降低(P<0.05,0.01),而刺芒柄花素低剂量组大鼠上述指标无明显变化(P>0.05)。
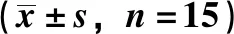
表2 刺芒柄花素对糖尿病肾病大鼠血糖、血脂水平的影响Tab.2 Effects of formononetin on blood glucose and blood lipid levels in rats with diabetic nephropathy n=15)
3.3 刺芒柄花素对糖尿病肾病大鼠肾组织病理变化的影响 如图1A所示,正常对照组大鼠肾组织肾小球无明显肥大增生等病理变化;模型组大鼠肾组织肾小球肥大、增生,系膜扩张以及系膜基质增多;刺芒柄花素高剂量组、二甲双胍组大鼠肾组织损伤病理变化较模型组减轻,而刺芒柄花素低剂量组未明显缓解。如图1B所示,与正常对照组比较,模型组大鼠肾小球基质相对面积增加(P<0.01);与模型组比较,刺芒柄花素高剂量组、二甲双胍组大鼠肾小球基质相对面积减少(P<0.01),而刺芒柄花素低剂量组大鼠该指标无明显变化(P>0.05)。

注:与正常对照组比较,**P<0.01;与模型组比较,##P<0.01。图1 刺芒柄花素对糖尿病肾病大鼠肾组织病理变化的影响(×400)Fig.1 Effects of formononetin on renal tissue pathological changes of rats with diabetic nephropathy (×400)
3.4 刺芒柄花素对糖尿病肾病大鼠肾组织氧化指标的影响 如表3、图2所示,与正常对照组比较,模型组大鼠肾组织MDA、ROS水平升高(P<0.01),GSH-Px、SOD活性降低(P<0.01);与模型组比较,刺芒柄花素高剂量组、二甲双胍组大鼠肾组织MDA、ROS水平降低(P<0.05,P<0.01),GSH-Px、SOD活性升高(P<0.05,P<0.01),而刺芒柄花素低剂量组大鼠上述指标无明显变化(P>0.05)。
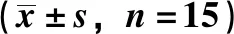
表3 刺芒柄花素对糖尿病肾病大鼠肾组织氧化指标的影响Tab.3 Effects of formononetin on renal tissue oxidation indices in rats with diabetic nephropathy n=15)
3.5 刺芒柄花素对糖尿病肾病大鼠肾组织Nrf2/HO-1表达的影响 如表4~5、图3所示,与正常对照组比较,模型组大鼠Nrf2/HO-1通路受到抑制,肾组织Nrf2、HO-1 mRNA及蛋白表达降低(P<0.01);与模型组比较,刺芒柄花素高剂量组、二甲双胍组大鼠Nrf2/HO-1通路激活,肾组织Nrf2、HO-1 mRNA及蛋白表达升高(P<0.05),而刺芒柄花素低剂量组大鼠Nrf2/HO-1通路无明显变化(P>0.05)。
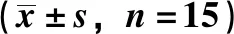
表4 刺芒柄花素对糖尿病肾病大鼠肾组织Nrf2、HO-1 mRNA表达的影响Tab.4 Effects of formononetin on the renal tissue mRNA expressions of Nrf2 and HO-1 in rats with diabetic nephropathy n=15)
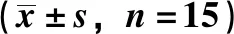
表5 刺芒柄花素对糖尿病肾病大鼠肾组织Nrf2、HO-1蛋白表达的影响Tab.5 Effects of formononetin on the renal tissue protein expressions of Nrf2 and HO-1 in rats with diabetic nephropathy n=15)

图3 刺芒柄花素对糖尿病肾病大鼠肾组织Nrf2、HO-1蛋白表达的影响Fig.3 Effects of formononetin on the renal tissue protein expressions of Nrf2 and HO-1 in rats with diabetic nephropathy
4 讨论
糖尿病肾病是终末期肾功能衰竭的重要原因。糖尿病肾病患者的全因死亡率、心血管死亡率和肾功能衰竭的风险明显增加[11]。据报道,糖尿病肾病患者24 h尿液MAER、血清Scr和BUN水平升高,导致疾病进展[12]。在本研究中,STZ诱导的糖尿病大鼠在病程进展4周后,出现24 h尿蛋白异常,尿液MAER、血清Scr和BUN水平均升高,光镜下观察到大鼠肾脏表现为肾小球肥大、增生以及系膜扩张等病理变化,成功建立糖尿病肾病大鼠模型。
糖尿病肾病的发病机制是多因素的,高血糖介导的多种途径失调导致机体增强氧化应激强度,进一步诱导器官组织损伤。因此,氧化应激被认为是糖尿病肾病进展的一个中心介质。糖尿病肾病患者早期肾组织MDA水平升高,总抗氧化能力降低,肾组织中总抗氧化能力和MDA水平与肾组织学评分有良好的线性相关性[13]。说明在糖尿病肾病早期阶段,糖尿病肾病患者的抗氧化能力已经下降。本研究结果表明,糖尿病4周后肾组织中MDA水平升高,SOD和GSH-Px活性降低。糖尿病肾病大鼠肾脏的抗氧化能力随着肾损伤的严重程度而减弱。Nrf2/HO-1信号通路作为氧化应激防御系统中的关键途径,在糖尿病肾病病程发展中具有两面性。一方面,Nrf2缺乏症减轻了糖尿病小鼠的高血压和肾病[14];另一方面,激活Nrf2可预防糖尿病性肾病[15]。本研究发现糖尿病肾病大鼠肾脏Nrf2和HO-1表达降低。综合分析,Nrf2具有两面性可能是由于在糖尿病肾病早期,肾组织Nrf2/HO-1信号通路激活促进抗氧化酶生成,抵抗氧化应激,保护糖尿病肾病诱导的肾损伤。随着病程的发展,在糖尿病肾病后期,肾损伤情况越来越严重,此时Nrf2/HO-1介导的抗氧化作用无法控制损伤的发展,肾组织内氧化、抗氧化动态平衡破坏,氧化应激占主导地位,因此肾组织内Nrf2/HO-1信号通路被抑制。
刺芒柄花素在多种与氧化应激相关的临床病理模型中发挥抗氧化作用[16-17]。研究发现,刺芒柄花素能通过减轻病变肾脏肾盂积水,阻碍肾间质纤维化的发展保护肾间质纤维化大鼠的肾功能[18]。研究发现[6],刺芒柄花素在急性肾损伤大鼠中上调了肾组织Nrf2的表达,进而诱导HO-1的表达和SOD活性增加。但在糖尿病引起的慢性肾病中,刺芒柄花素还未有相关报道。本研究结果显示,刺芒柄花素能有效降低糖尿病肾病大鼠血糖和血脂,提高肾组织抗氧化能力,减轻糖尿病肾病大鼠氧化应激引起的肾损伤。同时,刺芒柄花素还能激活糖尿病肾病大鼠肾组织Nrf2/HO-1信号通路,结合之前的研究,可以推测刺芒柄花素对糖尿病肾病大鼠肾组织氧化应激损伤的治疗作用可能与Nrf2/HO-1信号通路的调控相关。
综上所述,刺芒柄花素能减轻糖尿病肾病大鼠肾损伤,改善肾功能,降低血糖血脂,抑制肾组织氧化应激,其机制可能与激活Nrf2/HO-1信号通路有关。
