黑色素瘤抑制性活性蛋白对非小细胞肺癌患者肿瘤临床分期、组织分化程度的影响
2021-12-23谢忠海沈琦斌李冬顾勤花
谢忠海 沈琦斌 李冬 顾勤花
非小细胞肺癌细胞生长分裂慢、扩展转移较晚,发病初期无明显症状,通常确诊时病情已进展至中晚期,5 年生存率较低,预后差,严重威胁患者生命健康安全[1]。黑色素瘤抑制性活性蛋白(melanoma inhibitory active,MIA)最早通过纯化处理,从HTZ-19 恶性黑色素瘤细胞清液中分离而成,其细胞分子结构包含107 个疏水肽氨基酸及11 个KDA 蛋白质,在肿瘤细胞的进展和转移中发挥重要作用[2]。MIA 蛋白表达和非小细胞肺癌的恶性增殖及侵袭、转移等生物学特性密切相关,能够有效抑制肺癌细胞的转移和分化,阻断肿瘤血管形成,进而促进肺癌细胞凋亡[3]。基于此,本研究旨在观察MIA 对非小细胞肺癌患者肿瘤临床分期、组织分化程度的影响,以期为临床治疗方案的制定提供依据,报道如下。
1 资料与方法
1.1 一般资料 选择2020 年5 月—2021 年5 月浙江省湖州市中心医院住院治疗的非小细胞肺癌患者86 例纳入本次研究,其中男51 例,女35 例,年龄52~87(69.75±17.29)岁;TNM 分期[4]:Ⅲ期23 例,Ⅳ期26 例,Ⅱ期17 例,Ⅰ期20 例;Karnofsky 评分[5]:63~88(73.22±6.27)分;癌细胞转移:淋巴转移35 例,血液转移28 例,骨转移12 例;组织分化:低分化42例,中分化31 例,高分化13 例。本研究符合《世界医学协会赫尔辛基宣言》相关伦理学原则。
1.2 纳入及排除标准 纳入标准:(1)所有入选患者全部通过影像学、手术病理检查,符合中国临床肿瘤学会制定的《中国非小细胞肺癌免疫检查点抑制剂治疗专家共识(2020 年版)》相关诊断标准[6];(2)患者预计生存期>3 个月,Karnofsky 评分>60 分;(3)所有患者与其家属对本研究全部知情,签署同意确认书。排除标准:(1)合并肺部创伤性疾病、肺动脉高压、肺结核等肺部器质性病变疾病;(2)合并肺血吸虫病、新型冠状病毒性肺炎等肺部传染性疾病;(3)恶性肿瘤术后复发、其他癌症转移及凝血功能障碍患者;(4)伴有严重精神分裂综合征、语言和意识等基础功能丧失及临床资料不完整的患者。
1.3 方法
1.3.1 资料采集 制定《非小细胞肺癌患者基础资料问卷调查表》采集患者的性别(男、女),年龄(<60岁、≥60 岁),临床分期(Ⅰ~Ⅱ期、Ⅲ~Ⅳ期),淋巴结转移(有、无)及组织分化程度(低分化、中分化、高分化)等资料。
1.3.2 MIA 检测 采集非小细胞肺癌患者手术肿瘤细胞病理组织,石蜡包埋后采用EnVision 免疫组织化学染色法测定非小细胞肺癌细胞及其癌旁组织MIA 表达,操作步骤全部严格参照说明书执行。MIA蛋白工作液浓度比为1∶150。
1.3.3 MIA 免疫组化染色结果判定标准 在显微镜下观察癌细胞及其癌旁组织MIA 染色结果。细胞组织结构完好,且细胞中出现清晰棕黄色颗粒判定为阳性。分别采用显色强度、显色细胞比例进行MIA 免疫组化染色结果判定,具体如下:(1)显色强度:浅黄色:1 分,棕黄色:2 分,棕褐色:3 分;(2)显色细胞比例:显色细胞百分比<5%:0 分;5%~25%显色:1 分;>25%~50%显色:2 分;>50%~75%显色:3 分;显色细胞比例>75%:4 分。总分=显色强度计分×显色细胞比例计分,总分判定标准:0 分:阴性(-);1~4 分:弱阳性(+);5~8 分:阳性(++);9~12 分:强阳性(+++)[7]。根据MIA 免疫组化染色结果分组:MIA 低表达组:弱阳性,显色细胞总分1~4 分;MIA 高表达:阳性(++)或强阳性(+++),显色细胞总分5~12 分。
1.4 统计学方法 应用SPSS 21.0 软件行数据统计学处理,计量资料采用均数±标准差()描述,行t检验;计数资料采用例(%)描述,采用χ2检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 非小细胞肺癌、癌旁细胞组织MIA 表达 非小细胞肺癌、癌旁细胞组织均有MIA 阳性表达,其中非小细胞肺癌细胞阳性染色部分显示为弥漫性分布,包膜胞浆内呈现棕黄和棕褐色团块,细胞核内无分布,癌旁细胞组织阳性染色部分显示浅黄色。见图1。
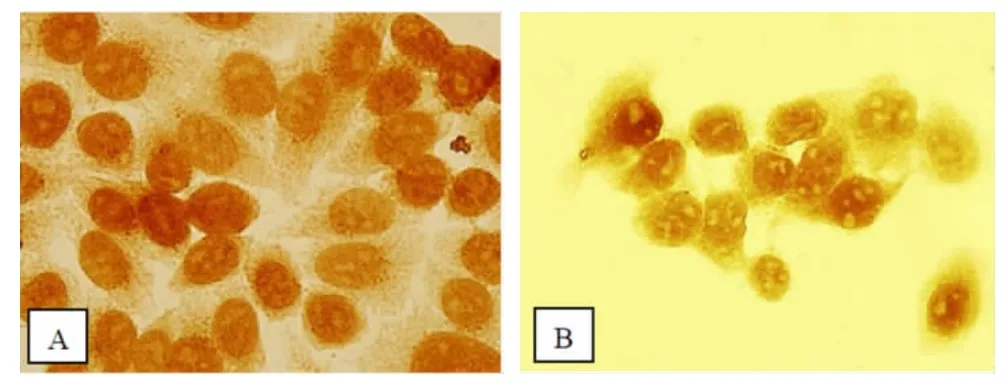
图1 非小细胞肺癌、癌旁组织MIA 免疫组化染色结果(×400)
2.2 MIA 表达与非小细胞肺癌临床指标的相关性非小细胞肺癌细胞组织MIA 表达与患者性别、年龄无相关性,差异无统计学意义(P>0.05);非小细胞肺癌细胞组织内MIA 表达和肿瘤临床分期、淋巴结转移、组织分化程度存在密切相关性,差异有统计学意义(P<0.05)。见表1。

表1 MIA 表达与非小细胞肺癌临床指标的相关性[例(%)]
2.3 不同肿瘤临床分期细胞组织MIA 表达的比较Ⅲ~Ⅳ期非小细胞肺癌、癌旁组织细胞MIA 表达均明显高于Ⅰ~Ⅱ期,且非小细胞肺癌MIA 表达高于癌旁组织,差异有统计学意义(P<0.05)。见表2。
表2 不同肿瘤临床分期细胞组织MIA 表达的比较(pg/mg,)

表2 不同肿瘤临床分期细胞组织MIA 表达的比较(pg/mg,)
注:MIA 为黑色素瘤抑制性活性蛋白;与同期癌旁组织比较,aP<0.05
2.4 不同组织分化程度肿瘤细胞组织MIA 表达的比较 高分化非小细胞肺癌、癌旁组织细胞中MIA表达明显高于中分化、低分化,且非小细胞肺癌MIA表达高于癌旁组织,差异有统计学意义(P<0.05)。见表3。
表3 不同组织分化程度非小细胞肺癌及癌旁细胞组织MIA表达的比较(pg/mg,)

表3 不同组织分化程度非小细胞肺癌及癌旁细胞组织MIA表达的比较(pg/mg,)
注:MIA 为黑色素瘤抑制性活性蛋白;与低分化比较,aP<0.05;与中分化比较,bP<0.05
3 讨论
非小细胞肺癌是肺癌中最为常见的类型,发病率占所有肺癌的80%以上,具有致病机制复杂、致死率高、预后差等特点,严重威胁人们的生命健康安全[7]。MIA 作为一种新型的黑色素瘤抑制性活性蛋白,可对非小细胞肺癌细胞株的异常增殖和分化进行有效抑制,极大削弱非小细胞肺癌细胞的软琼脂集落形成能力,从根本上降低非小细胞肺癌细胞进一步迁移、分化、侵袭能力[8]。
本研究结果显示,非小细胞肺癌、癌旁细胞组织均有MIA 阳性表达,其中非小细胞肺癌细胞阳性染色部分显示为弥漫性分布,包膜胞浆内呈现棕黄和棕褐色团块,细胞核内无分布,癌旁细胞组织阳性染色部分显示浅黄色;说明非小细胞肺癌的MIA阳性表达明显高于癌旁细胞组织,可以作为非小细胞肺癌与癌旁细胞组织的诊断标志物,为临床相关诊疗方案的制定提供参考,同Nencetti 等[9]研究结果相类似。究其原因发现,非小细胞肿瘤组织在生长、增殖与分化的过程中,会大量分泌生成MIA,于正常细胞中对抗肿瘤形成,亦可帮助肿瘤细胞抵抗放化疗产生的有毒、有害物质堆积。抑制蛋白酶体活性,可抑制自身免疫疾病及癌症的发展。非小细胞肺癌细胞中的MIA 蛋白表达要高于癌旁细胞,抑制蛋白酶体的活性,进而阻断肿瘤细胞蛋白质降解,促使蛋白质堆积,进一步促进非小细胞肺癌细胞的凋亡[10]。
本研究结果显示,非小细胞肺癌细胞组织内MIA 表达和肿瘤临床分期、淋巴结转移、组织分化程度存在密切相关性(P<0.05);说明非小细胞肺癌患者的肿瘤临床分期、淋巴结转移、组织分化程度均可以直接影响患者体内MIA 表达;同时,本研究还分析了MIA 与非小细胞肺癌组织的生长、黏附具有关联性,在肿瘤细胞的转移、增殖、分化过程中,和人体免疫反应相互作用,共同促进肿瘤细胞的凋亡;MIA 通过特异性阻断肺癌组织细胞与纤连蛋白、层粘连蛋白结合,从根源上降低肿瘤细胞的活性,降低细胞组织分化能力。本研究结果显示,Ⅲ~Ⅳ期非小细胞肺癌、癌旁组织细胞MIA 表达均明显高于Ⅰ~Ⅱ期,高分化非小细胞肺癌、癌旁组织细胞中MIA 表达高于中分化与低分化,且非小细胞肺癌MIA 表达高于癌旁组织;说明可以通过增加MIA 表达,降低非小细胞肺癌患者肿瘤组织分期和分化能力,阻断肿瘤血管形成,促进肺癌细胞凋亡,进而有利提高临床治疗效果。
综上所述,MIA 能够有效抑制非小细胞肺癌细胞的转移和分化能力,且与非小细胞肺癌患者的肿瘤临床分期、淋巴结转移、肿瘤细胞组织分化密切相关。
