基于生物信息学分析宫颈癌关键基因及预后相关生物标志物
2021-12-23鲁伟姚轶敏陈平陈婷婷
鲁伟 姚轶敏 陈平 陈婷婷
宫颈癌是女性第四大常见癌症,仅次于乳腺癌、结直肠癌和肺癌,在发展中国家是仅次于乳腺癌的第2 大常见恶性肿瘤,是最常见的女性生殖道恶性肿瘤[1]。相关危险因素包括遗传易感性、病毒感染、环境因素等,均与宫颈癌的病因有关[2]。由于宫颈癌的发生是一个复杂的病理过程,涉及各种遗传和表观遗传学,如抑制基因的失活和/或癌基因的过度表达,识别癌症相关途径中的失调基因可能会阐明肿瘤发生的分子机制[3]。目前,早期和局部晚期宫颈癌患者通常采用根治性治疗、化疗或联合治疗,而复发和持续性疾病患者的治疗选择有限。
近年来,高通量测序技术、基因芯片技术在肿瘤基因组学研究中逐步应用和发展,对寻找宫颈癌的发病机制、预后因素和潜在的治疗靶点具有重要意义[4-5]。而基因表达谱结合生物信息学分析已被广泛应用于识别差异表达基因(DEGs)、功能通路和与宫颈癌发生、预后相关的关键基因[6]。在本研究中,我们分析了两个mRNA 微阵列数据集,以获得宫颈癌组织和正常组织之间的DEGs。通过DEGs 功能富集和相互作用网络分析,结合生存分析和诊断效能分析,进一步识别宫颈癌中的关键基因,为宫颈癌的临床诊疗、预后和药物设计提供依据。
1 资料与方法
1.1 数据集收集 我们从NCBI-GEO 库(https://www.ncbi.nlm.nih.gov/geo)获得了GSE122697、GSE89657在宫颈癌组织标本和正常宫颈组织标本中的基因表达谱,这是一个包含基于微阵列的基因表达谱的公共数据库。两组的微阵列数据集均基于GPL570 平台(HG-U133-Plus-2,Affymetrix 人类基因组U133 Plus 2.0 微阵列)。
1.2 基因表达谱分析 应用GEO2R 在线工具(https://www.ncbi.nlm.nih.gov/geo/geo2r/),结合临床资料,对宫颈癌组织与正常宫颈组织间的DEGs 进行筛选(以|log2FC|>2,P<0.01 为条件),对每个数据集进行统计分析,筛选出差异基因。采用维恩软件在线(http://bioinformatics.psb.ugent.be/webtools/Venn/)筛 选两组数据中共同的DEGs。
1.3 基因本体与通路分析 DAVID(https://david.ncifcrf.gov/)是一个网站生物信息数据库,旨在确定相当数量的基因或蛋白质的生物功能[7]。基因本体论(GO)是一个公认的标准化分类系统,用于定义高通量基因组或转录组分析获得的基因及其RNA 或蛋白质产物的独特生物学功能。京都基因和基因组百科全书(KEGG)是一个由五个人工管理的数据库组成的集合,涉及基因组、生物途径、疾病、药物和化学底物。应用DAVID 分析DEGs 对GO 和KEGG 通路的富集程度,P<0.05 被认为差异有统计学意义。
1.4 蛋白质相互作用(PPIs)分析 检索相互作用基因的搜索工具(STRING)是一个用于评估PPIs 的在线数据库[8]。为了研究这些DEGs 之间潜在的蛋白质相关性,应用STRING 和综合评分的相互作用≥0.4(中等置信度)被认为是显著的[9]。此外,Cytoscape 软件用以可视化交互网络[10]。利用CytoHubba 插件及MCC 算法对已构建的PPIs 中的分子进一步筛选。
1.5 关键基因的TCGA 数据库验证 为了验证这些关键DEGs 的表达,我们应用R 软件Limma 包在TCGA 数据库(含数千个样本的测序表达数据)进行验证。
1.6 生存曲线及ROC 曲线分析验证宫颈癌的关键基因 利用R 语言软件的“survminer”(用于可视化)和“survival”(用于生存资料的统计分析)程序包,对所得到的关键基因进行单/多变量Cox 回归分析,根据基因表达量的中位值将基因分为高表达和低表达,筛选标准为P<0.05,计算95%置信区间的和风险比(HR),明确其与宫颈癌患者预后的相关性。基于TCGA 数据库(https://portal.gdc.cancer.gov/),对得到的与宫颈鳞患者预后显著相关的基因进行ROC 曲线分析。
2 结果
2.1 宫颈癌DEGs 初步筛选 我们收集了不同系列的原始数据(GSE122697、GSE89657),这些原始微阵列数据集是标准化数据,利用GEO2R 在线工具,提取微阵列数据集的DEGs。随后,维恩常用图解软件获取存在于两个数据集交叉的DEGs。癌组织与正常组织比较,共有56 个共同显著差异基因,包括15 个上调基因(log2FC>2)和41 个下调基因(log2FC<-2)。
2.2 宫颈癌DEGs 基因GO 及KEGG 通路分析 我们利用筛选的DEGs 进行GO 及KEGG 分析。为了实现这一目标,所有56 个共同差异基因通过David web 工具进行了分析。如图1 所示,GO 分析结果表明:(1)生物过程(BP):上调的DEGs 在核分裂、有丝分裂姐妹染色单体分离、姐妹染色单体分离的调控中尤为丰富,而下调的DEGs 主要在细胞外基质组织调控;(2)细胞成分(CC):上调的DEGs 主要集中在染色体区域,下调的DEGs 主要富集在含胶原的细胞外基质、细胞外基质成分、内质网腔;(3)分子功能(MF):上调的DEGs 主要富含组蛋白激酶活性,微管结合,蛋白丝氨酸/苏氨酸激酶活性,而下调的DEGs 细胞外基质结构成分、血小板衍生生长因子结合、生长因子结合。KEGG 分析结果显示,上调的DEGs 主要在细胞周期、卵母细胞成熟、减数分裂通路中显著富集,而下调的DEGs 在PI3K-Akt 信号通路、ECM 受体相互作用通路中显著富集(P<0.05)。
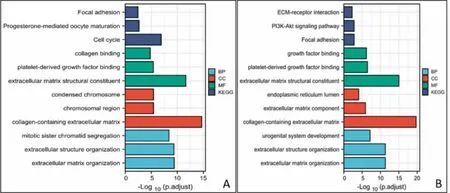
图1 DEGs 功能富集可视化结果
2.3 PPIs 构建模块化分析 为了探索筛选出的DEGs 中可能起关键作用的中枢基因在宫颈癌中的作用,采用Cytoscape 基于STRING 数据库构建PPI网络,包括15 个上调基因和41 个下调基因共56 个DEGs,去除孤立节点,生成35 个节点和93 条互相作用边的PPI 网络(见图2A)。经CytoHubba 插件及MCC 算法分析后,得到与其他蛋白作用最多的前18个枢纽蛋白的编码基因:ASF1B、ASPM、AURKA、CENPF、CEP55、DTL、E2F7、FOXM1、MELK、PLK1、APOD、CD34C、CXCL12IGFBP4、IGFBP4、LGALS1、SFRP1,见图2B。

图2 DEGs 的PPI 网络
2.4 18 个枢纽蛋白的编码基因验证 进一步通过TCGA 数据库验证与宫颈癌显著相关的基因在宫颈癌组织和正常宫颈组织中的差异表达,结果显示,与正常宫颈标本相比,所有上调的10 个基因均被证实显著高表达(见图3A),而下调的8 个均为显著低表达(见图3B)(P<0.05)。

图3 验证TCGA 数据库关键DEGs 表达
2.5 Cox 单/多因素分析关键基因 为了深入了解关键基因与宫颈癌之间的关系,我们利用包含了大量宫颈癌微阵列数据集的TCGA 数据库,通过R 软件包单/多因素Cox 分析这18 个基因的宫颈癌患者总生存率,如图4A 所示,在宫颈癌患者中,10 个上调基因中只有ASF1B 的总生存率显著改善[HR=0.437(0.272~0.704),P<0.01],而8 个下调基因中没有生存率显著改善的基因(P>0.05)。图4B 显示,高表达ASF1B 可显著增加宫颈癌患者总生存率(P<0.01)。此外,ROC 曲线显示ASF1B 可以作为区分肿瘤和正常宫颈组织的生物标志物(AUC=0.998,95%CI:0.993~1.000),如图4C。
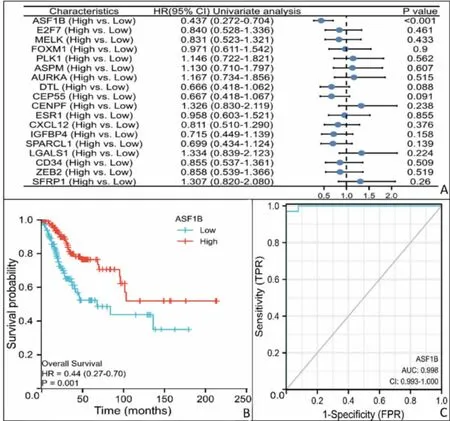
图4 关键基因的预后及诊断效能分析
3 讨论
本研究基于GEO 和TCGA 数据库通过生物信息学的方法,利用R 软件包初步得到DEGs 主要富集于细胞核分裂、有丝分裂姐妹染色单体分离、细胞外基质组织调控等生物学过程。KEGG 分析结果显示,DEGs 在细胞周期、减数分裂、PI3K-Akt 信号通路、ECM 受体相互作用通路等方面的聚集尤为明显。利用构建DEGs 的PPI 网络及生存分析,我们最终发现差异表达基因ASF1B 不仅是PPI 网络中的枢纽蛋白,而且其高表达的子宫颈癌患者生存率显著高于低表达患者,ROC 曲线显示其对宫颈癌有很高的诊断价值。因此,ASF1B 有可能在子宫颈癌发生、预后中发挥重要的作用。
抗沉默功能1(ASF1)是进化上保守的组蛋白H3-H4 分子伴侣,从酵母进化到哺乳动物,在各种染色质基础过程中起作用,如DNA 复制、DNA 损伤反应和修复、DNA 重组和转录调节等[11]。ASF1 同源物B(ASF1B)是ASF1 的亚型,ASF1B 基因位于染色体19p13.12 上,含4 个外显子,其编码蛋白由202 个氨基酸组成。ASF1B 是细胞周期调节核丝氨酸/苏氨酸激酶家族的底物,通过保证核小体组装位点组蛋白的正常供应,在调节染色质核小体结构中起关键作用[12]。人类ASF1B 是转录因子E2F1 的直接转录靶点,通过腺病毒介导的E2F1 基因过表达可上调HeLa 细胞ASF1B mRNA 的表达,即ASF1B 的表达在细胞周期进程中受到转录因子E2F 的调控[13]。在细胞生长中,当细胞周期结束时,与ASF1B 相对应的mRNA 和蛋白表达量均减少,并且ASF1B 的缺失严重影响细胞增殖,导致异常的核结构和明显的异常转录特征。
ASF1B 的过表达导致不同的转录特征与细胞增殖增加和细胞凋亡减少相一致,诱导了多个参与细胞周期调控的基因,包括介导G1/S、M 期、染色质调控因子等。此外,ASF1B 过表达还抑制一些与细胞凋亡相关的基因,进而促进S 期进入有丝分裂的进程,显著诱导β 细胞增殖[14]。ASF1B 可以通过诱导细胞凋亡来靶向抑制宫颈癌细胞的生长。具体来说,ASF1B 的沉默抑制了宫颈癌细胞的生长,而ASF1B的过度表达则加速了癌细胞的增殖,ASF1B 的缺乏诱导细胞周期阻滞和凋亡。在机制上,ASF1B 与细胞周期蛋白依赖激酶9(CDK9)形成稳定的复合物,并正调控CDK9 的稳定[15]。先前研究显示,ASF1B 的过度表达显著增强乳腺癌细胞的增殖,可以作为预测乳腺癌的一种新的预后因子,ASF1B 的高水平与癌症进展和转移发生率的增加相关[16]。ASF1B 除了在乳腺癌细胞中有显著的过表达外,在皮肤、肝脏、卵巢等其他类型的恶性肿瘤中也过度表达。ASF1B 可促进肾透明细胞癌细胞的增殖与迁移,与Akt/p70S6K1通路的调控密切相关[17]。PI3K/Akt 通路通过调节细胞周期促进肿瘤细胞增殖,与肿瘤的侵袭转移密切相关,ASF1B 的下调,可抑制PI3K/Akt 通路,从而诱导前列腺癌细胞凋亡[18]。另外有报道ASF1B 表达升高与人肺腺癌预后不良相关[19]。
人类蛋白质图谱网站(http://www.proteinatlas.org/)[20]提供的生存曲线数据也证实ASF1B 可作为肾透明细胞癌、宫颈癌、胃癌、胰腺癌和肝癌的预后标志物,和我们的结果一致,宫颈癌和胃癌的ASF1B 高表达提示有利于预后,而肾透明细胞癌、胰腺癌和肝癌则提示不利于预后。这种同一个基因在不同类型的肿瘤预后不一致,可能是不同的肿瘤在不同阶段基因的激活情况不同,参与调控的通路不一样,亦或ASF1B 通过不同调节网络调节细胞过程的特定方式不同所致。宫颈癌和胃癌的ASF1B 高表达,有可能没有激活转录因子介导的蛋白表达,或ASF1B 的高表达有可能提高对这两种癌的化疗敏感性,降低耐药,从而提高生存率。我们通过全面的生物信息学数据提供了可能对宫颈癌的发生、预后起重要作用的核心基因,可以为未来宫颈癌的基因个体化治疗提供一些重要的证据。
