青藤碱调控NLRP3/caspase-1 通路抑制BV-2 小胶质细胞焦亡及炎症的机制研究
2021-12-23陈应丛王国涛徐道剑
陈应丛 王国涛 徐道剑
胶质细胞包括小胶质细胞、少突胶质细胞和星形胶质细胞,是神经系统的重要组成部分[1]。其中,小胶质细胞作为神经系统固有免疫细胞,在脊髓损伤过程中,小胶质细胞会被激活并且发挥重要的调控作用[2]。细胞焦亡(pyroptosis)是一种新发现的伴随炎症发生的程序性细胞死亡方式,分为依赖半胱氨酸天冬氨酸蛋白酶(caspase-1)的经典途径和依赖caspase-4、5、11 等的非经典途径[3]。研究表明,脊髓损伤后,其小胶质细胞中caspase-1 表达明显上升[4]。因此,通过药物抑制细胞焦亡是脊髓损伤的一种潜在治疗方式。青藤碱是从我国传统中草药青风藤中提取的一种活性碱,具有止痛、抗炎及调节免疫等功能[5]。研究表明,青藤碱能通过抑制核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)表达,减缓小鼠关节软骨退变[6],但青藤碱对脊髓损伤的保护机制尚不明确。因此,本研究旨在探究青藤碱调控NLRP3/caspase-1 通路抑制BV-2 细胞焦亡和炎症的作用机制,以期为青藤碱治疗脊髓损伤的临床应用提供理论依据。
1 实验材料
1.1 细胞 BV-2 小胶质细胞(中国医学科学院基础医学研究所基础医学细胞中心,批号TCR14)。
1.2 主要试剂及仪器 青藤碱试剂(武汉谷歌生物公司,批号115-53-7);胎牛血清(德国SeraPro 公司,批号S601P-500);DMEM/高糖培养基(美国HyClone 公司,批号SH30022.01B);CCK-8 试剂盒(杭州苹谷生物公司,批号AG0063c);Hoechst/PI 染色试剂盒(杭州苹谷生物公司,批号AG0045c);乳酸脱氢酶(LDH)试剂盒(南京建成公司,批号A020-2-2);抗小鼠一抗硫氧还蛋白结合蛋白(TXNIP)、NLRP3、caspase-1、白细胞介素1β(IL-1β)和白细胞介素18(IL-18)抗体(Abcam 公司,批号ab188865、ab263899、ab179515、ab213818、ab223293),抗兔二抗购自默赛飞公司(批号31234)。2802H 型紫外分光光度计(美国UNICO 公司,型号UV2800);PCR 基因扩增仪(德国Eppendorf 公司,型号Mastercycler X50);凝胶成像仪(美国Bio-RAD 公司,型号BIO-RAD Gel Doc XR+);荧光倒置显微镜(日本奥林巴斯公司,型号IX83)。
2 实验方法
2.1 细胞培养及分组 将BV-2 细胞分为正常组、氧糖剥夺/复糖复氧(OGD/R)组和青藤碱组(20μmol/L)进行研究分组。正常组:BV-2 细胞用含体积分数10%胎牛血清的DMEM/高糖培养基培养,并置于37℃、5%CO2的恒温培养箱中。OGD/R 组:BV-2 小胶质细胞用Earle’s 平衡盐溶液培养,置于37℃、1%O2、5%CO2和94%N2的培养箱中培养6h,然后正常条件下继续培养。OGD/R+青藤碱组:BV-2 小胶质细胞用Earle’s 平衡盐溶液培养,置于37℃、1%O2、5%CO2和94%N2的培养箱中培养6h,然后用含20μmol/L 青藤碱、10%胎牛血清的高糖DMEM 培养基继续培养。
2.2 给药剂量筛选及CCK-8 检测细胞活力 BV-2小胶质细胞经OGD/R 模型处理后,分别用0、10、20、50、100μmol/L 浓度的青藤碱干预48h。每孔加入10μL CCK-8 溶液,恒温培养箱内孵育2h,酶标仪检测490nm 处各孔的吸光度(OD),以OGD/R 组(0μmol/L 浓度的青藤碱干预组)为对照组,计算各组BV-2 小胶质细胞相对活性。
2.3 微量酶标法检测BV-2 小胶质细胞LDH 活性将正常组、OGD/R 组和青藤碱组BV-2 小胶质细胞分别用胰酶消化后,以1350r/min,离心5min。取120μL 上清液,再加入60μL LDH 检测液混匀,在避光条件下摇床孵育30min。酶标仪检测490nm 处各孔的吸光度(OD)。以正常组为参照,LDH 相对释放量=OD 检测组/OD 正常组。
2.4 赫斯特(Hoechst)/碘化丙啶(PI)染色法检测青藤碱对BV-2 细胞焦亡的影响 将BV-2 小胶质细胞培养于6 孔板中,分别经过不同干预后,使用PBS洗涤3 次。将细胞染色缓冲液、Hoechst 溶液和PI 溶液以200∶1∶1 比例混匀形成工作液,每孔加入1mL 工作液,4℃避光反应30min,PBS 洗涤3 次后,使用荧光显微镜下观察细胞焦亡情况。
2.5 RT-PCR 检测BV-2 小胶质细胞基因表达 分别选取正常组、OGD/R 组和青藤碱组BV-2 小胶质细胞操作。具体试验步骤按照Trizol 试剂盒说明书进行,在细胞中加入Trizol 试剂,室温静置10min;加200μL 氯仿混匀后,以12000r/min,4℃离心15min,取上层转移至EP 管;加等体积异丙醇,以12000r/min,4℃离心15min,取底部RNA 沉淀。用预热灭菌水溶解沉淀。取4μL 总RNA 加至200μL 灭菌水中,在紫外分光光度仪上测定其OD260 和OD280,计算OD260/OD280。反转录反应:在20μL 反应体积中进行,成分如下:总RNA 5μL,随机引物1μL,ddH2O 4.5μL,70℃固定浴10min;加10μL 逆转录反应液在42℃固定浴60min,99℃固定浴5min,-20℃保存备用。引物由上海生工生物技术有限公司提供,序列见表1。实时定量PCR 实验方法:使用宝生物工程(大连)有限公司生产的SYRB Premix ExTaqTM和ABI 7900 扩增仪进行荧光扩增;求出CT 值,检测TXNIP、NLRP3、caspase-1、IL-1β 和IL-18 基因的表达情况。

表1 PCR 引物序列
2.6 Western blot 检测BV-2 小胶质细胞蛋白表达收集细胞,加入冰预冷的蛋白裂解液后混匀,超声破碎细胞,12000r/min,4℃离心15min 后,提取上层细胞蛋白,加入5X 上样缓冲液(体积比4∶1),100℃沸水中煮5min,-20℃备用。SDS-PAGE 电泳:按照胶配置方法配制不同浓度PAGE 胶,电泳置染料抵达分离胶底部,断开电源,取下凝胶,切取带有要转移蛋白泳道的凝胶。将分离后的蛋白电转移至PVDF 膜。封闭:转移结束后,在TBS-T 液内清洗20min,加5%脱脂奶粉,37℃封闭1h。一抗孵育:封闭结束后,用TBS-T 稀释第一抗体,将PVDF 滤膜置于其中,4℃震荡过夜。显迹:TBS-T 液漂洗PVDF 膜3 次/10min,将膜与TBS-T 稀释二抗孵育,室温下振荡1h;TBS-T漂洗PVDF 膜3 次/10min;TBS 液漂PVDF 膜3 次/10min,X 光胶片上曝光,随后显影、定影,用图像分析系统测定蛋白条带的光密度,定量分析TXNIP、NLRP3、caspase-1、IL-1β 和IL-18 蛋白的表达情况。
2.7 统计学方法 应用SPSS 13.0 统计软件进行分析,所有数据均以均数±标准差()表示。多组间的差异比较采用单因素方差分析,为检验组间差异,方差分析后作Dunnett’s test。检验水准α 值取双侧0.05,以P<0.05 为差异有统计学意义。
3 结果
3.1 青藤碱对BV-2 小胶质细胞活性的影响 用10、20μmol/L 青藤碱处理OGD/R 干预后的BV-2 小胶质细胞24h,BV-2 细胞活性无明显降低(P>0.05)。50、100μmol/L 青藤碱处理OGD/R 干预后的BV-2小胶质细胞24h,BV-2 细胞活性明显降低(P<0.05)。因此,后续实验选取20μmol/L 作为青藤碱的终浓度。见表2。
表2 不同浓度青藤碱对BV-2 小胶质细胞活性影响(%,)

表2 不同浓度青藤碱对BV-2 小胶质细胞活性影响(%,)
注:OGD/R组为OGD/R诱导的BV-2小胶质细胞;10、20、50、100μmol/L 青藤碱组分别为OGD/R 干预后的BV-2 小胶质细胞用相应浓度青藤碱处理;OGD/R 为氧糖剥夺/复糖复氧;与OGD/R 组比较,aP<0.05
3.2 青藤碱降低BV-2 小胶质细胞细胞焦亡的LDH表达 LDH 释放试验检测结果发现,与正常组比较,OGD/R 组细胞LDH 相对释放量明显升高(P<0.05),20μmol/L 青藤碱处理后,OGD/R+青藤碱组BV-2 小胶质细胞LDH 相对释放量较OGD/R 组显著降低(P<0.05)。见表3。
表3 青藤碱抑制OGD/R 诱导的BV-2 小胶质细胞LDH相对活性()

表3 青藤碱抑制OGD/R 诱导的BV-2 小胶质细胞LDH相对活性()
注:正常组为正常培养的BV-2 小胶质细胞;OGD/R 组为OGD/R 诱导的BV-2 小胶质细胞;OGD/R+青藤碱组为OGD/R 诱导后,用含20μmol/L 青藤碱的高糖培养基培养的BV-2 小胶质细胞;OGD/R 为氧糖剥夺/复糖复氧;LDH 为乳酸脱氧酶;与正常组比较,aP<0.05;与OGD/R 组比较,bP<0.05
3.3 青藤碱降低BV-2 小胶质细胞的PI 阳性细胞数 经Hoechst/PI 染色后,免疫荧光实验结果表明,与正常组比较,OGD/R 组BV-2 小胶质细胞中PI 阳性细胞数明显上升(P<0.05),青藤碱作用于OGD/R诱导的BV-2 小胶质细胞后,细胞中PI 阳性细胞数明显降低(P<0.05)。见图1 和表4。

图1 BV-2 小胶质细胞Hoechst/PI 荧光染色图(比例尺=500μm)
表4 青藤碱降低OGD/R 诱导的BV-2 小胶质细胞PI阳性细胞数(%,)
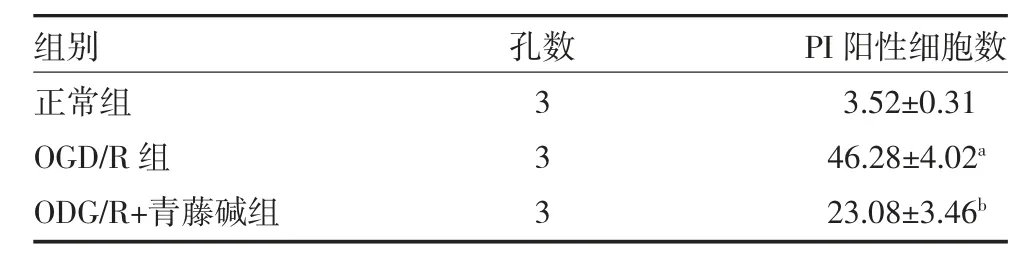
表4 青藤碱降低OGD/R 诱导的BV-2 小胶质细胞PI阳性细胞数(%,)
注:正常组为正常培养的BV-2 小胶质细胞;OGD/R 组为OGD/R 诱导的BV-2 小胶质细胞;OGD/R+青藤碱组为OGD/R 诱导后,用含20μmol/L 青藤碱的高糖培养基培养的BV-2 小胶质细胞;OGD/R 氧糖剥夺/复糖复氧;PI 为碘化丙啶;与正常组比较,aP<0.05;与OGD/R组比较,bP<0.05
3.4 青藤碱抑制TXNIP、NLRP3、caspase-1、IL-1β和IL-18 mRNA 的表达 RT-PCR 结果表明,OGD/R 组BV-2 小胶质细胞的TXNIP、NLRP3、caspase-1、IL-1β 和IL-18 mRNA 表达较正常组明显上升(P<0.05),而OGD/R 诱导的BV-2 小胶质细胞经青藤碱处理后,其TXNIP、NLRP3、caspase-1 和IL-1β 的mRNA 表达显著降低(P<0.05)。见表5。
表5 青藤碱对TXNIP、NLRP3、caspase-1、IL-1β 和IL-18 mRNA 表达的影响()
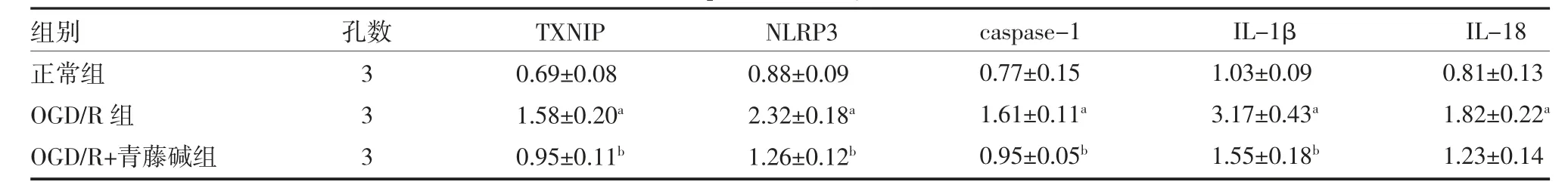
表5 青藤碱对TXNIP、NLRP3、caspase-1、IL-1β 和IL-18 mRNA 表达的影响()
注:正常组为正常培养的BV-2 小胶质细胞;OGD/R 组为OGD/R 诱导的BV-2 小胶质细胞;OGD/R+青藤碱组为OGD/R 诱导后,用含20μmol/L青藤碱的高糖培养基培养的BV-2 小胶质细胞;TXNIP 为硫氧还蛋白结合蛋白;NLRP3 为核苷酸结合寡聚化结构域样受体蛋白3;caspase-1为半胱氨酸天冬氨酸蛋白酶1;IL-1β 为白细胞介素1β;IL-18 为白细胞介素18;与正常组比较,aP<0.05;与OGD/R 组比较,bP<0.05
3.5 青藤碱抑制NLRP3/caspase-1 通路的激活和细胞焦亡相关蛋白的表达 Western blot 结果表明,相对于正常组,OGD/R 组BV-2 小胶质细胞的TXNIP、NLRP3、caspase-1、IL-1β 和IL-18 蛋白表达较正常组明显上升(P<0.05);而与OGD/R 组比较,青藤碱能显著下调TXNIP、NLRP3、caspase-1、IL-1β 和IL-18蛋白表达水平(P<0.05)。见图2 和表6。
表6 青藤碱对TXNIP、NLRP3、caspase-1、IL-1β 和IL-18 蛋白表达的影响()

表6 青藤碱对TXNIP、NLRP3、caspase-1、IL-1β 和IL-18 蛋白表达的影响()
注:正常组为正常培养的BV-2 小胶质细胞;OGD/R 组为OGD/R 诱导的BV-2 小胶质细胞;OGD/R+青藤碱组为OGD/R 诱导后,用含20μmol/L青藤碱的高糖培养基培养的BV-2 小胶质细胞;TXNIP 为硫氧还蛋白结合蛋白;NLRP3 为核苷酸结合寡聚化结构域样受体蛋白3;caspase-1为半胱氨酸天冬氨酸蛋白酶1;IL-1β 为白细胞介素1β;IL-18 为白细胞介素18;与正常组比较,aP<0.05;与OGD/R 组比较,bP<0.05

图2 TXNIP、NLRP3、caspase-1、IL-1β 和IL-18 蛋白印记图
4 讨论
炎症是脊髓损伤的重要生物学过程,及时抑制脊髓损伤后的炎症反应有利于改善脊髓损伤,促进脊髓修复[7-8]。近期有研究进一步表明,与炎症密切相关的细胞焦亡在脊髓损伤过程中发挥着重要的作用[9]。因此,通过药物抑制细胞焦亡及炎症是治疗脊髓损伤的可行方案。青藤碱提取于我国传统中草药青风藤,具有生物活性高等优点[5],是近年来的研究热点。有研究表明,青藤碱能通过抑制NLRP3 治疗缺血性脑卒中、急性肝损伤、骨关节炎等疾病[10-12]。因此,本研究以青藤碱为研究对象,观察其对脊髓损伤模型中小胶质细胞NLRP3/caspase-1 通路的影响。
NLRP3/caspase-1 通路在细胞焦亡中发挥重要作用[13]。NLRP3 炎症小体是由Pro-caspase-1、NLRP3和凋亡相关微粒蛋白(apoptosis-associated specklike protein containing CARD,ASC)所组成的蛋白复合体,能进一步激活caspase-1。而活化的caspase-1能切割Gasdermin D,形成含有Gasdermin D 氮端活性域的肽段,该肽段能与细胞膜的磷脂蛋白相结合并促使细胞膜穿孔,细胞破裂,释放包含LDH 等细胞内容物,致使细胞焦亡[14]。本研究使用OGD/R 模型处理BV-2 小胶质细胞后,细胞LDH 释放量及Hoechst/PI 染色阳性细胞数较正常组明显提升,即细胞焦亡水平升高。然而,用合适浓度(20μmol/L)的青藤碱处理OGD/R 组的BV-2 小胶质细胞后,LDH 活性检测和Hoechst/PI 染色试验结果证实青藤碱能抑制细胞焦亡。另一方面,随着细胞焦亡通路中caspase-1 的激活,活化的caspase-1 能对IL-1β 和IL-18 前体进行切割,形成有活性的IL-1β 和IL-18,募集炎症细胞聚集,诱发级联放大的炎症反应[15-16]。为了进一步探究青藤碱抑制细胞焦亡的具体机制,本研究通过RT-PCR 和Western blot 技术检测细胞焦亡通路中关键因子TXNIP、NLRP3 和caspase-1 mRNA 和蛋白的表达。结果发现,青藤碱能够通过调控NLRP3/caspase-1 通路抑制BV-2 小胶质细胞焦亡及进一步的炎症反应。
综上所述,本研究表明,青藤碱可能通过调控NLRP3/caspase-1 通路抑制BV-2 小胶质细胞焦亡及炎症反应,为青藤碱的药理学研究和临床脊髓损伤的治疗提供了新的思路。
