阻断CCR2信号对IgA肾病模型大鼠肾病理损伤及炎性因子表达的影响
2021-12-23沈雁婕朱志清闫莉莉任振华
沈雁婕,朱志清,王 蕊,闫莉莉,鹿 玲,张 琴,任振华
IgA肾病(IgA nephropathy, IgAN)是指肾小球系膜区以IgA沉积和系膜细胞增殖为特征的原发性肾小球肾炎。IgA1合成和糖基化异常,导致循环半乳糖缺陷型IgA1增加失调。异常糖基化的IgA1与特定的自身抗体形成免疫复合物,沉积在肾小球引起其系膜细胞增殖[1]。同时,免疫复合物诱导增殖的系膜细胞释放炎症因子和趋化因子,促进肾脏组织炎症反应,进一步导致肾脏间质纤维化[2]。目前,IgAN的具体发病机制尚不清楚,临床以保守治疗和皮质类固醇药物治疗为主[3],但药物毒副作用较大且疗效不显著。因此,明确IgAN的发病机制,寻找新的治疗方法显得尤为迫切。C-C趋化因子受体2(C-C chemokine receptor 2, CCR2)信号通路被认为与多种肾病相关[4-5],但MCP-1/CCR2在IgAN中的作用尚不清楚。奥美沙坦是一类血管紧张素II受体拮抗剂,常用于IgAN治疗[6-7]。本实验着重探讨CCR2在IgAN模型大鼠肾组织中的表达及与肾脏病理的关系,分析CCR2信号通路在IgAN发生、发展中的作用,为临床治疗IgAN提供参考。
1 材料与方法
1.1 试剂兔抗大鼠CCR2抗体购自BioVision公司;CCR2阻滞剂RS102895购自Tocris Bioscience公司;炎症因子IL-6、IL-17和TNF-α抗体及趋化因子MCP-1抗体和山羊抗大鼠IgA抗体,均购自Abcam公司。二抗、DAB显色试剂盒等,均购自北京中杉金桥公司。奥美沙坦购自国药集团;ECL增强化学发光试剂盒、牛血清白蛋白、脂多糖、二硫苏糖醇等,均购自美国Sigma公司。逆转录酶、DNA聚合酶等,购自Promega公司;造模用蓖麻油和四氯化碳,均购自天津光复化工公司。
1.2 实验动物及分组Wistar大鼠48只(6周龄),雄性,每只质量(150±10)g,购自安徽医科大学实验动物中心。Wistar大鼠随机分成正常对照组(14只)和IgAN模型组(34只)。参照汤颖等[8]的造模方法建立IgAN模型,首先用BSA(100 g/L)每隔1天给大鼠灌胃(4 mL/kg),合计8周;皮下注射0.3 mL蓖麻油和0.1 mL四氯化碳,每周1次,合计注射9次;第6和第8周的第一日尾静脉注射0.05 mg脂多糖,对照组采用等量氯化钠溶液。第7和第12周末取2只对照组及IgAN模型组大鼠,取肾脏皮质以备荧光染色和病理染色。造模完成后,将30只IgAN模型大鼠随机分成IgAN模型组、CCR2拮抗剂组和奥美沙坦组,每组10只。CCR2拮抗剂组大鼠RS102895(10 mg/kg)灌胃,奥美沙坦组以Olmesartan(10 mg/kg)灌胃,IgAN模型组以同等剂量生理盐水代替,1天1次,持续2周,第14周末处死大鼠,取肾皮质备用。
1.3 方法
1.3.1血液和尿液标本检测 收集各组大鼠尿液和血液样本,在第7、9、12、14周末收集24 h尿液,在第12周末和第14周末采集血液样本。生化分析仪测定24 h尿蛋白(NPr)、血尿素氮(BUN)、血肌酐(SCre)和血尿酸(UA),各组样本分3次检测,取平均值统计比较。
1.3.2肾组织切片及染色 处死动物,取肾皮质组织块,经4%多聚甲醛固定,石蜡包埋,5 μm厚连续切片。标本行HE、PAS、PASM和Masson染色,观察肾脏组织病理改变及肾小球系膜细胞增生。切片常规脱蜡至水,分别行IgA荧光染色和DAB染色。荧光染色一抗采用山羊抗大鼠IgA过夜,二抗为FITC标记兔抗山羊IgG;DAB染色采用3%H2O2室温30 min,5%BSA室温封闭1 h,加一抗4 ℃孵育过夜,室温复温1 h。洗涤后,辣根过氧化物酶标记二抗室温孵育1 h,DAB工作液显色,苏木精复染,封固后显微镜观察拍片。阴性对照以PBS代替一抗染色。
1.3.3Western blot法 肾脏组织称重加入裂解缓冲液,4 ℃震荡破碎,低温离心30 min取上清。测定蛋白浓度,煮沸蛋白,-80 ℃分装保存。30 μL蛋白样品电泳,PVDF膜电转,5%BSA或5%脱脂奶粉封闭1 h,加入一抗4 ℃孵育过夜,TPBS洗膜3次,每次5 min,HRP标记的二抗IgG室温孵育1 h,ECL化学发光试剂盒显色,Bio-rad凝胶成像系统拍摄。
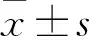
2 结果
2.1 各组大鼠肾功能损伤表现实验过程中IgAN模型大鼠出现不同程度的精神不振,食欲下降。造模第7周大鼠出现NPr,并呈进行性加重。造模第8周,大鼠出现镜下血尿。造模第14周末,IgAN模型组大鼠24 h NPr、SCre、BUN水平明显升高(P<0.01,图1)。与IgAN模型组相比,CCR2拮抗剂组和奥美沙坦组处理后,24 h Npr、BUN和SCre水平明显下降(P<0.01),UA水平未见明显变化。

图1 各组大鼠尿液和血液样本检测:A.24 h尿蛋白;B.血肌酐;C.血尿素氮;D.血尿酸;**P<0.01,##P<0.01
2.2 各组大鼠肾脏病理学改变第14周末IgA免疫荧光结果显示,IgAN模型大鼠肾小球系膜区IgA沉积,强度为IgA(~),CCR2拮抗剂RS102895能明显缓解IgAN模型大鼠肾小球系膜区IgA沉积。HE、Masson、PASM和PAS染色结果显示,与正常对照组相比,IgAN模型组大鼠肾组织可见肾小球肿胀,体积增大,系膜区细胞及基质增生,基膜空泡变性。与IgAN模型组相比,CCR2拮抗剂组和奥美沙坦组能明显缓解大鼠肾小球系膜细胞和基质增生(图2)。
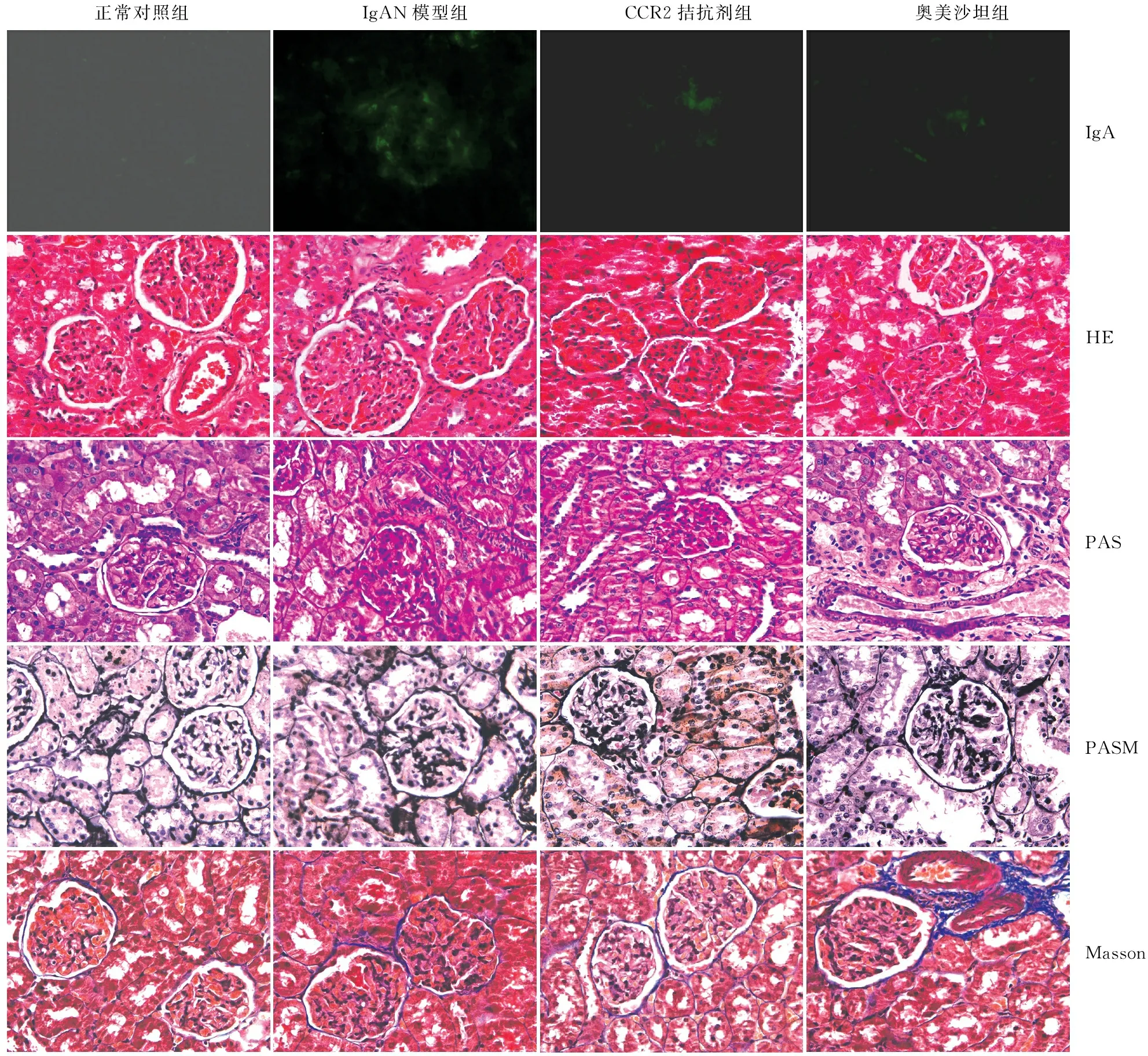
正常对照组IgAN模型组CCR2拮抗剂组奥美沙坦组IgAHEPASPASMMasson
2.3 各组大鼠肾组织炎症因子的表达正常对照组和IgAN模型组大鼠肾组织均表达CCR2,以肾小管的表达最为强烈(图3A)。与正常对照组相比,IgAN模型组大鼠与CCR2拮抗剂组大鼠的肾脏组织CCR2的表达明显增强(P<0.05),以CCR2拮抗剂组更为明显,而奥美沙坦组CCR2表达降低(P<0.05,图3B)。Western blot法结果亦证实,与正常对照组相比,IgAN模型组与CCR2拮抗剂组大鼠肾脏组织CCR2表达明显增强(P<0.05,图3C、D)。
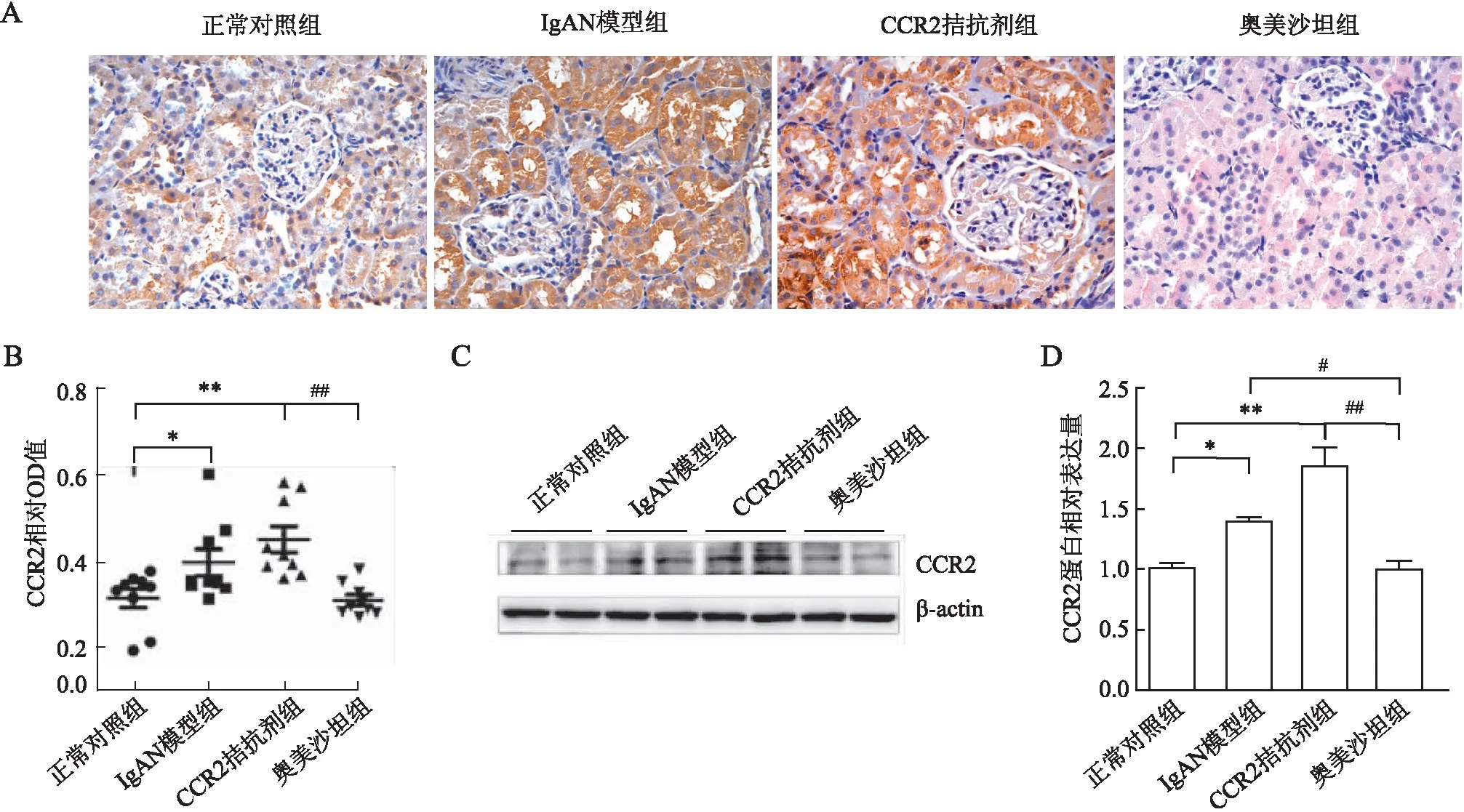
图3 大鼠肾组织中CCR2表达检测:A.各组大鼠肾组织中CCR2的表达,PV两步法;B.免疫组化OD值分析;C.Western blot法检测各组大鼠肾组织中CCR2表达;D.Western blot法检测CCR2表达的定量分析:*P<0.05,**P<0.01,#P<0.05,##P<0.01
正常对照组大鼠肾小球基本无MCP-1阳性信号,IgAN模型组大鼠肾小球仅有少量MCP-1阳性细胞,MCP-1阳性信号主要集中于肾小管。与正常对照组相比,IgAN模型组大鼠肾组织中MCP-1阳性信号明显增强(P<0.05),而CCR2拮抗剂和奥美沙坦处理后能明显降低MCP-1的表达(P<0.05,图4)。
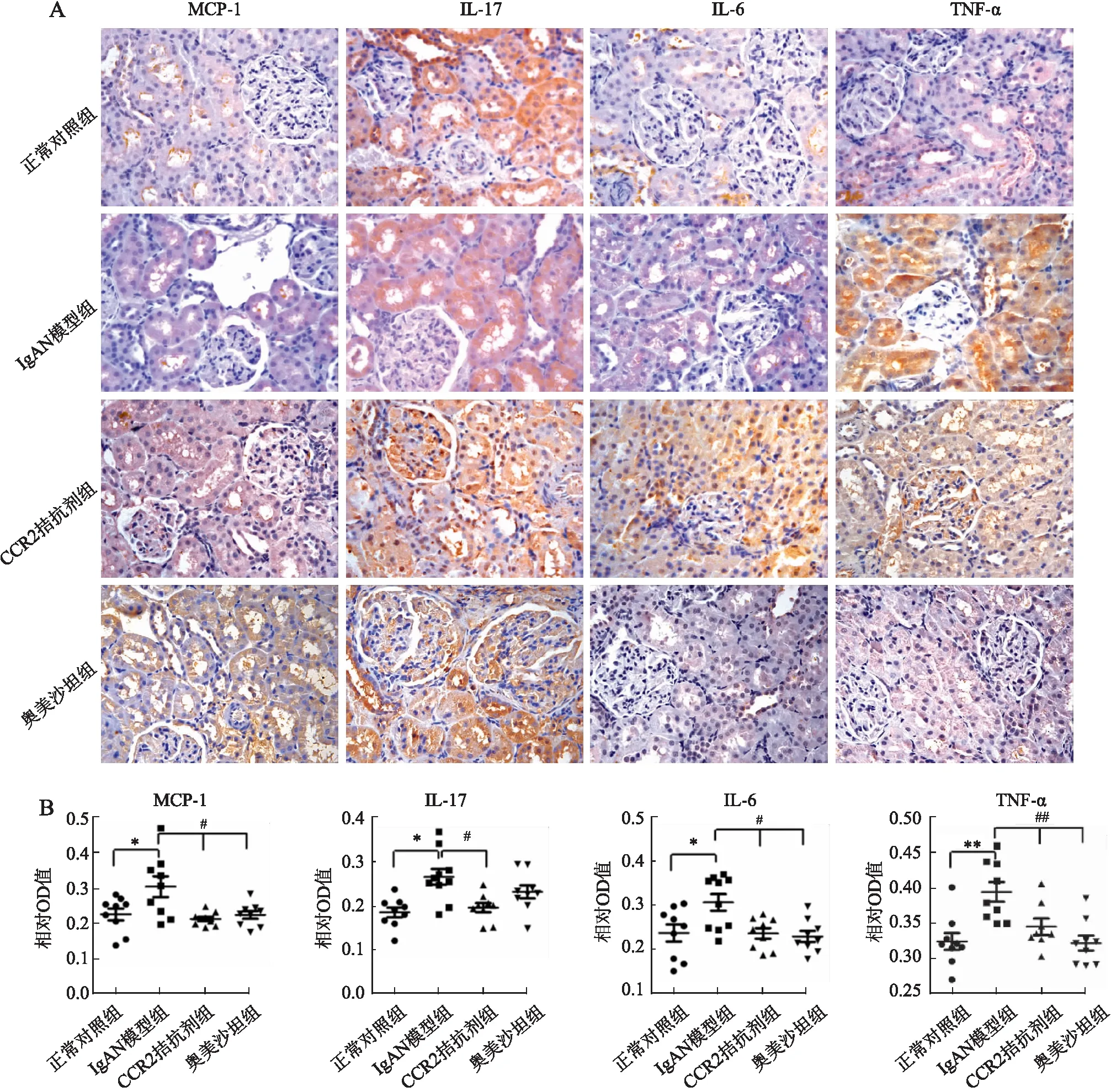
图4 大鼠肾组织中MCP-1、IL-17、IL-6和TNF-α表达检测:A.各组肾组织中标志物的表达,PV两步法;B.各组免疫组化OD值分析:*P<0.05,**P<0.01,#P<0.05,##P<0.01
正常对照组大鼠肾组织中有少量IL-6和IL-17表达,主要集中于集合管。与对照组相比,IgAN模型组大鼠肾组织中IL-6和IL-17阳性信号明显增加(P<0.01),IL-6阳性信号主要集中于肾小球和集合管,而IL-17阳性信号主要集中于肾小球和肾小管。CCR2拮抗剂和奥美沙坦能降低模型大鼠肾组织中IL-6和IL-17的表达(P<0.05,图4A)。
正常对照组肾组织仅少量表达TNF-α,IgAN模型大鼠肾组织中TNF-α阳性信号明显增加(P<0.05),阳性信号主要集中于肾小球和集合管。CCR2拮抗剂和奥美沙坦能降低IgAN模型组肾组织的TNF-α阳性信号(P<0.05,图4B)。
3 讨论
IgAN又称Berger病,是全球范围内最常见的原发性肾小球肾炎,其病理特征是异常糖基化的IgA1复合物在肾小球系膜区沉积[4]。目前,IgAN发病机制仍不清楚,可能与感染、炎症、免疫反应等多种因素有关。IgAN临床、病理表现多样化,预后有异质性,尚无特效的治疗方法。
MCP-1属于CC亚家族,具有较强的趋化性,可以激活单核细胞/巨噬细胞,分泌多种炎症因子和纤维化因子。有文献报道IgAN患者中MCP-1水平与24 h NPr、肾小管间质损伤和血肌酐呈正相关,表明MCP-1可能与IgAN进展有关[9]。CCR2是MCP-1的受体,在炎症性疾病和自身免疫性疾病中发挥重要作用[10-11]。有研究报道,MCP-1和CCR2基因多态性可能影响IgAN的进展[4]。目前,尚未有研究报道CCR2信号通路在IgAN中的作用及机制。本实验通过建立IgAN大鼠模型,用CCR2拮抗剂干预后,对大鼠肾组织病理变化和相关临床指标进行检测,并以正常对照组、IgAN模型组和奥美沙坦组作为对照,观察CCR2在IgAN中的作用。本实验发现与正常对照组相比,IgAN模型组大鼠24 h NPr明显升高,BUN和SCre水平显著上升。用CCR2拮抗剂RS102895干预后,大鼠24 h NPr、BUN和SCre水平显著降低,提示CCR2拮抗剂对IgAN模型大鼠肾功能有改善作用。
异常糖基化的IgA1免疫复合物系膜沉积参与IgAN发生、发展,且系膜区IgA沉积物面积大小与IgAN病理组织学分级密切相关[12]。IgAN的诊断需评估肾活检标本并检测IgA符合物沉积,通常伴系膜/毛细血管内细胞增多和纤维化[13]。免疫荧光染色结果显示,IgAN组肾小球系膜区IgA沉积,荧光强度为IgA(~)。病理染色结果显示,IgAN模型大鼠肾组织中,系膜区细胞和基质增生,基膜空泡变性,提示造模成功。给予CCR2拮抗剂RS102895干预后,IgAN模型组大鼠肾小球系膜区IgA沉积明显减少,且系膜细胞和基质增生被缓解;提示CCR2拮抗剂能改善IgAN大鼠的病理学变化。
IgA1沉积于肾小球系膜区,引起肾小球系膜细胞增殖[14],而异常增殖的系膜细胞释放各种趋化因子和炎症因子,进一步促进系膜细胞增殖,进而导致肾小球损伤[2]。免疫组化结果显示,与正常对照组相比,IgAN模型组大鼠肾组织中炎症相关因子MCP-1、TNF-α、IL-6和IL-17阳性信号增强,与Zhang等[15]的结果一致。第12~14周给予CCR2拮抗剂干预后,上述炎症相关因子的阳性信号明显减弱。即CCR2拮抗剂能缓解IgAN模型组大鼠肾组织中的炎症反应。
综上所述,本实验结果显示,阻断CCR2信号途径能改善IgAN模型组大鼠的肾功能,减少系膜细胞增生和炎症反应,提示CCR2信号途径可能参与IgAN的发生、发展。为临床治疗IgAN提供新思路和理论依据,但CCR2信号通路在IgAN中的具体作用机制尚需进一步分析。
