不同染色条件对COVID-19 Nucleocapsid抗体免疫组化染色的比较
2021-12-23吉佳乐姚馨悦何志承
吉佳乐,林 爽,曾 晖,姚馨悦,李 杨,何志承
新型冠状病毒肺炎(coronavirus disease 2019, COVID-19)是一种由新型冠状病毒(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)引发的强传染性疾病,其通过呼吸道飞沫、气溶胶及携带病毒的分泌物进行传播。此外,无症状感染者也可能成为传染源,给全球尤其是老人、有基础性疾病的患者带来了严重的健康危机。因此,该病的防控和治疗至关重要。患者在感染COVID-19后期,部分组织器官可能会引发一系列复杂的生理变化和病理学症状[1]。姚小红等[2]研究表明:COVID-19病变主要以肺部病变最明显,免疫组化提示肺泡上皮细胞和巨噬细胞均存在COVID-19抗原表达,其还对肾脏、肝脏、心血管等其他脏器也有影响。免疫组化是病理诊断的重要辅助手段,可以帮助病理医师在诊断过程中明确组织中抗原的表达位置及阳性细胞比例,并对其进行定位、定性及定量的研究[3]。因此,免疫组化在临床病理诊断中不可替代,在COVID-19病理尸检工作中也发挥重要作用。由于Nucleocapsid是COVID-19新研发抗体,暂无相关文献报道,试剂盒说明书建议Western blot实验中一抗稀释浓度为1 ∶1 000~1 ∶5 000;酶联免疫吸附实验中一抗稀释浓度为1 ∶5 000~1 ∶10 000;但对免疫组化的稀释浓度及孵育条件无明确建议。本文现收集8例COVID-19尸检肺组织标本,分别使用全自动免疫组化染色仪和手工免疫组化进行染色,探讨其在不同操作条件下的免疫组化染色情况,以便得到定位准确、背景清晰的染色切片,更好地为COVID-19的病理诊断和临床治疗提供参考。
1 材料与方法
1.1 临床资料收集2020年3~6月陆军军医大学第一附属医院病理科8例COVID-19尸检石蜡包埋组织,以2.5 μm厚连续切片15张,85 ℃烤片30 min备用[4]。将COVID-19的Nucleocapsid抗体,分别按1 ∶2 000、1 ∶4 000、1 ∶8 000的比例进行稀释备用。
1.2 主要试剂及仪器COVID-19的Nucleocapsid(40143-R019)抗体,购自北京义翘神州公司。EDTA修复液和柠檬酸修复液(MVS-0100),均购自福州迈新公司。OptiView DAB IHC Detection Kit和Roche BenchMark全自动免疫组化染色机,购自美国Ventana公司。
1.3 HE染色及免疫组化
1.3.1HE染色 将备好的组织切片进行HE染色,具体流程如下:将切片脱蜡、脱水,苏木精染色 5 min,1%盐酸酒精分化数秒,1%氨水返蓝 2 min,水洗后再用伊红染色 1 min,切片经脱水、透明、封固,光镜下观察。
1.3.2全自动免疫组化仪染色 将备好的组织切片放入Roche BenchMark XT全自动免疫组化染色仪中,设定相应程序进行染色。程序设定如下:75 ℃条件下烤片4 min;EZ Prep溶液76 ℃脱蜡4 min;Cell Conditioning Solution(CC1)抗原修复液99 ℃修复36 min;抑制剂孵育45 min;加入一抗100 μL,36 ℃孵育32 min;Reaction Buffer Concentrate(10×)缓冲液清洗5 min;二抗37 ℃孵育8 min;DAB显色8 min,苏木精II衬染12 min,返蓝液返蓝4 min,脱水、透明、封固。
1.3.3手工免疫组化染色 组织切片经二甲苯-二甲苯-100%乙醇-100%乙醇-95%乙醇-75%乙醇常规脱蜡、水化、蒸馏水浸泡。采用高温高压修复,用柠檬酸(或EDTA)修复液修复2.5 min。自然冷却后置于3%H2O2中,37 ℃ 10 min,PBS冲洗3 min×3次。加入一抗,4 ℃孵育过夜(或37 ℃孵育1 h ),PBS冲洗3 min×3次;加入二抗,37 ℃孵育30 min,PBS冲洗3 min×3次。DAB显色,苏木精复染3 min,酸化后返蓝、脱水、透明、封固。
1.4 透射电镜扫描和COVID-19核酸检测将标本制备成厚度为100 nm的超薄切片,染色后用透射电子显微镜(日立HT7700,电压 100 kV)观察超微结构变化。提取的检测标本RNA用RT-PCR试剂盒(8.0131901X024E,厦门艾德生物公司)进行核酸检测。透射电镜扫描、核酸检测与免疫组化检测,均来自同一例尸检的肺组织标本。
2 结果
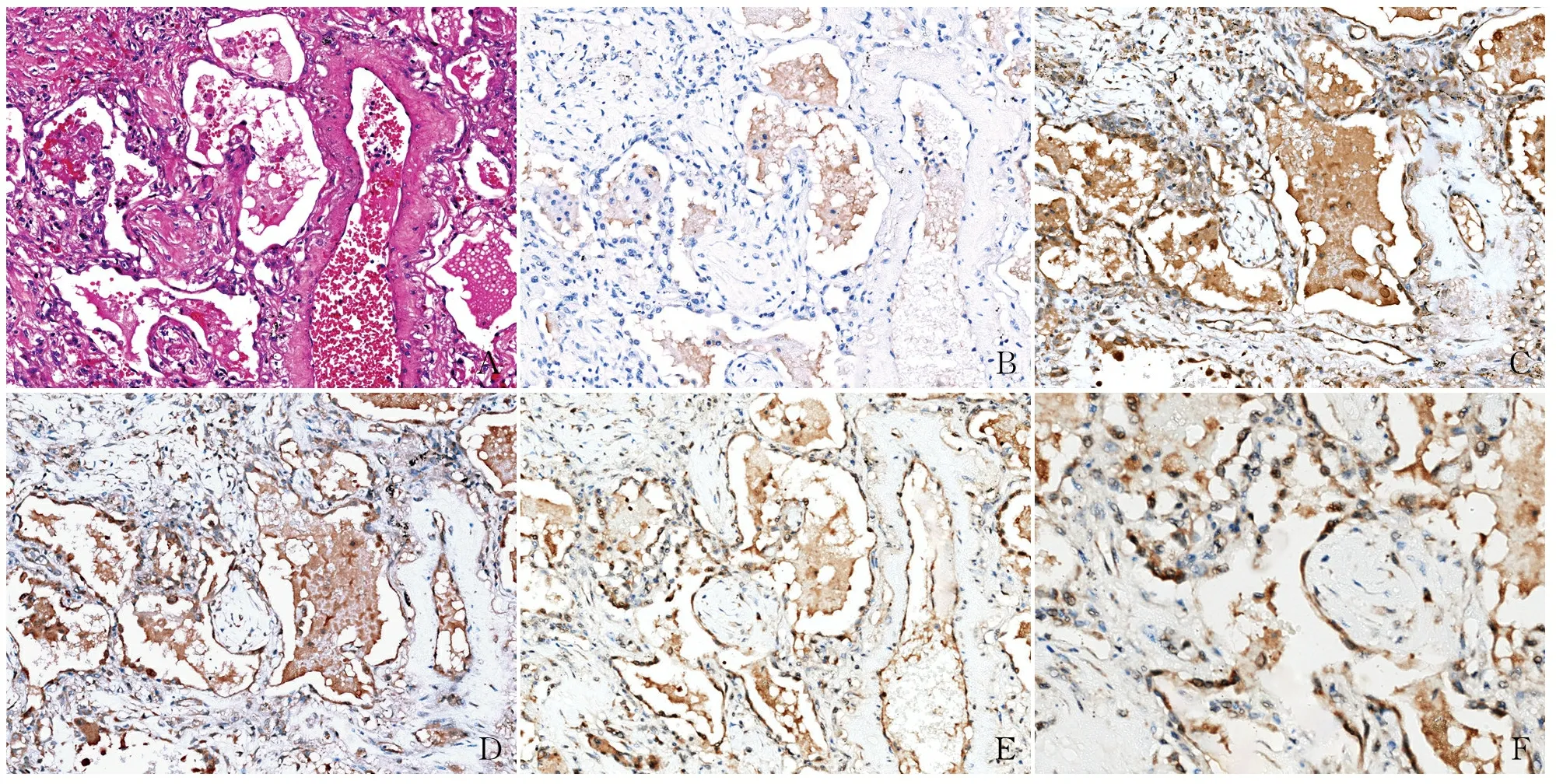
2.1 HE染色HE染色结果清晰可见肺泡上皮稍增生,肺泡腔内可见分泌物及出血,肺泡间隔增宽,纤维组织增生并见少量中性粒细胞浸润(图1A)。
2.2 全自动免疫组化染色仪最佳染色条件本科室采用Roch BenchMark全自动免疫组化染色平台,设置不同一抗浓度为1 ∶2 000、1 ∶4 000、1 ∶8 000和阴性对照的4个组别。结果显示:阴性对照组的组织待检细胞无阳性信号(图1B),提示COVID-19的Nucleocapsid抗体表达有特异性。在不同浓度的一抗中发现COVID-19的Nucleocapsid 抗体在肺泡Ⅱ型上皮细胞均呈阳性。其中,稀释比为1 ∶2 000(图1C)和1 ∶4 000(图1D)组的非特异性着色较为明显,稀释比为1 ∶8 000组阳性细胞染色更加清晰,特异性较高(图1E);高倍镜下视野可清晰观察到肺泡Ⅱ型上皮细胞呈阳性(图1F)。以上结果提示:全自动免疫组化染色仪检测COVID-19的Nucleocapsid抗体,按稀释比为1 ∶8 000可取得较好的染色效果。
ABCDEF
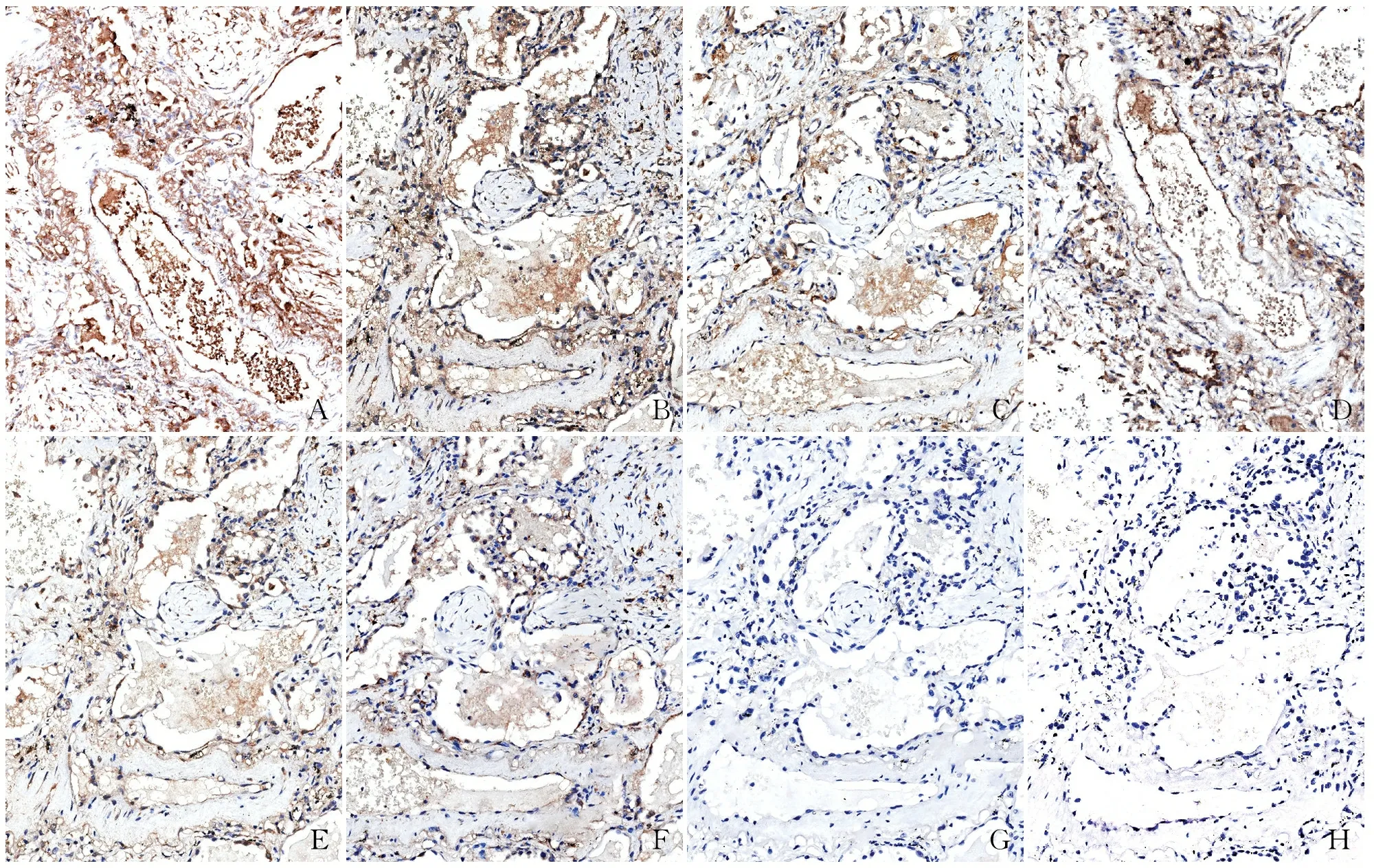
2.3 手工免疫组化最佳染色条件在进行手工免疫组化染色时,本组分别设置了不同的抗原修复条件、抗体孵育方式及一抗浓度。结果显示采用EDTA对抗原进行修复后,阳性细胞的着色强度明显高于柠檬酸修复,但其特异性较差,阳性着色部位不够明确。进一步通过不同方式进行一抗孵育,结果显示一抗4 ℃孵育过夜的染色效果优于37 ℃孵育1 h,其非特异性着色相对较少。在不同一抗浓度差异分析中发现,组织非特异性着色随着一抗稀释比的增加而逐渐降低,但是一抗1 ∶8 000稀释浓度未见阳性信号。因此,推荐采用1 ∶4 000的一抗稀释浓度。此外,阴性对照组无阳性信号。根据不同染色条件结果显示:手工免疫组化染色检测COVID-19的Nucleocapsid抗体时,最佳染色条件为柠檬酸修复、一抗4 ℃过夜孵育、一抗稀释比为1 ∶4 000(图2)。
ABCDEFGH
2.4 透射电镜扫描和COVID-19核酸检测将8例COVID-19尸检组织分别使用电镜扫描和核酸检测对免疫组化染色结果进行验证,发现病毒颗粒和PCR检测病毒阳性(图3),提示待检样本染色阳性的可靠性。
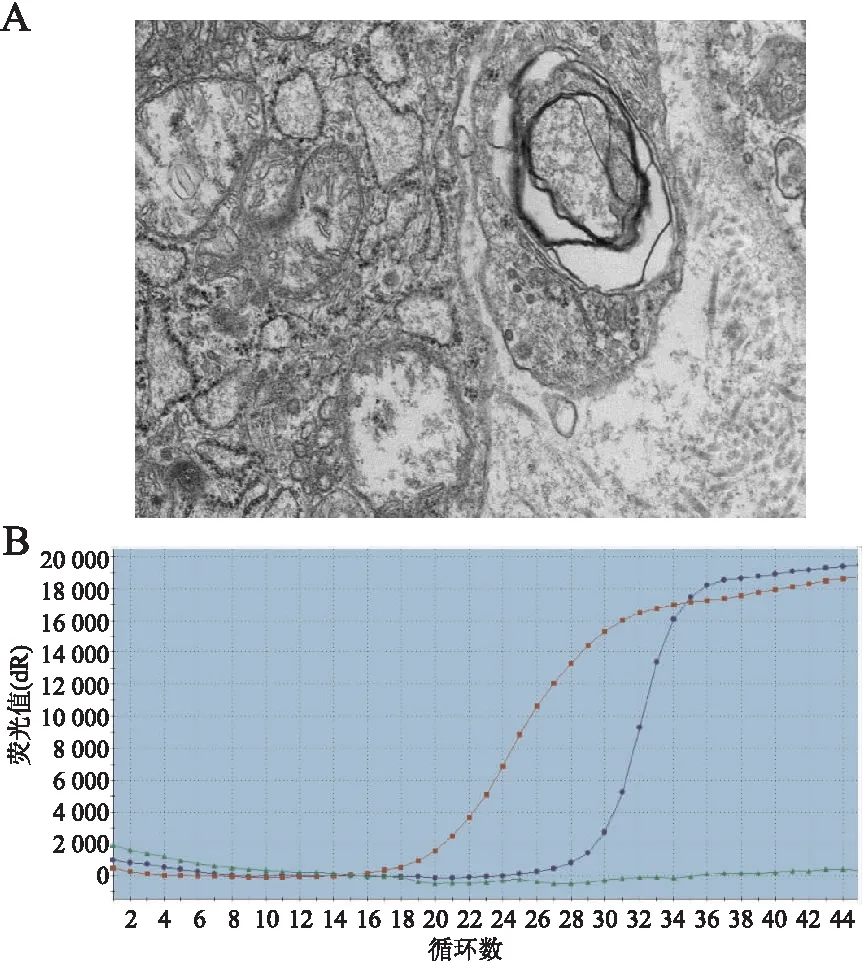
图3 透射电镜扫描和COVID-19核酸检测:A.透射电镜扫描显示肺组织内有病毒颗粒;B.COVID-19核酸检测为COVID-19阳性;红色是HEX通道,显示内参基因;蓝色是ROX通道,显示COVID-19开放阅读框1 ab基因的保守区域;绿色是FAM通道,显示COVID-19衣壳蛋白基因的保守区域
3 讨论
COVID-19具有高度传染性,其周期性大暴发及国际性传播对全球的公共卫生和经济发展构成重大的威胁,有效的防控和治疗至关重要。Bian等[5]研究发现:患者感染SARS-CoV-2后,将导致多处器官和组织受损伤,并伴明显的肺部病变。Yao等[6]通过电镜在肺Ⅱ型上皮细胞内发现直径为70~100 nm的新型冠状病毒颗粒,肺部组织切片经免疫组化染色后也证实在肺组织中存在SARS-CoV-2病毒。免疫组化是指利用抗原抗体特异性结合的原理,通过化学反应使标记抗体的显色剂(如荧光素、酶、金属离子和同位素)显色,以确定组织细胞内的抗原,并对其进行定位、定性及半定量的研究[7]。高质量的免疫组化染色效果更有利于结果的判读,对推进COVID-19病理机制的研究具有重要意义。免疫组化染色过程中的切片制备、抗原修复、抗体浓度及孵育条件、显色等各个环节均可能影响最终的结果,故探索其最优染色条件至关重要。
研究报道[8],由于COVID-19标本的特殊性,固定时间以48 h最佳,病毒标本必须间隔1 cm切开,并使用5~10倍固定液充分固定后再进行后续实验。此外,在切片制备过程中,要根据标本的类型选择合适的厚度。本组选用的是肺组织标本,切片过薄容易丢失部分抗原信号,过厚容易出现细胞堆积导致染色过深影响判读,且在高温高压抗原修复时容易掉片,故应选择适宜的厚度(3 μm)进行切片。烤片时温度不高于70 ℃,同时保持切片干燥,有利于组织和拨片充分粘合。由于前期经10%中性福尔马林固定形成醛键,遮蔽抗原决定簇,干扰抗原与抗体的特异性结合,行免疫组化染色时需进行抗原修复,使抗原决定簇充分暴露[9];但修复方式和修复液选择不当,均可能出现假阳性或假阴性。刘智等[10]研究证实,高温高压修复优于微波抗原修复,而柠檬酸(pH 6.0)和EDTA(pH 9.0)两种不同修复液也会影响免疫组化染色结果。因此,需要进行预实验对COVID-19的Nucleocapsid抗体最佳修复方式进行摸索。为去除细胞中残留的杂蛋白、内源性酶等,常使用过氧化物酶封闭液破坏酶活性,避免非特异性着色[11]。本实验结果提示:相同修复条件下使用同浓度抗体进行检测时,全自动免疫组化染色仪的染色效果优于手工免疫组化,特异性着色也相对较少,原因可能是Roche BenchMark全自动染色仪采用喷射式清洗技术,可均匀彻底的清洗切片,使染色背景更干净,染色结果更为清晰。此外,抗原抗体特异性结合达到平衡终点需要一定的温度、时间和浓度,故探讨抗体的孵育时间、温度和一抗浓度也至关重要。研究证明[12]:阳性细胞强度随一抗孵育温度升高而增强,但阳性细胞数量与孵育温度无直接关系,温度过高反而会降低抗原抗体结合效率。本实验结果显示,一抗4 ℃过夜孵育的染色质量优于37 ℃ 孵育1 h的染色质量,其染色清晰、着色均匀、特异性更高,提示手工免疫组化染色经4 ℃孵育更有利于抗原抗体的有效结合。本实验还发现全自动免疫组化染色仪和手工免疫组化染色的抗体特异性,均随着一抗浓度的增加而降低,两者最佳染色浓度分别为1 ∶8 000和1 ∶4 000,提示抗原抗体结合不仅受外界环境的影响,而且与抗体自身的浓度也显著相关,浓度太高或太低,都会影响抗原抗体的结合反应。除一抗浓度外,二抗的稀释比例和显色时间对染色结果也至关重要,二抗浓度过高或显示时间过长,均会出现着色较深、非特异性着色增加的现象。因此,对于新抗体一定要摸索出最佳染色条件后再进行实验,以得到更为优化、准确的结果。
随着越来越多新型抗体的出现,免疫组化染色结果在病理诊断、预后判断、指导治疗等方面发挥重要作用。在全球COVID-19暴发的特殊时期,准确的组织病理学诊断结果将有助于学者对该病毒感染机制的进一步分析,为后期疫苗和临床治疗药物的研发、诊治方案优化提供科学依据。因此,制作一张高质量的免疫组化染色切片也将为COVID-19的研究和临床诊断治疗提供必要的参考。
