尖晶石/层状异质界面的构筑提升富锂锰基正极材料电化学性能
2021-12-22高永恩贾梦哲戴仲葭杜泽学侯栓弟
高永恩,贾梦哲,李 刚,戴仲葭,姜 瑞,袁 蕙,杜泽学,侯栓弟
(1.中国石化 石油化工科学研究院,北京 100083;2.中国石化 大连石油化工研究院,大连 116045)
近年来,为了减少对石油等化石能源的依赖以及对环境保护的迫切需求,电动汽车(包括纯电动汽车、混合动力汽车等)得到了快速发展。动力电池是电动汽车的核心之一,其性能直接决定了电动汽车的续驶里程、安全性能、成本等。按照所使用正极材料的不同,动力电池主要分为三元电池和磷酸铁锂电池。三元电池能量密度较高(240~250 Wh/kg),使得电动汽车的续驶里程较长,其应用占市场份额的60%~70%。但即便是能量密度较高的三元电池,电动汽车的续驶里程一般也不超过500 km,因此需要发展更高能量密度的动力电池来进一步提高续驶里程。
富锂锰基正极材料(LLMO)放电比容量高(大于250 mAh/g),而且使用较少的镍和钴等金属,使其材料成本较低、安全性能较高,被认为是下一代锂离子动力电池的首选正极材料之一[1-4]。但该材料也存在首次库伦效率偏低、循环性能和倍率性能差,以及严重的电压衰减等诸多问题[5-8],这极大地阻碍了富锂锰基正极材料的商业化应用。预激活是减少富锂锰基材料首次充放电过程中释氧的有效手段,但目前的报道多是采用低浓度的盐酸、硫酸、硝酸等溶液洗涤富锂锰基正极材料,使得浅层晶格锂脱出,将材料预活化来提高首次库伦效率[9]。Zheng等[10]用过硫酸盐来处理富锂锰基材料,结果表明Na2S2O8处理后的富锂锰基材料首次库伦效率接近100%。Zheng等[11]将富锂锰基材料与NH4H2PO4溶液进行离子交换,构建了尖晶石相包覆层,有效提高了材料的首次库伦效率和倍率性能。但以上预激活方法对材料的晶体结构破坏性大,容易造成循环稳定性恶化[12],同时也存在工艺复杂、成本较高等问题。
笔者采用去离子水作为预激活剂,并结合二次焙烧改性工艺,促使富锂锰基正极材料表界面发生相变,原位形成了结构紧密连接的尖晶石/层状异质界面,该方法操作简单,成本低。尖晶石/层状异质界面可以使电极材料在放电过程中嵌入更多的Li+,有利于放电比容量和首次库伦效率的提高,还能够减少电解液对电极材料的腐蚀,提高电池循环性能,此外尖晶石相的三维扩散通道还能加快Li+传输速率,有利于提高材料的倍率性能。
1 实验部分
1.1 原料和试剂
七水硫酸钴(CoSO4·7H2O)、六水硫酸镍(NiSO4·6H2O),均为电池级,吉林吉恩镍业股份有限公司产品;一水硫酸锰(MnSO4·H2O),电池级,湖南汇通科技有限公司产品;碳酸锂(Li2CO3),电池级,赣锋锂业股份有限公司产品;碳酸氢铵(NH4HCO3)、无水碳酸钠(NaCO3)、盐酸,均为分析纯,天津大茂化学试剂厂产品;酚酞、甲基红、溴甲酚绿,指示剂级,北京一诺凯科技有限公司产品;聚偏氟乙烯(PVDF)黏合剂,电池级,阿科玛化工有限公司产品;乙炔黑,电池级,深圳市科景智达科技有限公司产品;N-甲基吡咯烷酮(NMP),分析纯,北京一诺凯科技有限公司产品;含1 mol/L六氟磷酸锂(LiPF6)的混合溶液(碳酸乙烯酯(EC)、碳酸二甲酯(DEC)、碳酸甲基乙基酯(EMC)按体积比V(EC)∶V(DEC)∶V(EMC)=1∶1∶1混合,简称EC-DEC-EMC溶液)为电解液,电池级,珠海赛维电子材料有限公司产品;锂金属片,电池级,天津中能锂业有限公司产品。
1.2 材料的合成
1.2.1 富锂锰基正极材料的合成
将MnSO4·H2O、NiSO4·6H2O和CoSO4·7H2O按照摩尔比n(MnSO4·H2O)∶n(NiSO4·6H2O)∶n(CoSO4·7H2O)=0.54∶0.13∶0.13加入到去离子水中配制成盐溶液A,金属离子总摩尔浓度为2 mol/L;将无水Na2CO3和NH4HCO3按一定的比例溶解到去离子水中配制成碱溶液B,Na2CO3和NH4HCO3的总摩尔浓度为2.2 mol/L。在反应釜中加入一定量去离子水作为底液,将盐溶液A及碱溶液B按照相同的速率并流加入到强烈搅拌的反应釜中,控制反应温度为50 ℃,pH值为7.2~7.5,搅拌速率为700 r/min。待反应完成后,陈化12 h,将釜内浆料过滤、洗涤、烘干,得到富锂锰基碳酸盐前驱体Mn0.54Ni0.13Co0.13(CO3)0.8。
将Li2CO3和前驱体Mn0.54Ni0.13Co0.13(CO3)0.8按照摩尔比n(Li)∶n(M)=1.30∶1(M =Mn+Ni+Co)球磨混合2 h,然后将混合物料装入匣钵,放入气氛炉中焙烧,焙烧气氛为空气气氛,在550和700 ℃下分别焙烧5 h,随后升温至850 ℃并保温15 h,焙烧完成后随炉冷却,破碎、过筛,得到富锂锰基基础材料Li1.09Mn0.54CO0.13Ni0.13O2,标记为W-0。
1.2.2 富锂锰基正极材料的表界面改性
将富锂锰基基础材料W-0按质量比m(W-0)∶m(H2O)=1∶10加入到去离子水中,于80 ℃下剧烈搅拌30 min。水洗时间设置为30 min,主要是因为随着水洗时间的增长,材料表面的残碱会逐步降低并趋于稳定[13]。搅拌完成后,抽滤、烘干,将物料转移至气氛炉中,焙烧气氛为空气气氛,分别在100、300和500 ℃下热处理5 h,将热处理后的物料过筛、密封包装,样品分别标记为W-1、W-2和W-3。
1.3 材料的物化性能表征
采用美国Philips公司的X射线粉末衍射仪对富锂锰基正极材料进行XRD物相分析,采用Cu靶阳极Kα辐射源,步宽0.02°,扫描速率为2 °/min,2θ=10°~80°;采用扫描电子显微镜(SEM,FEI QUANTA400)对富锂锰基材料进行样品形貌分析,加速电压为20 kV;采用北京精微高博科学技术有限公司JW-DA比表面积测试仪对材料进行比表面积分析,测试方法为低温N2吸/脱附法;采用美国Thermo Fisher Thermo ESCALAB 250型X-射线光电子能谱仪对富锂锰基正极材料表面的Ni、Co、Mn的相对含量进行测试,使用AlKα X射线发射光源;采用日本HORIBA公司生产的LabRAM HR UV-NIR型激光共聚焦拉曼光谱仪(Raman)对富锂锰基正极材料的局部结构进行测定,激发光源波长532 nm,50倍物镜,共焦针孔直径100 μm,扫2次取平均值;通过酸碱滴定法对富锂锰基正极材料进行表面残碱含量分析。
1.4 电池组装与电化学测试
将富锂锰基正极材料、乙炔黑和PVDF按照质量比为8∶1∶1的比例加入到NMP中,混合均匀后涂覆在铝箔上,110 ℃干燥1 h,将干燥的极片辊压,用冲片机裁成直径为12 mm的正极片,在真空烘箱中于110 ℃真空干燥12 h。以金属Li片为负极,1 mol/L的LiPF6的EC-DEC-EMC溶液(V(EC)∶V(DEC)∶V(EMC)=1∶1∶1)为电解液,单层聚乙烯膜(Celgard 2300)为隔膜,在充满氩气的手套箱中组装成CR2032扣式半电池。采用武汉LAND CT3001A 1U电池性能测试系统对所制备扣式电池进行电化学性能测试,温度保持在25 ℃,充放电电压范围为2.0~4.6 V,前5次循环充放电倍率为0.1 C(1 C=250 mA/g,下同),其后50次循环充放电倍率为0.2 C;采用中国华科普天公司生产的CHI 660D型电化学工作站进行循环伏安测试,电压扫描范围为2.0~4.8 V,扫描速率为0.1 mV/s;采用英国输立强EnergyLab XM电化学工作站对电池进行交流阻抗(EIS)测试,测试频率范围为0.01~100000 Hz,振幅为5 mV,将扣式电池以0.1 C充电至4.2 V,静置5 h后进行EIS测试。
评价正极材料电化学性能的指标包括首次放电比容量、首次库伦效率、容量保持率等。
扣式电池首次放电比容量(CDS,mAh/g)的计算如式(1)所示。
CDS=CD/m
(1)
式(1)中:CD为扣式电池首次放电容量,mAh;m为正极极片活性物质的质量,g。
首次库伦效率(EIC,%)的计算如式(2)所示。
EIC=CDS/CCS×100%
(2)
式(2)中:CCS为扣式电池首次放电比容量,mAh/g。
容量保持率(CRR,%)的计算如式(3)所示。
CRR=C1/C2×100%
(3)
式(3)中:C1为电池以0.1 C循环5圈得到的放电比容量,mAh/g;C2为在C1的基础上接着以0.2 C循环50圈最终得到的放电比容量,mAh/g。
2 结果与讨论
2.1 富锂锰基正极材料物化性能表征
2.1.1 XRD晶体结构表征
图1为富锂锰基正极材料改性前后样品的XRD对比图。从图1可以看出,4种样品中,除2θ为20°~30°范围内的超晶格峰外,其他峰均符合α-NaFeO2层状结构,属于六方晶系、R-3 m空间群[14]。位于2θ约23°的弱衍射峰对应于Li2MnO3相中LiMn6的超晶格结构,该峰是富锂锰基材料的典型特征峰[15]。此外,4种样品均在(006)、(012)和(018)、(110)晶面这2组峰分裂明显,表明富锂锰基正极材料改性前后样品的层状结构均良好。

图1 富锂锰基正极材料改性前后样品的XRD谱图Fig.1 XRD patterns of LLMO samples before and after modification
对富锂锰基正极材料改性前后样品的晶胞参数进行计算,其结果见表1,其中a、c为沿晶胞边方向且长度与边长相等的晶胞基矢。由表1可以看出,与W-0样品相比,改性后的富锂锰基材料c/a不同程度的增大,表明材料层状结构的有序性有所增加。

表1 富锂锰基正极材料改性前后样品的晶格参数Table 1 Lattice parameters of LLMO samples before and after modification
a没有明显变化,c明显增大,表明层状结构沿c轴方向逐渐扩展。c变化的原因可能是H2O中的H质子与富锂锰基材料中的Li+进行离子交换,从锂层中抽提Li+的同时,形成了氧空位,导致氧层之间的屏蔽减弱[11,16]。因此水洗/二次焙烧改性工艺的作用范围为表界面,没有改变富锂锰基材料主体的层状结构,且改性工艺可能使得富锂锰基材料表界面发生质子交换,导致氧空位的产生。
2.1.2 SEM微观形貌表征
对富锂锰基正极材料改性前后样品的微观形貌进行了表征,其SEM照片如图2所示。由图2(a)可知,富锂锰基正极材料未经改性的W-0样品呈类球形且表面光滑,粒径10 μm左右。由图2(b)~(d)可知,改性后的富锂锰基正极材料,仍保持较好的球形形貌,并没有发生破裂现象,说明水洗/二次焙烧改性工艺不会改变富锂锰基材料的微观形貌。图2(e)~(h)为富锂锰基正极材料改性前后样品更高放大倍数的电镜图。由图2(e)~(h)可以看出,富锂锰基正极材料改性前后的一次颗粒均为纳米级小颗粒,改性前后的形貌和尺寸也并无明显改变。此外,富锂锰基正极材料在改性前表面残存少量碎屑,这可能是材料在破碎过程中产生的;而经改性处理后,材料表面更加光滑平整,几乎没有碎屑的存在[13,17]。

图2 富锂锰基正极材料改性前后样品的SEM照片Fig.2 SEM images of LLMO samples before and after modification(a),(e)W-0;(b),(f)W-1;(c),(g)W-2;(d),(h)W-3
2.1.3 残碱含量分析
富锂锰基正极材料表面的残碱含量过高会使得材料制浆时易吸水成果冻状,其次表面残存的Li2CO3会与电解液反应生成LiF覆盖在电极材料表面,增大界面阻抗;高电压下Li2CO3会发生分解产生CO2,导致电池胀气。富锂锰基正极材料的充电电压通常在4.5 V以上,因此降低表面残碱对提高富锂锰基材料的电化学性能及安全性至关重要。
对富锂锰基正极材料改性前后样品进行了残碱含量测定,结果见表2。从表2可以看出:W-0样品总残Li含量最高,质量分数为0.1948%,且大多以Li2CO3的形式存在;改性后的富锂锰基材料表面总残Li量显著降低,质量分数约为0.04%,下降了79.5%左右。其中改性后样品的Li2CO3含量下降最为显著,W-1、W-2、W-3中的Li2CO3质量分数分别为0.2407%、0.2301%、0.2482%,与W-0样品中Li2CO3质量分数0.9966%相比,分别下降了75.8%、76.9%和75.1%,这说明水洗/二次焙烧改性工艺可以有效降低表面残碱含量,尤其残留Li2CO3含量下降幅度较大。

表2 富锂锰基正极材料改性前后样品的表面残碱含量Table 2 Surface residual alkali content of LLMO samples before and after modification
2.1.4 比表面积表征
对富锂锰基正极材料改性前后样品比表面积进行了测试。W-0、W-1、W-2、W-3的比表面积分别为5.33、6.45、8.08、5.76 m2/g。相比W-0样品,W-1和W-2样品的比表面积均有所增加,这可能是在改性过程中一次晶粒之间残留的Li2CO3和LiOH被去除后,暴露出了新的晶面,导致比表面积增大[13]。而W-3样品经500 ℃二次焙烧后,相邻的一次晶粒之间又进行了融合重构,使得比表面积又有所降低,比表面积的降低将有助于减少活性材料与电解液之间的副反应,提升材料的循环性能。
2.1.5 拉曼光谱表征
拉曼散射光谱可以用来检测材料短程局部结构,因此对富锂锰基正极材料改性前后样品进行了拉曼测试,结果如图3所示。由图3可知,4种样品均在490和600 cm-1处有2个主要宽带,分别代表R-3 m 结构中Eg和A1 g的振动结构。400 cm-1附近窄而弱的峰为Li2MnO3相中Li—O的振动峰[18]。而W-3样品除保持富锂锰基正极材料的各特征峰外,在630 cm-1处出现了一个新的拉曼带,该峰对应于Fd-3 m尖晶石结构带,与之前文献报道结果一致[19-20]。该尖晶石相形成的原因可能是改性过程中H质子与Li+发生离子交换,Li+被抽提的过程中伴随着氧流失,促使材料发生层状向尖晶石的相变[11-12]。以上结果表明水洗/二次焙烧改性工艺能够诱导富锂锰基材料表界面尖晶石相的产生,且主体结构仍能得以保持。
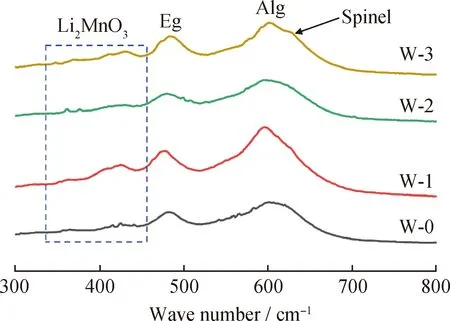
图3 富锂锰基正极材料改性前后样品的拉曼谱图Fig.3 Raman spectra of LLMO samples before and after modification
2.1.6 X射线光电子能谱表征
为探究富锂锰基正极材料改性前后样品中各过渡金属化学态的变化,对4种样品进行了XPS测试,结果如图4所示,图4(a)和(b)分别为Mn、Co的2p谱图,图4(c)为Ni的2p分峰谱图。由图4(a)和(b)可以看出,改性前后样品的峰几乎没有发生偏移,从峰位上可以判断其化合价为Mn4+和Co3+。由图4(c)可以看出,随着二次焙烧温度的提高,W-0、W-1、W-2、W-3样品的Ni2+质量分数逐渐降低,从69.7%逐渐下降到42.5%,而Ni3+质量分数从30.3%逐渐增加到57.5%。这是由于Ni在3种过渡金属中的化学势最高,改性过程预先形成的氧空位会导致Ni2+首先被氧化为Ni3+,而对Mn和Co的价态几乎没有影响[16],这也间接说明了改性工艺在富锂锰基正极材料的表界面构造了氧空位。

Take the peak area corresponding of Ni 2p3/2 as the standard for calculating Ni2+ and Ni3+图4 富锂锰基正极材料改性前后样品的XPS表征Fig.4 XPS profiles of LLMO samples before and after modification(a)Mn 2p;(b)Co 2p;(c)Ni 2p
2.2 电化学性能表征
对富锂锰基正极材料改性前后样品进行了电化学性能测试,结果如图5所示。从图5可以看出,所有材料的首次充电曲线都由一条光滑的倾斜电压区(≤4.5 V)和平台区(≥4.5 V)组成,分别代表Ni2+→Ni4+、Co3+→Co4+的氧化以及Li2O从Li2MnO3中的脱出[21-22]。同时可以看到改性后样品的4.5 V放电平台明显缩短[12],这是由于在水洗过程中Li2MnO3相中的Li+提前被激活从结构中脱出,同时伴随着晶格氧的释放导致。

图5 富锂锰基正极材料改性前后样品在0.1 C倍率下的首次充放电曲线Fig.5 Curves of initial charge and discharge at a rate of 0.1 C for LLMO samples before and after modificationConditions:Voltage scan range 2.0—4.6 V;Room temperature;1 C=250 mA/g
表3为富锂锰基正极材料改性前后样品的首次充放电数据。由表3可知,W-0、W-1、W-2和W-3样品的首次放电比容量分别为279.0、272.8、277.0、286.6 mAh/g。与W-0样品相比,W-1、W-2样品放电比容量略有降低,首次库伦效率有所提高,而W-3样品的放电比容量和首次库伦效率均有明显提高,分别达286.6 mAh/g和91.89%。这是因为W-3样品的放电曲线在2.6 V附近有一个明显的放电小平台(见图5虚线框),使得材料可以嵌入更多的Li+,有利于放电比容量和库伦效率的提高。有相关文献表明,该小平台对应了尖晶石相中Mn4+还原为Mn3+的氧化还原反应[8,16],与图3的拉曼表征结果相一致。

表3 富锂锰基正极材料改性前后样品在0.1 C倍率下的首次充放电数据Table 3 Data of initial charge and discharge at a rate of 0.1 C for LLMO samples before and after modification
富锂锰基正极材料改性前后样品的循环稳定性测试如图6所示。由图6可以看出,经过50次循环后,W-0、W-1、W-2、W-3样品的放电比容量分别为244.3、251.9、251.3、258.0 mAh/g,容量保持率分别为92.82%、92.50%、92.12%、95.31%。W-1和W-2样品容量保持率降低的原因是由于改性后材料的比表面积增加,活性物质与电解液之间的副反应加剧,导致材料循环性能下降。而W-3样品在500 ℃烧结后,暴露的晶粒发生融合重构比表面积降低,且表界面的尖晶石相还能够避免富锂锰基材料与电解液直接接触,减少了电解液对材料的侵蚀,因此循环稳定性最佳。

图6 富锂锰基正极材料改性前后样品在0.2 C倍率下的循环性能曲线Fig.6 Cyclic performance of LLMO samples at a rate of 0.2 C before and after modificationConditions:Voltage scan range 2.0—4.6 V;Room temperature;1 C=250 mA/g
在25 ℃条件下,对富锂锰基正极材料改性前后的样品进行了0.1 C到3 C的倍率性能测试,结果如图7所示。由图7可知:随着放电倍率的提升,4种样品放电比容量均逐渐下降,但W-3样品的容量始终高于其他样品。在0.1 C、0.2 C、0.5 C、1.0 C、2.0 C和3.0 C倍率下,W-0样品的放电比容量分别为256.5、250.0、237.5、225.5、210.5和190.7 mAh/g,W-3样品的放电比容量分别为277.0、268.3、258.8、249.6、232.5和216.2 mAh/g。W-3样品在3 C下的放电比容量为在0.1 C下的78.1%,而W-0样品仅为74.3%,这可能是由于表界面尖晶石相的形成稳定了富锂锰基材料的层状结构,且尖晶石特殊的三维扩散路径有利于锂离子的传输[23]。综合材料的各项电化学性能结果,W-3样品的电化学性能最优。

图7 富锂锰基正极材料改性前后样品的倍率性能曲线Fig.7 Rate performance of LLMO samples before and after modificationConditions:Voltage scan range 2.0—4.6 V;Room temperature;1 C=250 mA/g
图8为富锂锰基正极材料改性前后样品前3次的循环伏安曲线。从图8可以看出,4种样品的首次充电过程中均在4.2 V处有峰,对应于LiMO2结构中Ni2+/Ni4+和Co3+/Co4+的氧化反应[24]。4.7 V附近的峰对应于Li2O从Li2MnO3中脱出的氧化峰,且该峰在后续的循环曲线中消失,说明Li2O的脱出仅发生在首次循环过程中[23]。该氧化峰的强度越高说明Li+的脱出速度越快[23],改性后样品在4.7 V处的峰都比W-0样品的氧化峰要强,说明改性后样品Li+脱出速度有所提升。同时仅在图8(d)中出现的2.6 V/2.8 V的氧化还原峰对应了尖晶石相中的Mn3+/Mn4+的氧化还原[20,25](虚线框标注),说明水洗预激活结合二次焙烧改性工艺可以使富锂锰基材料表界面晶型发生转变,从而形成了尖晶石/层状异质界面,这与样品的充放电曲线(见图5)相对应。
为进一步探究水洗/二次焙烧改性工艺对材料界面阻抗改善的作用机理,对4种样品进行了电化学阻抗测试。图9是富锂锰基正极材料改性前后样品的Nyquist图。由图9可以看出,4种样品的阻抗图形状基本相近,均是由两个半圆和一条斜线组成。其中高频区半圆与阻抗实部Z′的截距为隔膜和电解质的欧姆电阻(Re),高频区半圆的直径代表Li+穿过表面SEI膜的阻抗(Rs),中频区为电荷传递阻抗(Rct),斜线则表示Li+扩散时的Warburg阻抗(Zw),图9中的插图为相应的拟合等效电路图。经等效电路拟合后,W-0、W-1、W-2和W-3样品的Rct分别为93.6、85.4、80.4和54.3 Ω。阻抗下降的主要原因是去除了材料表面绝缘的Li2CO3,水洗过程中将大部分Li2CO3去除,有利于阻抗降低。此外W-3样品表界面的尖晶石相所具有的三维扩散通道使得该样品的阻抗显著降低,这也使得W-3样品具有最优异的电化学性能。

Z′—Resistance;-Z″—Reactance;Re—Ohmic impedance;Rs—Impedance of Li+ passing through the surface SEI film;Rct—Charge transfer impedance;Zw—Warburg impedance;CPEs—The electric double layer capacitance of the auxiliary electrode;CPEct—The electric double layer capacitance of the working electrode图9 富锂锰基正极材料改性前后样品的EIS谱图和拟合等效电路图Fig.9 Electrochemical impedance spectra (EIS)and fitted equivalent circuit diagram of LLMO samples before and after modificationCondition:The test frequency range 0.01—100000 Hz;Amplitude 5 mV
3 结 论
系统研究了水洗/二次焙烧改性工艺对富锂锰基正极材料理化性能的影响,当二次焙烧温度为500 ℃ 时,改性后的富锂锰基材料表界面形成了尖晶石/层状异质界面,该界面对材料物化性能和电化学性能的影响如下:
(1)水洗/二次焙烧改性工艺的作用范围为富锂锰基正极材料的表界面,不会改变富锂锰基正极材料的主体晶体结构及形貌;
(2)改性工艺能够有效降低富锂锰基材料的表面残碱含量,Li2CO3质量分数降低了75%以上,总残Li质量分数下降79%左右;
(3)XPS表征结果表明,W-0、W-1、W-2、W-3样品的Ni3+含量逐渐升高,间接说明改性工艺在富锂锰基正极材料表界面构造了氧空位;
(4)改性后样品的电化学性能得到较大提升,其中W-3样品的放电比容量达到286.6 mAh/g,首次库伦效率为91.89%,50次循环容量保持率为95.31%,3.0 C 倍率下的放电比容量为216.2 mAh/g;
(5)表界面尖晶石相独特的三维扩散通道使得W-3样品的阻抗降低到54.3 Ω。
水洗/二次焙烧改性工艺操作简单,成本低,能较大地提高富锂锰基材料的首次库伦效率和循环性能,未来需要重点攻克富锂锰基正极材料严重的电压衰减等难题。
