柴油加氢脱硫绝热反应动力学模型
2021-12-22陈文斌孙新格江洪波鞠雪艳李明丰
陈文斌,孙新格,江洪波,秦 康,鞠雪艳,李明丰,聂 红,韦 业
(1.中国石化 石油化工科学研究院,北京 100083;2.华东理工大学 石油加工研究所,上海 200237)
近些年来,中国油品质量升级步伐加快,柴油质量标准快速从国Ⅳ标准迈进了国Ⅵ标准。国Ⅵ柴油质量标准要求柴油产品中硫质量分数小于10 mg/kg,且多环芳烃质量分数要小于7%[1]。硫和多环芳烃指标的同步降低导致催化剂失活速率加快并且运转周期明显缩短,严重影响工业柴油加氢装置长周期的运转[2]。为了应对运转周期缩短的难题,需要开发更高活性和稳定性的催化剂或催化剂级配技术。柴油加氢反应体系复杂,主要包括硫化物、氮化物的脱除和芳烃的饱和等[3]。在反应过程中伴随着大量的放热,反应温升常常高达40~60 ℃[4],在整个反应过程中催化剂的反应环境将持续发生变化。因此,有必要深入研究绝热反应过程中柴油物流性质沿反应器轴向的变化规律,为高性能柴油加氢催化剂或级配技术的开发获取“卡脖子”的基础数据。现有柴油加氢反应动力学研究一般基于等温反应条件,与工业柴油加氢反应的绝热环境相距较远。笔者以NiMo型催化剂为基础,以柴油原料为考察对象,考虑柴油加氢脱硫反应过程的放热和温升,对柴油加氢脱硫反应动力学进行研究,建立了绝热型加氢脱硫反应动力学模型,揭示物流性质沿反应器轴向的变化规律。
1 实验部分
1.1 原料和试剂
柴油原料为含有20%(质量分数)二次加工柴油的直馏柴油,来自中国石化青岛炼化公司柴油加氢装置,主要性质如表1所示。工业NiMo型催化剂为中国石化催化剂分公司生产的工业剂,比表面积为146 m2/g,孔体积为0.28 cm3/g。

表1 柴油原料的主要性质Table 1 Main properties of diesel feedstock
1.2 反应动力学实验
以工业NiMo型催化剂为研究对象,在柴油加氢脱硫高通量系统上进行反应动力学参数测定实验。反应装置流程图参考笔者前期已发表的文献[5]。反应器中装入颗粒大小为40~60目的氧化态NiMo型催化剂。在进行柴油加氢反应之前,采用含有质量分数为2%的二硫化碳的煤油为硫化油将催化剂进行硫化,硫化条件为:硫化压力6.4 MPa,温度320 ℃,空速2.0 h-1,氢/油体积比300,硫化时间24 h。在硫化完毕后将催化剂进行反应初活性稳定,然后再通入柴油原料,分别考察压力(4.4~6.4 MPa)、温度(300~360 ℃)、氢/油体积比(200~800)、空速(0.75~3 h-1)的变化对产品性质的影响,每个反应条件稳定3 d。参见笔者前期工作文献[6],采用赛默飞世尔科技公司生产的型号为TN/TS3000的硫氮分析仪对加氢脱硫产品中的硫、氮含量进行分析,采用近红外方法对加氢脱硫产品中的芳烃组成进行测定,采用色谱-质谱联用仪对加氢脱硫产品中的硫化物进行分析。
1.3 反应动力学模型建立方法
1.3.1 柴油加氢脱氮反应动力学模型
首先根据以下假设建立等温型动力学模型:(1)反应器为平推流反应器,忽略反应过程中柴油的气化;(2)实验在等温、等压、稳态下进行,反应过程中催化剂不发生失活;(3)在加氢反应条件下,芳烃加氢反应的每个集总可以发生可逆反应;(4)单环芳烃向非芳烃的转化主要发生在液相;(5)忽略内扩散的影响;(6)使用Langmuir-Hinshelwood-Hougen-Watson(LHHW)方程处理氮化物、芳烃的竞争吸附,相同环数芳烃的吸附常数相同。
将柴油中的氮化物划分为2个集总(N1和N2),在考虑温度、压力、氢/油体积比、空时、空塔线速度等加氢反应的条件下,建立二集总加氢脱氮动力学模型。加氢脱氮反应动力学模型方程如式(1)和式(2)所示。
(1)
(2)
其中:
ηNed=tanh(parpNv)
(3)
式(1)~式(3)中:wN1和wN2分别为氮化物2个集总(N1、N2)中氮的质量分数,mg/kg;kNi为氮化物集总i(i=1、2)的反应速率常数(min-1·(mg/kg)-nNi);nNi为氮化物集总i(i=1、2)的反应级数;rp为反应压力和基准压力(6.4 MPa)的比值;αNi为氮化物集总i(i=1、2)的压力影响因子;rH/O为氢/油体积比和基准氢/油体积比(300)的比值;βN为氢/油体积比影响因子;ηNed为外扩散影响因子。fNi为氮化物集总i(i=1、2)的吸附常数;v为空塔线速度,m/min;parpN为氮化物的相关系数。详细模型建立过程可参见笔者前期工作文献[5]。
由于芳烃加氢饱和是逐环加氢并且可逆,因此依据所含芳环的个数将柴油中的芳烃化合物分成4个集总(单环芳烃、双环芳烃、三环芳烃、非芳烃类),提出如图1所示的芳烃加氢饱和路径。
1.3.2 柴油加氢脱芳烃反应动力学模型
芳烃加氢饱和反应动力学公式如式(4)~式(7)所示。

(4)
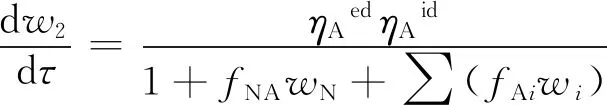
(5)
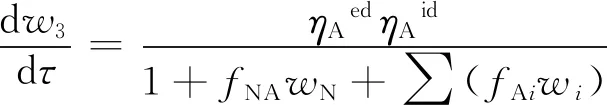
(6)

(7)
其中:
ηAed=tanh(parpA*v)
(8)
ηNed=tanh(parpNv)
(9)
1+fNAwN+∑(fAiwi)=1+fNwN+fA1w1+fA2w2+fA3w3
(10)
(11)
式(4)~式(11)中:w1为单环芳烃集总的质量分数,%;w2为双环芳烃集总的质量分数,%;w3为三环以上芳烃集总的质量分数,%;w4为非芳烃集总的质量分数,%;kij为集总i(i=1、2、3、4)到集总j(j=1、2、3、4)的反应速率常数,h-1;pH2为氢气压力,MPa;rH/O为氢气和柴油的体积比;fA1为单环芳烃集总的吸附平衡常数;fA2为双环芳烃集总的吸附平衡常数;fA3为三环及以上芳烃集总的吸附平衡常数;τ为空时,h;αA1、αA2、αA3分别为等温型芳烃加氢动力学模型中氢气压力对单环芳烃集总、双环芳烃集总和三环及以上芳烃集总的影响因子;βA为等温型芳烃加氢动力学模型中氢/油体积比的影响因子;ηNed为等温型加氢脱氮动力学模型中的外扩散影响因子;ηNid为等温型加氢脱氮动力学模型中的内扩散影响因子;ηAed为等温型芳烃加氢动力学模型中的外扩散影响因子;ηAid为等温型芳烃加氢动力学模型中的内扩散影响因子;parpA为芳烃的相关系数;fAi为芳烃各集总的吸附常数;fA0,i为指前因子,h-1;ΔHads,i为用来度量温度对fAi的影响;fNA为等温型芳烃加氢动力学模型中氮化物的吸附平衡常数;wN为氮化物的质量分数,%;芳烃饱和动力学模型具体见文献[7]。

kij is reaction rate constant from lump i to lump j (i,j=1-4).图1 芳烃加氢饱和反应网络Fig.1 Reaction network of aromatics hydrogenation saturation
1.3.3 柴油加氢脱硫反应动力学模型
对于硫化物,按照加氢脱除的难度分为3个集总。其中,第一集总(S1)包括容易加氢脱除的硫化物,具体包括噻吩、苯并噻吩类硫化物;第二集总(S2)包括较难加氢脱除的硫化物,具体包括二苯并噻吩、1个碳取代的二苯并噻吩;第三集总(S3)包括最难加氢脱除的硫化物,具体包括2个及2个以上的碳取代的二苯并噻吩。在考虑温度、压力、氢/油体积比、空时、空塔线速度和H2S抑制加氢反应的条件下,建立了如式(12)~式(14)的加氢脱硫反应动力学模型。

(12)

(13)

(14)
其中,
ηS=tanh(parpSiv)
(15)
CH2S=wS0-wS1-wS2-wS3
(16)
(17)
式(12)~式(17)中:wH2S为转化为硫化氢的硫的质量分数,mg/kg;wN为氮化物的质量分数,mg/kg;EaS1、EaS2、EaS3分别为硫化物第一集总、第二集总、第三集总的反应活化能,kJ/mol;fAij为加氢脱硫模型中的芳烃的吸附平衡常数;fH2S为加氢脱硫模型中的H2S的吸附平衡常数;fNS为加氢脱硫模型中的氮化物的吸附平衡常数;rH/O为氢气和柴油的体积比;k0,S1、k0,S2、k0,S3分别为硫化物第一集总、第二集总、第三集总的反应指前因子;nS1、nS2、nS3分别为加氢脱硫模型中所述第一集总、所述第二集总、所述第三集总的反应级数;parpSi为硫化物的相关系数;pH2为氢气压力,MPa;R为气体普适常数;wS0为反应前硫的总质量分数,mg/kg;wS1、wS2、wS3分别为第一集总、第二集总、第三集总硫的质量分数,mg/kg;T为反应温度,℃;ν为空塔线速度,m/min;αSi为加氢脱硫模型中的氢气压力的影响因子;βSi为加氢脱硫模型中氢/油体积比的影响因子;ηS为加氢脱硫模型中的外扩散影响因子;τ为空时,h。
动力学微分方程组用龙格库塔法求解,采用鲍威尔优化算法求解获得加氢脱氮、加氢脱芳、加氢脱硫反应动力学参数[8]。以下优化目标函数是各产品质量百分比的实验数据与计算值之间的相对偏差之和。
(18)
式(18)中:a=1~n表示有n组实验数据;b=1~m表示有m个集总分量;Q为目标函数;xa,b,exp为实验数据,mg/kg;xa,b,cal为计算值,mg/kg;
以上述反应动力学模型为基础,通过对柴油加氢反应过程中反应热的估算建立了绝热反应动力学模型。具体来说,综合考虑反应过程中的质量衡算和热量衡算,然后和已建立的加氢脱硫、加氢脱氮、加氢脱芳烃等温反应动力学模型联立,从而求解出绝热反应器中的柴油加氢精制反应结果和温度变化。由于芳烃含量要远远高于硫、氮化合物的含量,热效应主要体现在芳烃加氢反应中,因此提出了如式(19)所示的绝热反应模型。

(19)
其中:
(20)
(21)
(22)
式(19)~式(22)中:ΔH1、ΔH2、ΔH3分别为单环、双环、三环芳烃反应热,kJ/mol;xA1、xA2、xA3分别为单环、双环、三环芳烃的摩尔分数,mol/mol;Cp.oil为柴油比热,kJ/(mol·℃);Cp.H2为氢气比热,kJ/(mol·℃);MA1、MA2、MA3、MOil分别为单环、双环、三环芳烃和柴油的平均相对分子质量,g/mol。
因无法确定集总中的具体物质,故取几个典型的物质来估算每个集总的反应热[9-10]。通过HSC chemistry软件来进行估算。芳烃各集总的反应热和柴油的比热按式(23)~式(26)计算[11-12]。
单环加氢反应热:
ΔH1=3×10-5T2-0.0722T-196.93
(23)
双环加氢反应热:
ΔH2=3×10-5T2-0.0282T-122.11
(24)
三环加氢反应热:
ΔH3=1×10-4T2-0.0744T-137.73
(25)
柴油比热估算:
Cp=4.18×10-3T+1.82
(26)
2 结果与讨论
在柴油加氢反应过程中,硫化物的脱除反应受到原料中氮化物、芳烃以及产物硫化氢、氨的抑制[13-14]。其中,氨的影响相对较小[15],在建模过程中忽略其影响。首先建立加氢脱氮和加氢脱芳烃模型,然后在加氢脱硫反应动力学模型中引入氮化物、芳烃和H2S的抑制作用。具体的加氢脱氮和加氢脱芳烃模型信息参考文献[5-6],笔者着重讨论加氢脱硫动力学模型。
2.1 等温型加氢脱硫三集总模型
图2显示了3个集总硫化物含量分别随空时的变化趋势。由图2可以看出:3个集总的硫化物含量各有不同,且三者的变化趋势不同。S1集总的硫化物含量最多,反应速率相对较快;S3集总的硫化物脱除难度最大。
等温型加氢脱硫反应动力学参数列于表2。由表2可以看出,加氢脱硫S3集总的反应活化能最大,表明S3集总的加氢脱硫反应难度更大,其反应速率受温度影响更大。另外,3个集总的反应级数由大到小的顺序为nS1、nS2、nS3,且nS2和nS3均小于1。3个集总受氢分压的影响因子由高到低的顺序为αS1、αS2、αS3。表明S1集总受压力影响更为明显,这是由于S1集总反应分子相对较小,容易与活性中心接触。同样,S1集总受氢/油体积比的影响更大(βS1>βS2≈βS3)。外扩散相关影响系数由大到小的顺序为parpS3、parpS2、parpS1,表明S3集总受外扩散的影响更大,这表明了不同硫化物集总受外扩散的影响不同,可能与硫化物分子的结构有关。

S1—Sulfur lump 1;S2—Sulfur lump 2;S3—Sulfur lump 3图2 加氢脱硫反应动力学模型3个集总中硫化物含量随空时的变化曲线Fig.2 Variation curves of the sulfides content with space time in the three-lump kinetic model for hydrodesulfurization reaction

表2 加氢脱硫反应动力学参数Table 1 Kinetic parameters of hydrodesulfurization reaction
在反应温度340 ℃、压力6.4 MPa、氢/油体积比300、空塔线速度0.0039 m/min的条件下,加氢脱硫反应速率常数计算值和实际值的拟合结果见图3。由图3可以看出,加氢脱硫反应速率常数的实验值与计算值吻合程度较高,表明加氢脱硫反应模型的参数设计比较合理。

S1—Sulfur lump 1;S2—Sulfur lump 2;S3—Sulfur lump 3图3 NiMo催化剂加氢脱硫动力学模型的试验值和计算值的拟合结果Fig.3 Fitting results of test and calculated values of the kinetics model for hydrodesulfurization of NiMo catalystConditions:p=6.4 MPa;T=340 ℃;VH2/VOil=300
2.2 绝热型加氢脱硫三集总模型
在建立绝热反应动力学模型的基础上,进行了绝热反应模拟计算,计算采用的反应条件为:初始反应温度320 ℃,压力6.4 MPa,氢/油体积比300,空时1.5 h,平均相对分子质量MA1、MA2、MA3、MOil计算时统一取220 g/mol。硫含量与氮含量与NiMo催化剂床层温度和液体空时的关系见图4。由图4可以看出,床层的温升大概为50 ℃左右。在反应温度升高到360 ℃之前,随空时变化温升基本呈线性增加趋势。当反应温度继续升高时,温升增加速率逐渐变小且趋于平缓,这是由于芳烃加氢进入了热力学平衡限制区域,芳烃加氢反应逐渐变缓。硫化物各集总的变化趋势明显与等温条件的变化趋势不同。与等温条件相比,在绝热条件下硫化物含量的变化趋势相对平缓。

S1,S2,S3—Sulfur lumps;N—Nitride lump图4 硫、氮集总中硫含量与氮含量与NiMo催化剂床层温度和液时空速的关系Fig.4 Relationship between the content of sulfur and nitride in sulfur and nitrogen lumps and the bed temperature and liquid hourly space velocity (LHSV)of NiMo catalystConditions:p=6.4 MPa;T=340 ℃;VH2/VOil=300
2.3 物流性质沿轴向变化的对比
根据动力学模型,计算了等温和绝热反应条件下产品硫含量沿反应器轴向的变化规律,保持出口硫含量相同(质量分数为5 mg/kg),在压力6.4 MPa、液时空速1.5 h-1、氢/油体积比300时,拟等温条件的温度348.5 ℃、绝热条件的温度为311.5~363.5 ℃。沿反应器轴向物流总硫、氮、芳烃含量的变化见图5。由图5(a)可知:等温条件的硫含量沿反应器轴向降低趋势明显快于拟绝热条件。在反应初始阶段,等温体系的温度明显高于绝热体系,因此脱硫速率明显较快。在等温条件下,在催化剂20%体积位置(从上到下)时硫质量分数可以降低到1000 mg/kg;而绝热反应条件下在催化剂40%体积位置时,物流中硫才能降低到相同含量。等温和绝热条件下氮含量和芳烃含量的变化规律也均不相同。
沿反应器轴向物流总氮含量的变化见图5(b)。从图5(b)可以看出,绝热条件下氮含量在物流中降低速率小于等温条件,催化剂装填量分别为30%和50%时可以将大部分氮化物脱除。对于芳烃饱和反应(见图5(c)),在等温条件时,总芳烃的质量分数逐步降低;而在拟绝热条件下芳烃反应速率呈现出由慢到快、然后再变缓慢的规律。这是由于反应初期的反应温度较低,而在反应器中部氮化物基本被脱除导致脱芳速率增加;而到反应器后部的反应温度较高,芳烃反应受到热力学平衡的限制。

图5 沿反应器轴向物流总硫、氮、芳烃含量的变化规律Fig.5 Axial variation law of total sulfur,nitride and aromatics content in feedstock along the reactor(a)Total sulfur;(b)Total nitride;(c)Total aromatic hydrocarbon contentConditions:p=6.4 MPa;VH2/VOil=300;T=348.5 ℃ (Isothermal);T=311.5—363.5 ℃(Adiabatic)
根据绝热反应动力学模型,模拟计算了在NiMo催化剂作用下沿反应器轴向反应物流中硫、氮和芳烃含量的变化趋势,如图6所示。从图6可以看出,入口反应温度变化时反应物流中硫、氮和芳烃含量的变化趋势均不相同。

图6 在不同入口反应温度下沿反应器轴向硫、氮和多环芳烃含量的变化规律Fig.6 Axial variation law of total sulfur,nitride and polyaromatics content along the reactor at different inlet reaction temperatures(a)Total sulfur;(b)Total nitride;(c)Total polyaromaticsConditions:p=6.4 MPa;VH2/VOil=300
图7显示了不同集总硫、氮和芳烃含量沿反应器轴向的变化趋势(入口反应温度为311.5 ℃)。从图7可以看出,易脱除和较难脱除硫化物在反应器70%位置基本可以脱除;易反应氮化物基本可以在60%反应器位置脱除完毕;三环芳烃和双环芳烃呈单调脱除趋势并呈现出先快后慢的规律,而单环芳烃呈现出先增加再缓慢递减的规律,到反应器80%之后,其浓度基本不发生变化,此时温度已达360 ℃左右,进入了反应热力学平衡区,芳烃浓度降低变得困难。
3 结 论
(1)研究了NiMo型催化剂在柴油加氢脱硫过程中的反应动力学规律,在考虑硫化氢、氮化物和芳烃抑制因素的基础上建立了等温三集总加氢脱硫反应动力学模型,获得了各项反应动力学参数,模型计算值与实验值吻合较好。
(2)根据反应动力学模型对反应过程中的放热和温升进行了估算,建立了绝热型反应动力学模型。根据动力学模型计算了柴油加氢过程中沿反应器轴向反应物流性质的变化规律。结果显示,在反应器出口硫含量保持相同的情况时,绝热反应条件下物流性质的变化规律与等温条件明显不同。受反应温度逐渐升高的影响,绝热反应条件中反应器前阶段硫化物和氮化物脱除速率相对较慢,芳烃反应速率呈现出先由慢到快后缓慢增加的特征。
(3)通过动力学模型定量计算了绝热反应条件各集总物流中硫化物、氮化物和芳烃含量沿反应器轴向的变化规律,为适应绝热反应环境的催化剂和催化剂级配体系研究提供了基础数据。
