酸化、低氧对大黄鱼非特异性免疫及抗氧化能力的影响
2021-12-22王翠华彭士明马凌波
曾 姣,陈 润,王翠华,彭士明,王 倩,郑 亮,马凌波
(1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院东海水产研究所,上海 200090)
大黄鱼(Larimichthys crocea)是中国东海区域的主要经济鱼类[1],其产量在海水养殖鱼类中占据第三的位置,且近年来呈现增长的趋势[2]。而大黄鱼对水环境溶氧要求较高[3],近年来随着工业的发展,海洋吸收大气中的CO2导致海水pH下降[4],东海地区也频繁出现低氧现象[5]。研究表明,海水中CO2的增加将导致溶解氧的降低,因此海洋生物或将面临酸化-低氧的双重胁迫,这将给海水养殖行业带来巨大的影响[6]。在低氧胁迫下,海洋生物通过抗氧化酶活性变化[7]、代谢底物改变[8],从而保护机体不受损伤,尽管如此,生物组织仍会受到一定程度的损伤,进而机能出现紊乱[9],甚至导致鱼死亡[10]。酸化会影响海洋生物的钙化率[11]、呼吸代谢[12],影响其躲避敌害[13-14]和洄游等行为[15]。在酸化-低氧双重胁迫下,海洋生物新陈代谢减缓[16]、生理生长性能[17-18]和免疫功能[19]降低,这不仅导致海洋生物变得更容易被捕食[20],甚至出现大规模死亡的现象[21]。近期关于酸化与低氧的研究,主要集中于其对海洋生物钙化率[22]、抗病能力[23]、生长率[24]、存活率[25]以及基因表达水平[26]、抗氧化酶活力与非特异性免疫相关酶[19]活力变化的影响,研究对象均以钙质生物为主。
鱼类的特异性免疫相对哺乳动物较低级,而鱼类的非特异性免疫在机体免疫中占主要地位[27]。鱼类的抗氧化系统为鱼类先天免疫的第一道防线,SOD和CAT是抗氧化系统中清除多余活性自由基ROS的主要抗氧化酶,而MDA含量的变化可以有效地表明鱼体受氧化损伤的程度[28]。LZM活力作为体液免疫因子,在一定程度上可以反映鱼类非特异性免疫能力的强弱[29]。本研究以大黄鱼为研究对象,对酸化-低氧给大黄鱼的非特异性免疫以及抗氧化能力带来的影响进行探讨分析,以期为减少酸化-低氧对大黄鱼的胁迫提供依据。
1 材料与方法
1.1 实验材料
实验所用大黄鱼幼鱼由东海水产研究所福建福鼎研究基地提供,挑选800尾健康无伤大黄鱼,体长(19.5±1.1)cm,体质量(75.6±4.9)g,十月龄,不分雌雄,在一直径4 m的室内水泥池中预养2周。在此期间每天更换池子中一半的海水,每天早上7点喂食直至实验开始的前两天,所投喂饲料为市售配合饲料。
1.2 实验方案
1.2.1 实验设计
CALDEIRA等[30]根据政府间气候变化专门委员会(IPCC)发表的评估报告,预测到2100年海水pH值将会下降0.3~0.5,2300年pH值将下降0.8~1.4。已知健康大黄鱼幼鱼的溶解氧(DO)窒息点为2.58~2.83 mg·L-1[31-33],根据已知估算数据,并通过预实验确定方案可行性后,实验设置4个处理组:对照组(pH 8.1,DO 7.0 mg·L-1)、低氧组(pH 8.1,DO 3.5 mg·L-1)、酸化组(pH 7.35,DO 7.0 mg·L-1)及酸化-低氧组(pH 7.35,DO 3.5 mg·L-1),每个处理组设置3个平行。
实验在12个装有1500 L过滤曝气海水的玻璃钢圆桶(直径1.5 m)中进行,实验各组通过充入氮气来调节溶解氧水平,通过充入CO2来调节pH水平,用YSI Pro10万能水质检测仪(美国)以及YSI Prosolo溶氧仪(美国)每5 min测定pH以及溶解氧(DO),待池内pH以及DO稳定下来后,将50条健康无伤的试验鱼同时放入每个玻璃钢圆桶中,等大黄鱼适应10 min后开始计时。实验分为急性胁迫和慢性胁迫两个阶段,急性胁迫取样时间分别为0、3、6、12、24、48、96 h,慢性胁迫取样时间分别为7、15、30 d。
1.2.2 样品收集与处理
采血前24 h对大黄鱼进行空腹处理,从每个试验组随机取大黄鱼6尾,用1%的丁香酚对试验鱼进行麻醉。使用一次性无菌注射器(2 mL)进行尾静脉采血制作血清用于实验。采血时针头使用抗凝剂(1%肝素钠)润洗,并将全血分装在2 mL的离心管,置于冰盒中。采血完成后及时在4℃下,3000 r·min-1离心15 min,吸取离心后的上清液血清于新的1.5 mL离心管中,用Parafilm封口膜封口,放入-80℃冰箱保存用于待测。
采血后在灭菌操作台上快速解剖取出大黄鱼的肝脏,并用预冷的生理盐水清洗3次,吸干水分后取1 g以上的肝脏放入1.5 mL离心管中,液氮速冻后转移至180℃高温灭菌的预冷研钵中充分研磨,研磨后按重量体积比1∶9(g·mL-1)称取0.1 g组织加入0.9 mL生理盐水后转移至新的1.5 mL离心管中,充分震荡混匀,然后在4℃下,2500 r·min-1离心10 min,取上清液分装后4℃冰箱暂存,用于测定酶活性。
1.2.3 酶活性的测定
各指标测定均采用南京建成生物有限公司所提供的对应酶测定试剂盒[如:丙二醛(MDA)测定试剂盒]进行测定。LZM活力采用比浊法测定(U·mL-1)、蛋白浓度的测定采用考马斯亮蓝法(mgprot·mL-1)、SOD采用黄嘌呤氧化酶法测定(U·mgprot-1)、CAT采用可见光比色法测定(U·mgprot-1)、MDA则用TBA法测定(nmol·mgprot-1)。
1.3 数据处理
实验数据以平均值±标准差(mean±SD)(n=3)采用IBM SPSSStatistics 25.0软件进行oneway ANOVA分析,采用Duncan多重比较法检验,同时采用双因素方差分析方法确定低氧与酸化对大黄鱼非特异性免疫以及抗氧化酶类的交互作用,P<0.05为显著性水平,P<0.01为极显著性水平。
2 结果与分析
2.1 酸化、低氧胁迫对大黄鱼非特异性免疫的影响
酸化及低氧胁迫下大黄鱼血清LZM活力随时间的变化趋势如图1所示,对照组LZM活力在实验期间变化幅度较为平缓;酸化组的LZM活力在3 h时出现升高,然后在6~12 h时降低,从12 h时又开始递增至48 h出现峰值,并显著高于其他时间点(P<0.05);低氧组的LZM活力在3 h时出现增加,在6 h时出现降低后开始递增,至96 h出现峰值并极显著高于其他时间点(P<0.01);酸化-低氧组的LZM活力在3 h时低于初始水平,随后显著高于初始水平(P<0.05),在48 h时达到峰值并极显著高于其他时间点(P<0.01)。在慢性胁迫下,酸化-低氧组、酸化组、低氧组均表现出随着时间的延长恢复至初始水平的趋势。结果表明,酸化组的LZM活力在3、6、24、48 h和7、15、30 d时与对照组存在极显著性差异(P<0.01),96 h时存在显著性差异(P<0.05);低氧组的LZM活力在3、48、96 h和7、30 d时与对照组存在极显著性差异(P<0.01),12 h、15 d时存在显著性差异(P<0.05);酸化-低氧组的LZM活力在6、24、48、96 h和7、15 d时与对照组存在极显著性差异(P<0.01),12 h时存在显著性差异(P<0.05)。
酸化及低氧对大黄鱼血清LZM活力各时期影响的交互作用分析结果见表1。从表1可以看出,仅从单一因子而言,低氧对大黄鱼血清LZM活力在6、24、48 h和15 d时具有极显著性影响(P<0.01),12 h、7 d时存在显著性影响(P<0.05);酸化对大黄鱼血清LZM活力在48、96 h和7、15 d时具有极显著性影响(P<0.01),3 h时存在显著性影响(P<0.05);酸化-低氧的交互作用对大黄鱼血清LZM活力在3、48 h和30 d时表现出了极显著性影响(P<0.01),在7 d时表现出了显著性影响(P<0.05)。

表1 酸化以及低氧对大黄鱼血清LZM活力各时期影响的双因素分析Tab.1 Two-factor analysis of effects of acidification and hypoxia on serum LZM activity of Larimichthys crocea in different periods
2.2 酸化、低氧胁迫对大黄鱼抗氧化能力的影响
酸化及低氧胁迫下大黄鱼肝脏SOD含量随时间变化情况如图2所示。实验期间对照组SOD含量无显著变化;酸化组的SOD含量则在12 h时出现最低值,其余时间点SOD含量与初始值无显著性差异(P>0.05);低氧组的SOD含量一直处于显著高于初始水平状态并在24 h时达到峰值(P<0.05);酸化-低氧组的SOD含量一直处于显著高于初始水平的状态(P<0.05),在30 d达到峰值,并显著高于其他时间点以及其他处理组(P<0.05)。慢性胁迫下,低氧组及酸化组大黄鱼肝脏SOD含量呈现出恢复至初始水平的趋势。结果表明,酸化组的SOD含量在3、12、24、96 h时与对照组存在极显著性差异(P<0.01),15 d时存在显著性差异(P<0.05);低氧组的SOD含量在3、6、12、24、48、96 h及7 d时与对照组存在极显著性差异(P<0.01),在15 d时存在显著性差异(P<0.05);酸化-低氧组的SOD含量在3、6、12、24、48、96 h及7、15、30 d任一胁迫时间点都与对照组存在极显著性差异(P<0.01)。

图2 酸化、低氧对大黄鱼肝脏SOD含量的影响Fig.2 Effect of acidification and hypoxia on liver SOD content of Larimichthys crocea
酸化以及低氧对大黄鱼肝脏SOD含量各时期影响的交互作用分析结果见表2。从表2可以看出,仅从单一因子而言,低氧对大黄鱼肝脏SOD含量在12、96 h及30 d时具有极显著性影响(P<0.01),3 h时存在显著性影响(P<0.05);酸化对大黄鱼肝脏SOD含量在3、6、12、24、48、96 h及7、15、30 d任一胁迫时间点均具有极显著性影响(P<0.01);酸化以及低氧两者的交互作用对大黄鱼肝脏SOD含量在12、24 h及30 d时表现出了极显著性影响(P<0.01)。

表2 酸化以及低氧对大黄鱼肝脏SOD含量各时期影响的双因素分析Tab.2 Two-factor analysis of effects of acidification and hypoxia on liver SOD content of Larimichthys crocea in different periods
酸化及低氧胁迫下大黄鱼肝脏CAT活力随时间变化情况如图3所示。对照组CAT活力实验期间变幅较为平缓;酸化组的CAT活力则整体呈现出先升高后降低再升高的趋势;低氧组的CAT活力则在12 h时突然升高并达到最高峰(P<0.05);酸化-低氧组的CAT活力随着时间的延长呈现先升高后降低而后升高的趋势,在12 h时达到峰值。在慢性胁迫下,酸化-低氧组及低氧组呈现出恢复至初始水平的趋势。结果表明,酸化组的CAT活力在3、6、12、24、48、96 h及7、30 d胁迫时间点与对照组存在极显著性差异(P<0.01),15 d时存在显著性差异(P<0.05);低氧组的CAT活力在12、24、48、96 h及7、30 d胁迫时与对照组存在极显著性差异(P<0.01),15 d时存在显著性差异(P<0.05);酸化-低氧组的CAT活力在3、6、12、24、96 h及7、15、30 d胁迫时与对照组存在极显著性差异(P<0.01)。

图3 酸化、低氧对大黄鱼肝脏CAT活力的影响Fig.3 Effect of acidification and hypoxia on liver CAT activity of Larimichthys crocea
酸化以及低氧对大黄鱼肝脏CAT活力各时期影响的交互作用分析结果见表3。从表3可以看出,仅从单一因子而言,低氧在3、6、12、24、48、96 h及7、30 d时对大黄鱼肝脏CAT活力具有极显著性影响(P<0.01),15 d时存在显著性影响(P<0.05);酸化在12、24、48、96 h及7、30 d时对大黄鱼肝脏CAT活力具有极显著性影响(P<0.01),6 h时存在显著性影响(P<0.05);酸化-低氧的交互作用在6、24、48、96 h及7、30 d时对大黄鱼肝脏CAT活力表现出了极显著性影响(P<0.01)。
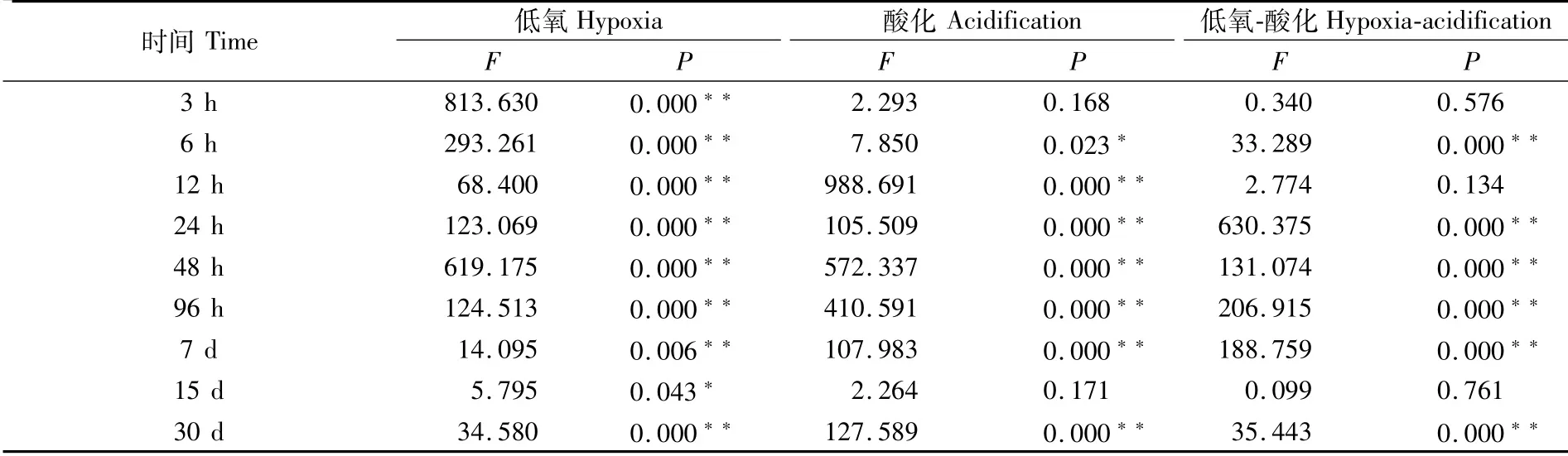
表3 酸化以及低氧对大黄鱼肝脏CAT活力各时期影响的双因素分析Tab.3 Two-factor analysis of effects of acidification and hypoxia on liver CAT activity of Larimichthys crocea in different periods
酸化及低氧胁迫下大黄鱼肝脏MDA含量随时间变化情况如图4所示。对照组MDA含量实验期间变幅较为平缓;酸化组的MDA含量整体呈现先升高后降低的趋势,在24 h时达到峰值,并显著高于其他时间点(P<0.05),而后开始下降并逐渐接近初始水平;低氧组的MDA含量在3 h时出现降低,从7 d开始呈现升高趋势,在第30天达到最高峰,并显著高于其他时间点(P<0.05);酸化-低氧组的MDA含量随着时间的推移在3 h时出现降低,在12 h时达到最高值,并显著高于其他时间点(P<0.05)。慢性胁迫下,酸化-低氧组、酸化组呈现出恢复至初始水平的趋势。结果表明,酸化组的MDA含量在3、6、12、24、48、96 h及15、30 d胁迫时与对照组存在极显著性差异(P<0.01),在7 d胁迫时存在显著性差异(P<0.05);低氧组的MDA含量在3、6、12、24、48、96 h及7、15、30 d任一胁迫时间点都与对照组存在极显著性差异(P<0.01);酸化-低氧组的MDA含量在3、12、24、48、96 h及7、15、30 d胁迫时与对照组存在极显著性差异(P<0.01)。

图4 酸化、低氧对大黄鱼肝脏MDA含量的影响Fig.4 Effect of acidification and hypoxia on liver MDA content of Larimichthys crocea
酸化以及低氧对大黄鱼肝脏MDA含量各时期影响的交互作用分析结果见表4。从表4可以看出,仅从单一因子而言,低氧在3、6、12、24、48、96 h和7、30 d时对大黄鱼肝脏MDA含量具有极显著性影响(P<0.01);酸化在3、6、12、48、96 h和7、15、30 d时对大黄鱼肝脏MDA含量具有极显著性影响(P<0.01),3 h时存在显著性影响(P<0.05);酸化-低氧的交互作用在6、12、24、48、96 h和7、15、30 d时对大黄鱼肝脏MDA含量表现出了极显著性影响(P<0.01)。

表4 酸化以及低氧对大黄鱼肝脏MDA含量各时期影响的双因素分析Tab.4 Two-factor analysis of effects of acidification and hypoxia on liver MDA content of Larimichthys crocea in different periods
3 讨论
3.1 酸化、低氧对大黄鱼非特异性免疫的影响
鱼类的特异性免疫相对哺乳动物较低级,鱼类的非特异性免疫在机体免疫中占主要地位[27]。在非特异性免疫中,LZM活力作为体液免疫因子,是机体防御的第一道防线,是吞噬细胞能否杀死细菌的决定性要素[34]。血清中的LZM活力主要来自吞噬细胞[35]和血细胞[36],受到免疫刺激或接触到抗原性物质将导致其活力上升。测定LZM活力在一定程度上可以反映鱼类非特异性免疫能力的强弱[29]。本文结果显示,酸化及低氧将显著影响大黄鱼血清中的LZM活力(P<0.05)。据研究报道,鱼体LZM活力的最佳pH值为7.5[37],因此酸化组的LZM活力均高于对照组的LZM活力,这与孙汉等[38]在pH7.5以及pH7.8条件下检测的中华绒螯蟹(Eriocheir sinensis)LZM活力结果相似。而低氧组的LZM活力在12 h时低于对照组,但其余时间段均高于对照组,这可能是因为当天水温波动(18.2~20.8℃)使得LZM活力降低[34]。酸化-低氧组中大黄鱼血清LZM活力呈现先降低后升高的趋势,这与酸化及低氧胁迫下贻贝(Mytilus coruscus)的LZM活力先升高后降低的趋势不一致[18],可能是因为大黄鱼的肝脏组织作为主要免疫组织在应对酸化和低氧双重胁迫时产生了比贻贝消化腺更强的免疫反应[39]。在酸化-低氧双重胁迫、酸化胁迫、低氧胁迫下,LZM活力都有恢复至原始水平的趋势,这与王文博[40]的研究结果一致,可能是鱼体产生了一定的耐受性[41],但也有可能是长时间的胁迫环境导致鱼体内生理紊乱,从而使得LZM活力下降[42]。
3.2 酸化、低氧对大黄鱼抗氧化能力的影响
鱼类的抗氧化系统为鱼类先天免疫的第一道防线,SOD和CAT是抗氧化系统中清除多余活性自由基ROS的主要抗氧化酶,而MDA含量的变化可以有效地表明鱼体受氧化损伤的程度[28]。本实验中,低氧组的SOD含量、CAT活力及MDA含量变化趋势与王永红等[43]对大黄鱼进行低氧胁迫的研究结果一致,证明在低氧的慢性胁迫下,大黄鱼幼鱼抗氧化系统未能有效地缓解ROS带来的损伤。而酸化组的SOD含量与对照组并不存在显著性差异,这与酸化条件下草鱼(Ctenopharyngodon idellus)SOD含量变化趋势相似[44],其原因可能是在酸化情况下产生了过多的H+促使更多的活性氧生成,O2-被SOD还原成H2O2导致SOD含量减少[45],由于SOD未能清除完大部分多余的ROS自由基[46],因此CAT活力呈现先升高后降低而后再升高的趋势,这与酸化胁迫下凡纳滨对虾(Litopenaeus vannamei)的CAT活力变化趋势一致[47],随着SOD和CAT对ROS自由基的清除,MDA含量呈现先增加后减少的趋势,证明在慢性胁迫下出现了适应机制,此结果与韩星星等[48]的结果相似。急性胁迫下,酸化-低氧组的SOD含量以及CAT活力均显著高于对照组(P<0.05),该趋势与贻贝在酸化以及低氧胁迫下的实验结果相似[49]。在酸化-低氧双重胁迫下为了消除多余的活性自由基,SOD含量以及CAT活力均大幅增长,而在96 h出现减少的情况可能是因为长期的胁迫导致鱼体内出现了暂时的紊乱,从而导致SOD含量下降,连带CAT活力也受到一定的影响。在此种情况下MDA含量呈现先增加后减少的趋势,这表明在SOD和CAT协同作用下,多余的ROS自由基得到了消除,减少了鱼体的损伤。这可能是鱼类在酸化及低氧环境下的一种自我调节机制,具体仍需进一步研究探讨。
4 小结
本实验评估了不同时间尺度下酸化及低氧两种胁迫对大黄鱼非特异性免疫与抗氧化功能的影响。从检测的免疫和抗氧化指标来看,急性胁迫较慢性胁迫对大黄鱼的非特异免疫、抗氧化反应的影响更为明显,慢性胁迫条件下虽然大黄鱼对免疫、抗氧化指标具有一定的自我调控作用,但仍受到一定影响。由此证明,在酸化-低氧情况下大黄鱼存在一定的自我调节机制,但酸化-低氧不管是单一因子还是交互作用均对大黄鱼的非特异性免疫与抗氧化能力存在一定程度的胁迫影响,其中的内在影响机理尚需进一步研究探讨。本研究结果可为大黄鱼健康养殖和逆境生理功能调节研究提供部分基础数据。
