血清PGs、G- 17、IL- 23 检测与OLGA/ OLGIM胃炎评价标准在胃癌前状态评估中的相关性
2021-12-20于丹凤袁奠波张智
于丹凤,袁奠波,张智
1.东莞广济医院内科,广东东莞 523690;2.东莞三局医院ICU,广东东莞 523000
胃癌为普遍的恶性肿瘤,病死率较高,早期胃癌患者病灶较小,未表现出显著的临床症状,因此在进行初期诊断中,难以有效确诊,从而导致疾病进展,对患者的临床预后亦造成了严重影响。对于胃癌的个体筛查及疾病诊断,主要选择纤维胃、十二指肠镜检查的方法,但是内镜检查作为一种侵入性检查,患者表现出较差的依从性[1]。 无论胃癌筛查人群还是需长期随访监测的高危人群,血清学检查都有助于评估胃癌前病变发生风险,为后续是否需作胃镜精查提供依据[2]。该研究选取在该院2020年3月—2021年6月就诊的消化道病变患者150 例为研究对象,探究血清学指标与OLGA/OLGIM 胃炎评价标准在胃癌前状态评估中的应用,现报道如下。
1 资料与方法
1.1 一般资料
选取该院收治的消化道病变患者150 例为研究对象,根据胃镜检查及病理结果分为胃溃疡组、胃息肉组、萎缩性胃炎组、肠上皮化生组和上皮内瘤变组,每组30 例;根据OLGA 分级和OLGIM 分级系统将患者划分为0~Ⅳ级组, 其中OLGA 分级0 级45 例,Ⅰ级35 例,Ⅱ级31 例,Ⅲ级24 例,Ⅳ级15 例,OLGIM分级0 级54 例,Ⅰ级36 例,Ⅱ级25 例,Ⅲ级21 例,Ⅳ级14 例;选取同期健康体检者30 名为对照组和已确诊的胃癌患者30 例为胃癌组。
纳入标准:①符合《消化性溃疡诊断与治疗规范(2016年,西安)》[3]对胃溃疡诊断标准、符合《慢性胃炎及上皮性肿瘤胃黏膜活检病理诊断共识》[4]对萎缩性胃炎、肠上皮化生、低级别上皮内瘤变的诊断标准;②患者本人及其家属知晓并同意参加该次研究;③检查前3 个月内未服用抗生素、质子泵抑制剂、益生菌等可能影响检测结果的药物。 排除标准:①有严重的心、肝、肾、肠等的病变者,有精神病史、过敏史、处于哺乳期的妇女或孕妇;②两周内使用PPI、制酸剂、护胃剂者;③患有严重的凝血障碍者;④有胃部手术史者。
1.2 方法
受检者空腹抽取静脉血5mL,分离血清,立即检测或置于-80℃保存待测。 以ELISA 法定量检测血清G-17、PGI、PGII、IL-23 水平, 试剂盒均购买于R&D生物技术公司,操作严格按照说明书步骤进行。 于固定位置取5 块活组织(胃窦小弯、胃窦大弯、胃角、胃体小弯、胃体大弯各1 块),4%甲醛固定,石蜡包埋、切片,HE 染色,由病理科医师根据新悉尼系统进行诊断。 萎缩根据严重程度分为轻、中、重度,轻度为固有腺体数减少不超过原有腺体的1/3; 中度为固有腺体数减少介于原有腺体的1/3~2/3 之间;重度为固有腺体数减少超过2/3,仅残留少数腺体,甚至完全消失。综合胃窦和胃体黏膜的萎缩程度和肠化生程度评分结果, 依据慢性胃炎OLGA 分期和OLGIM 分期系统进行分期,以5 处病理活检作为金标准,分别采用4处病理活检(共5 种组合方式)、3 处病理活检(共9种组合方式)、2 处病理活检(共6 种组合方式)依据慢性胃炎分级分期评估系统(perative link on gastritis assessment, OLGA) 和慢性胃炎肠化生分级分期评估系统 (perative link on gastritis intestinal metaplasia,OLGIM)进行分级。
1.3 统计方法
采用SPSS 22.0 统计学软件进行数据分析,计量资料以(±s)表示,采用t 检验;计数资料以[n(%)]表示,采用χ2检验;多组间采用方差分析,组间两两比较采用t 检验;P<0.05 为差异有统计学意义。
2 结果
2.1 不同组间血清PGI、PGs、G-17、IL-23 水平比较
血清PGI、PGII、G-17 和IL-23 水平在对照组、胃癌组、胃溃疡组、胃息肉组、萎缩性胃炎组、肠上皮化生组和上皮内瘤变组患者间的差异有统计学意义(P<0.05), 且胃癌组患者的血清PGI、PGII 和IL-23 水平最高,G-17 水平最低。 见表1。
表1 不同组间血清PGI、PGs、G-17、IL-23 水平比较(±s)

表1 不同组间血清PGI、PGs、G-17、IL-23 水平比较(±s)
组别 PGI(μg/L) PGII(μg/L) G-17(pmol/L) IL-23(pg/mL)对照组(n=30)胃溃疡组(n=30)胃息肉组(n=30)萎缩性胃炎组(n=30)肠上皮化生组(n=30)上皮内瘤变组(n=30)胃癌组(n=30)F 值P 值82.59±18.76 95.74±16.87 97.43±14.58 105.64±22.47 113.26±15.87 124.63±27.64 133.52±26.54 21.180<0.001 7.82±1.15 8.45±1.72 8.96±1.45 9.73±2.38 14.35±4.71 23.48±5.32 30.83±6.39 157.000<0.001 21.32±4.26 15.73±3.48 13.26±2.17 9.32±1.26 7.41±1.05 6.73±1.31 4.11±0.98 186.800<0.001 125.63±34.87 176.42±62.36 195.63±55.62 261.75±46.87 311.47±72.53 423.34±65.24 537.28±84.65 166.800<0.001
2.2 不同OLGA 和OLGIM 分级间血清PGI、PGs、G-17、IL-23 水平比较
不同OLGA 分级患者的PG II、G-17 和IL-23 水平间的差异有统计学意义(P<0.05);不同OLGIM 分级患者的PG II、G-17 和IL-23 水平间的差异有统计学意义(P<0.05)。 见表2、表3。
表2 不同OLGA 分级间的血清PGI、PGs、G-17、IL-23 水平比较(±s)
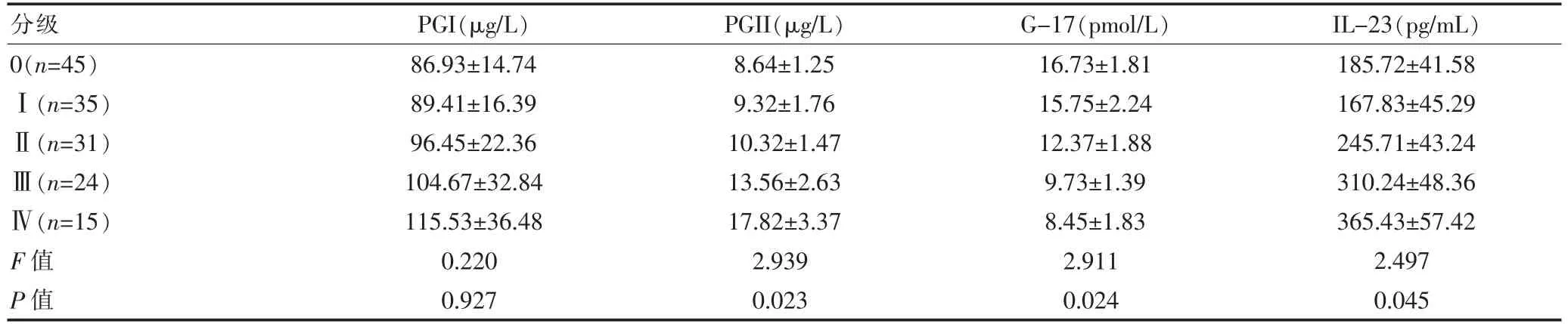
表2 不同OLGA 分级间的血清PGI、PGs、G-17、IL-23 水平比较(±s)
分级 PGI(μg/L) PGII(μg/L) G-17(pmol/L) IL-23(pg/mL)0(n=45)Ⅰ(n=35)Ⅱ(n=31)Ⅲ(n=24)Ⅳ(n=15)F 值P 值86.93±14.74 89.41±16.39 96.45±22.36 104.67±32.84 115.53±36.48 0.220 0.927 8.64±1.25 9.32±1.76 10.32±1.47 13.56±2.63 17.82±3.37 2.939 0.023 16.73±1.81 15.75±2.24 12.37±1.88 9.73±1.39 8.45±1.83 2.911 0.024 185.72±41.58 167.83±45.29 245.71±43.24 310.24±48.36 365.43±57.42 2.497 0.045
表3 不同OLGIM 分级间血清PGI、PGs、G-17、IL-23 水平比较(±s)

表3 不同OLGIM 分级间血清PGI、PGs、G-17、IL-23 水平比较(±s)
分级 PGI(μg/L) PGII(μg/L) G-17(pmol/L) IL-23(pg/mL)0(n=54)Ⅰ(n=36)Ⅱ(n=25)Ⅲ(n=21)Ⅳ(n=14)F 值P 值88.32±29.43 95.47±21.46 98.34±18.53 111.45±26.72 123.81±34.61 0.176 0.950 8.31±1.56 9.43±2.14 11.46±1.82 14.62±2.35 18.54±2.26 3.137 0.017 13.65±0.94 12.34±0.86 10.47±1.15 8.31±0.79 7.38±1.26 5.679<0.001 208.49±48.16 231.86±51.27 319.47±57.65 396.48±41.45 435.17±59.32 2.780 0.029
3 讨论
胃癌是起源于胃黏膜上皮的恶性肿瘤,在我国各种恶性肿瘤中发病率居首位, 其发生是多种致病因素、多步骤进行性发展的慢性过程。因此,监测癌前疾病对胃癌的早期筛查具有重要意义。胃镜是胃癌早期筛查最重要的检查方式, 但由于我国人口基数大、内镜医师数量少的客观原因,限制了胃镜在大规模胃癌筛查中的应用。
血清PG 是由胃黏膜分泌, 主要包括PGI 和PGⅡ,可以间接地反应人体不同部位胃黏膜的功能和形态,从而反映胃黏膜的萎缩程度[5]。 血清G-17 由胃窦G 细胞合成和分泌,对胃黏膜具有营养作用,其可有效激活诸多信号通路,发挥抗侵袭、抗凋亡、抗炎性反应等作用[6]。 血清IL-23 水平升高是胃癌患者预后不良的生物学指标, 可用于评估胃癌的转移与预后,但在胃癌的发展演变过程中所起的作用尚未明确[7-10]。有研究指出,胃癌是从浅表性胃炎起,经萎缩性胃炎、肠上皮化生、上皮内瘤变等癌前病变,最后发展成为胃癌[11],该研究中胃癌组患者PGI(133.52±26.54)μg/L、PGII(30.83±6.39)μg/L 和IL-23(537.28±84.65)pg/mL水平均高于对照组,G-17 水平(4.11±0.98)pmol/L 低于对照组(P<0.05),这与魏华等[12]学者在相关研究中得出,胃癌患者PGI(113.7±38.77)μg/L 高于对照组、G17(5.40±3.46)pmol/L 水平低于对照组,与该文所得结果相近,表示PGI、PGII 和IL-23 水平在胃溃疡、胃息肉组、萎缩性胃炎、肠上皮化生和上皮内瘤变患者中逐渐升高,G-17 水平在胃溃疡、胃息肉组、萎缩性胃炎、 肠上皮化生和上皮内瘤变患者中逐渐降低,提示胃癌前病理状态的进展下的血清学变化,炎症在病理进程中发挥重要的作用。
国际胃炎萎缩工作小组提出的OLGA 和OLGIM胃炎萎缩和肠化生程度与范围相结合,能较好地预测癌变风险,近年已逐步为人们所认知和接受[13-17]。近年提出的OLGA/OLGIM 胃炎评价标准通过对胃炎萎缩/肠化生程度和范围进行综合评估,能起到较好地预测作用,高等级分期(Ⅲ、Ⅳ期)的患者通常意味着更高的胃癌发生风险,需接受内镜和病理随访[18]。 该研究结果显示, 随着OLGA 和OLGIM 分级的增加,PGII和IL-23 水平逐渐升高,G-17 水平逐渐降低,提示在胃癌前病理进程中炎症和胃泌素相关的信号有重要作用。
综上所述,PGII、G-17 和IL-23 水平与胃癌前OLGA/OLGIM 分级相关,在胃癌前病变诊断中有重要的临床意义,PGs、G-17 和IL-23 可用于胃癌前状态评估。
