SASH1表达对胆囊癌细胞增殖、凋亡和转移的作用机制研究*
2021-12-20王欣欣刘丽莉包小娜
吴 博,王欣欣,刘丽莉,包小娜,蔡 宇△
(辽宁健康产业集团阜新矿总医院 1.消化内科;2窥镜中心,阜新 123000)
胆囊癌在胆道系统恶性肿瘤中发病率最高,在全球消化系统常见恶性肿瘤中排名第六,肿瘤流行病学调查显示,2018年新发和死亡胆囊癌患者超过15万[1]。由于胆囊癌早期诊断较难以及复发和转移等重要因素的存在,胆囊癌患者的预后极差[2]。虽然医疗在不断的进步,但是现有的治疗策略仍不能改善胆囊癌的临床疗效,因此揭示其发病分子机制可能有助于鉴定治疗胆囊癌新的治疗靶标。SASH1(scaffold protein sterile α motif-and Src-homology 3-domain containing 1,SAM and SH3 domain-containing 1)基因在正常人体组织中广泛表达,该基因调节细胞的生长、增殖和凋亡,并参与多种疾病的发展[3]。SASH1 被认为是肿瘤抑制基因,在乳腺癌、非小细胞肺癌和胃癌等常见恶性肿瘤中低表达,通过调控细胞增殖、凋亡和侵袭转移等肿瘤生物学过程促进肿瘤的恶性进展[4-6]。SASH1 在多种肿瘤中被研究,并可以作为抗肿瘤治疗的靶点[7],但是SASH1 在胆囊癌中的研究至今未有报道。因此,本研究对SASH1在胆囊癌中的表达及在胆囊癌发生发展中的生物学功能和作用机制进行了探讨,旨在获得SASH1作为胆囊癌抗肿瘤治疗潜在分子靶点的依据。
1 材料与方法
1.1 主要试剂材料
高效蛋白裂解液和吉姆萨染液,购自北京solarbio公司;蛋白上样缓冲液和BCA检测试剂盒,购自上海碧云天试剂有限公司;PVDF膜,购自美国Millipore 公司;SASH1 一抗和鼠二抗、兔二抗,购自美国proteintech公司;ECL化学发光试剂盒,购自美国Thermo公司;胆囊癌细胞GBC-SD、MKN-45、GES-1和人正常胃粘膜上皮细胞系RGM-1,购自美国ATCC 细胞库;细胞培养基、FBS 和胰酶,购自美国Hyclone公司;SASH1 siRNA,购自广州锐博生物生物技术有限公司;MTS 试剂,购自美国Biovision 公司;细胞凋亡检测试剂盒,购自南京凯基生物技术有限公司;Transwell 小室,购自美国coring 公司;4周龄左右的雌性BALB/c裸鼠,购自北京维通利华实验动物技术有限公司。
1.2 样本来源
收集2018 年1 月至2020 年1 月入住辽宁健康产业集团阜新矿总医院行手术治疗的胆囊癌患者31例,要求患者在本次手术前未接受过放化疗等任何形式的抗肿瘤治疗。胆囊癌及大于肿瘤组织5 cm以上的癌旁组织,均由经病理专家证实。手术切除的新鲜组织标本,放置-80 ℃冰箱中储存备用。患者均签署知情同意书,所有操作均由本院伦理委员会审核通过。
1.3 Western blotting检测SASH1蛋白表达
组织加入高效蛋白裂解液,超声裂解细胞。12 000 r/min、4 ℃离心30 min,去除沉淀,获得细胞总蛋白。BCA 蛋白检测试剂盒检测蛋白浓度后加入蛋白上样缓冲液,蛋白加热煮沸进行变性。采用10%的SDS-PAGE 凝胶进行蛋白电泳,湿转进行转膜。将PVDF 膜与蛋白封闭液常温孵育1 h 后分别与目的一抗稀释液(稀释浓度比均为1∶500)4 ℃孵育过夜、二抗稀释液(1∶8 000)室温孵育1 h后,采用ECL试剂盒曝光蛋白条带。
1.4 细胞培养和细胞转染
胆囊癌细胞GBC-SD、SGC996、NOZ 和正常胆管上皮细胞HIBEpiC 从液氮快速复苏后,采用含10%FBS的DMEM培养基培养细胞,放置在37 ℃、5%CO2的全湿度培养箱中。细胞长满时,收集各个细胞进行细胞裂解,获得细胞蛋白裂解液,采用western blotting 检测各个细胞中SASH1 蛋白的表达。并选择SASH1 表达最高的胆囊癌细胞进行6 孔板接种,每孔2×105个细胞,分为NC 组和Overexpression SASH1 组(oe-SASH1 组)。继续培养12 h,弃掉培养基后,更换无血清培养基,NC组细胞加入NC 质粒、siRNA 和lip2000,oe-SASH1 组细胞加入SASH1 过表达质粒和lip2000。转染48 h 后收集细胞蛋白,采用western blotting 检测各组细胞中SASH1的表达,并进行后续实验。
1.5 MTS实验
收集NC 组和oe-SASH1 组细胞进行96 孔板接种,每孔2×103个细胞,以细胞贴壁的时间计为0点,每组设置0 h、24 h、48 h、72 h和96 h时间点,及每个时间点设置6 个复孔,放置培养箱中培养。在相对应的时间点,每孔中加入20 μL MTS试剂,在培养箱中继续孵育2 h。采用酶标仪检测490nm 处各孔的吸光度值(OD值)。
1.6 细胞凋亡实验
NC组和oe-SASH1组细胞PBS洗两次后,采用无EDTA 的胰酶消化收集,PBS 洗两次,每管6×105个细胞,每组设置3个管,每管加入500 μL的凋亡染色缓冲液重悬细胞及5 μL 的Annexin V-FITC 和PI染色液,在常温下避光孵育10 min 后,采用流式细胞仪检测各组细胞凋亡率。
1.7 Transwell实验
收集NC组和oe-SASH1组细胞,无血清培养基洗两次后进行Transwell 小室孔接种,每孔1×105个细胞、100 μL 无血清培养基,细胞接种至Transwell小室膜的上室面,其下室面放于含有血清的细胞培养基中,将细胞放置培养箱中培养12 h。将Transwell 小室取出,其膜的上室面细胞擦除后,下室面的细胞经PBS 清洗、甲醇固定和吉姆萨染色后,在显微镜下观察膜下室面的细胞数目,细胞数越多,表明细胞穿膜数越多,细胞转移能力越强。
1.8 裸鼠体内成瘤实验
收集NC组和oe-SASH1组细胞,PBS洗两次后进行裸鼠接种,每只裸鼠4×106个细胞、100 μL PBS,细胞悬液接种至裸鼠的右侧腋窝下。采用游标卡尺每周对裸鼠成瘤的体积进行测量,接种4 周时处死裸鼠,解剖移植瘤,并对瘤体进行称重。
1.9 统计学方法
采用SPSS 17.0 软件进行数据统计分析,计量资料以均数±标准差()表示,两组比较采用独立样本t检验,多组间比较采用方差分析,两两比较采用DUNNETt检验,P<0.05为差异有统计学意义。
2 结果
2.1 SASH1在胆囊癌组织中的表达水平
SASH1 在胆囊癌组织和癌旁组织中的相对表达量分别为(1.04±0.33)和(1.38±0.59),SASH1在胆囊癌组织中的表达显著低于其在癌旁组织中的表达(t=2.773,P=0.007)。
2.2 SASH1蛋白在胆囊癌细胞系中的表达水平
与正常胆管上皮细胞HIBEpiC相比,SASH1在胆囊癌细胞中的表达均显著降低(F=195.34,P<0.001),其中在GBC-SD 细胞中的表达最低(P<0.05),见图1A。GBC-SD转染SASH1过表达质粒,结果显示,与NC 组相比,oe-SASH1 组中SASH1 相对表达量显著增加(t=8.62,P<0.001),见图1B。

图1 SASH1蛋白在胆囊癌细胞系中的表达水平
2.3 细胞增殖能力的检测
与NC组相比,24 h之后,oe-SASH1组GBC-SD细胞各个时点的OD 值显著降低,增殖能力降低(P<0.05),见表1。
表1 不同时间点NC组和oe-SASH1组GBC-SD细胞的OD值
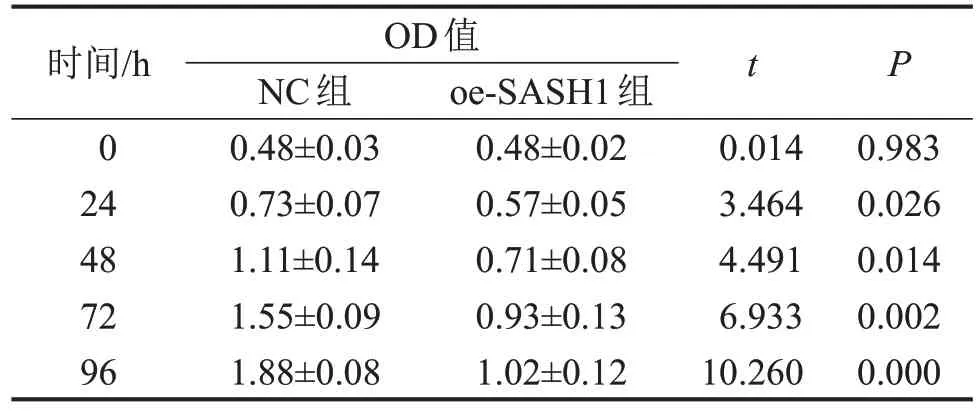
表1 不同时间点NC组和oe-SASH1组GBC-SD细胞的OD值
2.4 细胞凋亡的检测
NC组和oe-SASH1组细胞凋亡率分别为(4.61±0.39)和(14.38±2.16),与NC 组相比,oe-SASH1 组GBC-SD 细胞凋亡率显著增加(t=7.710,P=0.001),见图2。
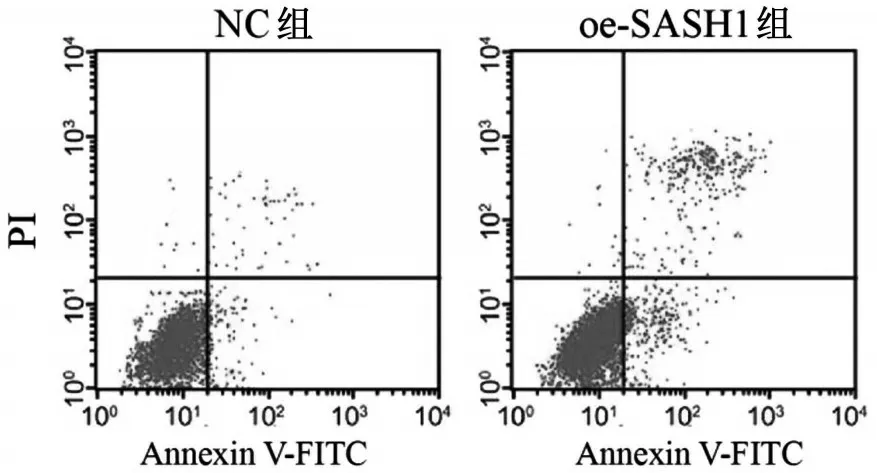
图2 流式细胞实验检测SASH1对胆囊癌细胞凋亡的影响
2.5 细胞转移能力的检测
NC 组和oe-SASH1 组细胞穿膜数分别为(68.67±7.39)和(44.33±4.85),与NC 组相比,oe-SASH1 组GBC-SD 细胞转移能力显著降低(t=4.769,P=0.005),见图3。
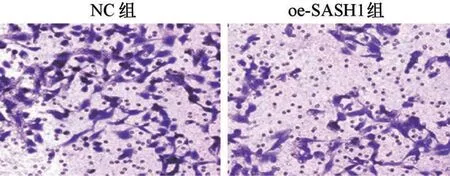
图3 Transwell实验检测SASH1 siRNA对胆囊癌细胞GBCSD转移能力的影响
2.6 细胞凋亡体内成瘤能力的检测
采用裸鼠成瘤检测NC 组和oe-SASH1 组胆囊癌细胞体内生长能力,结果显示,与NC 组相比,oe-SASH1 组GBC-SD 细胞体内成瘤能力显著降低(P<0.001),见图4。
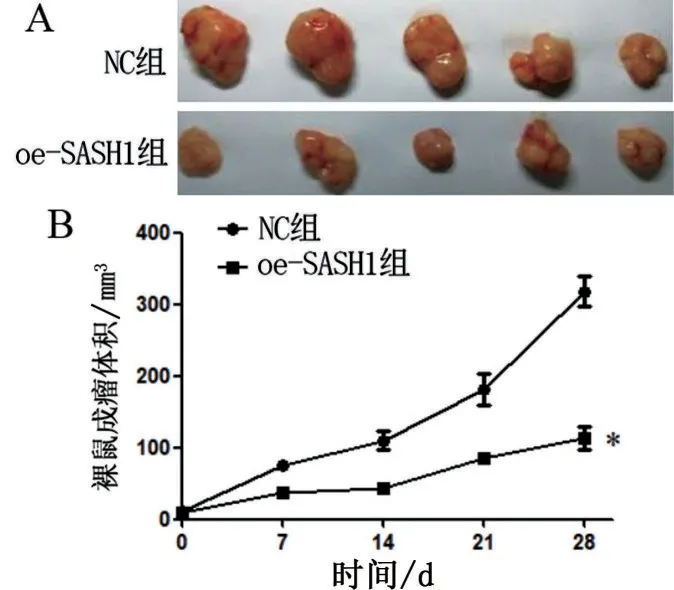
图4 裸鼠成瘤实验检测各组细胞裸鼠成瘤体积
2.7 SASH1 siRNA 对PI3K/AKT 信号通路及其下游基因表达的影响
oe-SASH1 组GBC-SD 细胞中PI3K/AKT 信号通路相关蛋白pPI3K 和pAKT 的表达减少,但是总蛋白PI3K和AKT蛋白的表达无显著变化,见图5和表2。
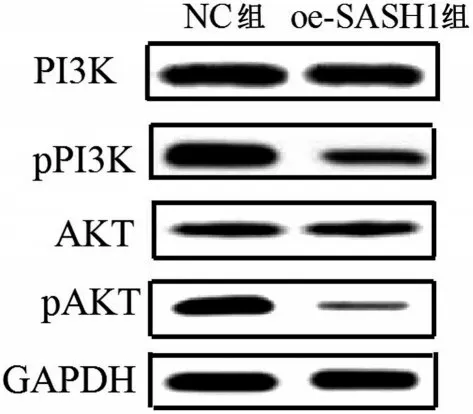
图5 Western blotting 实验检测SASH1 对胆囊癌细胞GBCSD细胞周期蛋白和转移蛋白表达的影响
表2 SASH1的表达对PI3K/AKT信号通路及其下游基因表达的影响
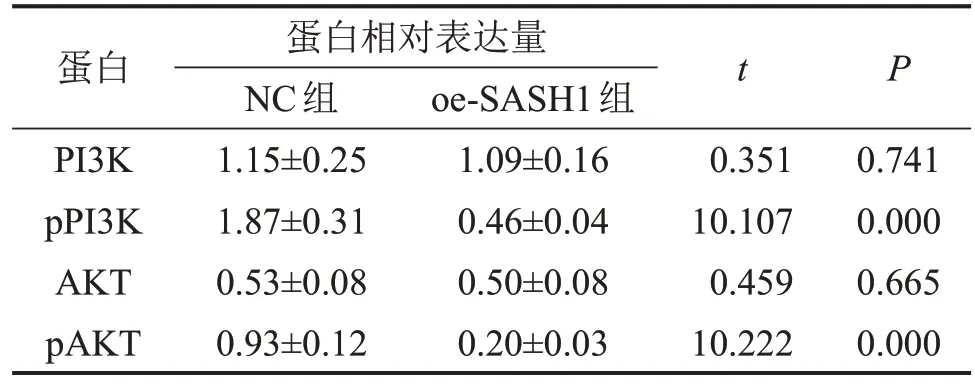
表2 SASH1的表达对PI3K/AKT信号通路及其下游基因表达的影响
3 讨论
胆囊癌是胆道中最具有侵略性和最常见的恶性肿瘤[1]。胆囊癌的唯一且可能的治疗方法是手术切除,但由于隐匿性早期症状和缺乏诊断标志物,在临床诊断出胆囊癌时,癌细胞大部分已入侵邻近器官并通过淋巴结转移,丧失了手术机会。晚期胆囊癌患者对化疗药物反应有限,导致了高死亡率。研究显示,T1 和T2 期的胆囊癌患者5 年生存率分别为85.9%和56.1%,而T3和T4期的胆囊癌患者5年生存率分别下降至19.2%和14.1%[2]。胆固醇代谢和胆结石等被认为是胆囊癌的主要高危因素,但是胆囊癌具体的发生发展机理尚未完全阐明[8]。目前已经确定癌基因和抑癌基因参与恶性肿瘤的发展,这表明基因研究可能为开发延长胆囊癌患者生存期的有效药物提供新的靶点[9]。
SASH1 基因属于信号衔接蛋白SLY 家族的一个成员,定位于细胞核,包含SAM和SH3结构域,具有信号衔接和分子支架的功能,在正常生命活动中发挥重要作用,如SASH1通过一氧化氮信号传导参与调节肺泡上皮细胞成熟过程,以及SASH1在胚胎发育过程中也发挥重要作用[3]。研究显示,SASH1异常表达引起多种肿瘤的恶性进展,是一个新型的肿瘤抑制基因。Zeller等[10]于2003年首次报道在乳腺癌样品中SASH1的表达显著降低。同时,SASH1基因位于染色体6q23-25,该区域为肺癌易感性基因座,SASH1 与肺癌的发生发展密切相关[11],SASH1低表达预示非小细胞肺癌患者预后不良,同时,过表达SASH1可以抑制肿瘤细胞的增殖和对顺铂的敏感性[5]。在胃癌组织中SASH1的表达显著低于其癌旁组织,SASH1 低表达与胃癌患者TNM 分期显著相关,是胃癌患者独立的预后因素[6]。但是SASH1在胆囊癌中的表达情况未知,本研究结果显示,与癌旁组织相比,SASH1 在胆囊癌组织中的表达显著下调,但是本研究胆囊癌组织样本较少,未能分析SASH1 表达水平与胆囊癌临床病理参数的关系,后续还需进一步扩大样本进行研究。
尽管SASH1在胆囊癌组织中表达异常,其发挥的功能及作用机制仍有待阐明。目前研究已经充分显示SASH1 调控肿瘤细胞的增殖、凋亡、侵袭和转移等恶性生物学功能[4-7]。本研究结果显示,SASH1在胆囊癌细胞中的表达显著低于在正常胆管上皮细胞HIBEpiC中的表达,并选择SASH1表达最低的胆囊癌细胞进行转染SASH1 过表达质粒,过表达SASH1 抑制胆囊癌细胞增殖、转移和体内成瘤能力,以及促进细胞的凋亡,表明SASH1 抑制胆囊癌的恶性进展。SASH1 在蛋白激酶B(Akt)中的抑制作用被认为是SASH-1 抗癌作用的潜在分子机制。SASH1 过表达通过降低p-Akt 及其包括cyclin D1,Bcl-2和MMP-2靶基因的表达水平抑制人皮肤鳞状细胞癌细胞的增殖和侵袭能力[12]。Sun 等[13]报道,SASH1可能通过在体内和体外下调PI3K/AKT信号通路抑制肝癌细胞的侵袭和转移能力。在骨肉瘤中SASH1 通过PI3K/AKT 信号通路抑制细胞增殖和迁移能力,促进细胞凋亡[14]。PI3K/AKT在胆囊癌中也处于异常激活状态[15],在胆囊癌细胞系中我们发现SASH1 抑制pPI3K 和pAKT 蛋白的表达,表明SASH1在胆囊癌中同样通过下调PI3K-AKT信号通路发挥抑癌作用。
综上所述,SASH1 在胆囊癌组织中低表达,SASH1可能通过调控PI3K/AKT信号通路抑制胆囊癌细胞的增殖和转移,促进细胞的凋亡。SASH1可能是胆囊癌抗治疗的潜在分子靶点。
