超声引导下射频消融术治疗甲状腺乳头状癌的安全性和远期随访结果分析
2021-12-19暴小耀
暴小耀
(平顶山市中医医院 外科,河南 平顶山 467099)
甲状腺癌是临床常见的恶性肿瘤之一,根据其组织学特征可分为甲状腺乳头状癌、未分化癌、滤泡状癌和髓样癌,其中以甲状腺乳头状癌发病率最高[1-2]。手术是有效治疗甲状腺癌的主要方法,但患者术后容易出现癌细胞转移情况。超声引导下射频消融术是近年来兴起的一种新型甲状腺癌治疗方式,其具有微创、美观、并发症少、恢复快等优势[3-4]。为明确在甲状腺乳头状癌治疗中超声引导下射频消融术的应用价值,本文对80例甲状腺乳头状癌患者展开探讨,现报道如下。
1 资料与方法
1.1 一般资料
选取2015 年8 月至2018 年8 月平顶山市中医医院外科收治的80 例甲状腺乳头状癌患者,按照随机摸球法分为对照组和实验组,每组40 例。纳入标准:①具有射频消融治疗指征[3]:a.消融前甲状腺功能正常;b.微小乳头状癌患者超声检查显示甲状腺结节呈单发,直径≤1 cm,包膜未有侵犯表现,并包膜与结节间距>2 mm,超声提示颈侧无可疑淋巴结转移;②消融前,超声引导下穿刺细胞学检查已确定病灶性质;③积极配合研究;④患者及其家属知情同意。排除标准:①伴有凝血功能障碍、免疫系统缺陷、术前甲状腺功能异常等;②颈测具有可疑转移性淋巴结,且细胞穿刺或超声检查显示包膜被侵犯;③存在射频消融术治疗禁忌症或无法耐受该种治疗方法;④精神疾病。对照组男性13 例,女性27 例;年龄42~78岁,平均(53.47±3.19)岁;病灶直径0.57~0.96 cm,平均(0.74±0.24)cm。实验组男性11例,女性29 例;年龄41~78 岁,平均(53.45±3.16)岁;病灶直径0.58~0.97 cm,平均(0.76±0.23)cm。本研究通过医院伦理委员会批准。两组性别、年龄、病灶直径等一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 对照组 予以超声引导下微波消融术治疗:协助患者摆放仰卧位,常规实施消毒及铺巾,以2%利多卡因(山东省蓬莱诺康药业有限公司,国药准字H37023231)进行局部麻醉。通过超声检查,明确病灶位置,于甲状腺包膜周边注射适当利多卡因与生理盐水混合液,注意保护颈部动脉,避免损害到喉返神经。在超声引导下经皮到结节穿刺微波天线,开展消融处理,一直到强回声彻底覆盖结节与周边组织。
1.2.2 实验组 开展超声引导下射频消融术治疗:取仰卧位,嘱咐患者头部适当后仰,予以其吸氧处理,并构建静脉通路,实施心电监护。常规消毒与铺巾,用2%利多卡因实施局部麻醉处理,根据病灶和颈部重要组织器官关系,决定是否应用隔离液(即生理盐水与利多卡因按照4∶1 混合所得溶液),可于病灶与颈部大血管、颈前肌群、食管与气管间生成液性隔离带,以避免邻近正常组织受到热损伤,减轻消融操作所带来的疼痛感。以超声技术全程监测消毒治疗效果,对于微小乳头状癌应适当增加消融范围,即保证强回声覆盖区域大于病灶范围。术后30 min 通过超声造影观察消融治疗效果,若结节中提示强化,代表消融不彻底,需要再次实施消融治疗。
1.3 观察指标
①比较两组术后并发症发生情况、病灶体积与缩小状况、复发情况。②观察两组治疗后1、2年随访,统计两组术后复发率情况。
1.4 统计学方法
数据分析采用SPSS 24.0 统计软件。计量资料以均数±标准差()表示,比较用t检验;计数资料以率(%)表示,比较用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组术后并发症发生率比较
两组术后并发症总发生率比较,差异无统计学意义(χ2=0.208,P=0.648)。见表1。
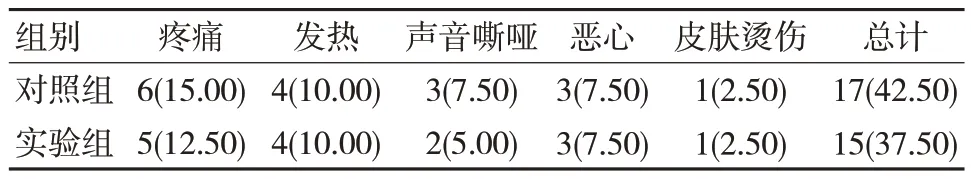
表1 两组术后并发症发生率情况 [n=40,n(%)]
2.2 两组术前和术后不同时间点病灶体积、缩小率比较
两组术后1 周、1 个月、3 个月、6 个月和1年病灶体积均小于术前,但两组1 个月、3 个月、6 个月和1 年病灶体积缩小率较术后1 周增大,差异有统计学意义(P<0.05)。两组术前、术后1 周、1 个月、3 个月、6 个月和1 年病灶体积、病灶体积缩小率比较,差异无统计学意义(P>0.05)。见表2。
表2 两组术前和术后不同时间点病灶体积、缩小率比较(n=40,)
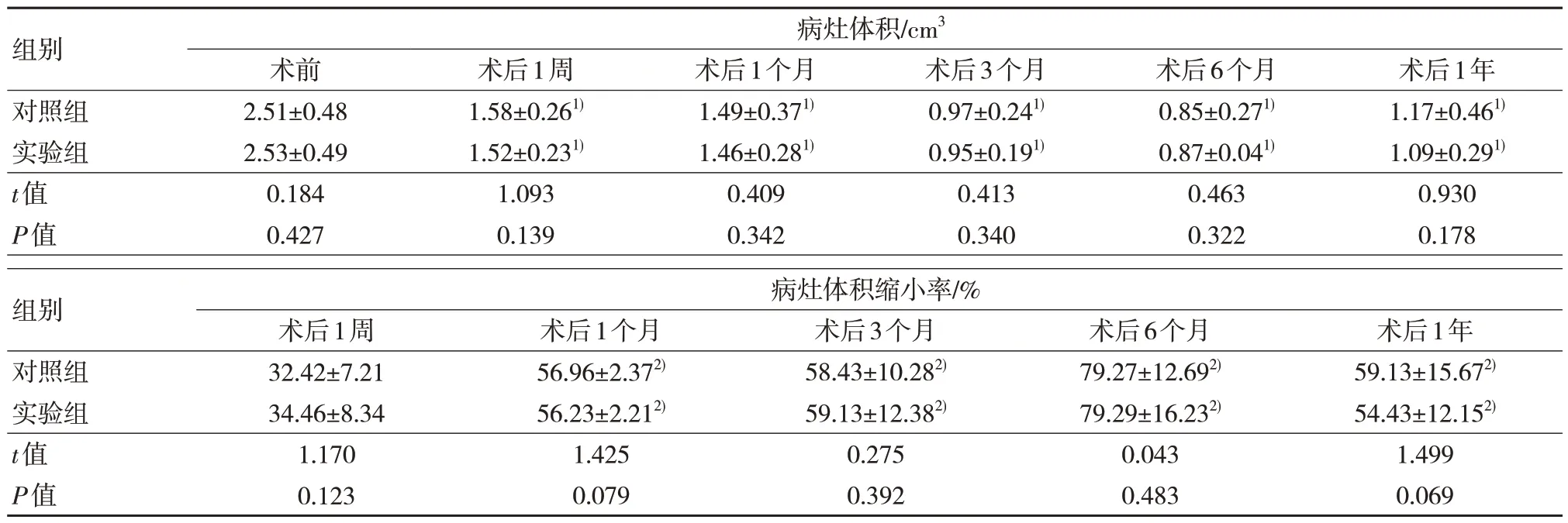
表2 两组术前和术后不同时间点病灶体积、缩小率比较(n=40,)
注:1)与术前比较,P<0.05;2)与术后1 周比较,P<0.05。
2.3 两组术后随访1、2 年复发率比较
两组术后随访1、2 年复发率比较,差异无统计学意义(P>0.05)。见表3。

表3 两组术后随访1、2 年复发率比较 [n=40,n(%)]
3 讨论
微波消融术属于物理学热消融范围内,其具有微创、操作简便等优势,且通过超声引导,能够有效提升微波针抵达病灶的准确性。超声引导下微波消融术作用机制为通过热效应杀灭肿瘤细胞,并能够最大程度暴露甲状腺正常组织。微波消融频率通常为300 MHZ~300 GHZ 高频电磁波,可于微波震荡电场内镜水分剧烈运动摩擦形成热量,促使细胞凝固坏死,但该种治疗方式出现较晚,且医疗费用较高,容易引起发热、疼痛等并发症,因此未得到临床大范围推广。
射频消融术是治疗甲状腺结节的新型方式,其具有操作简便、微创、术后恢复快、可重复性等优势,且疗效较为确切,临床应用实践价值较高,尤其是在甲状腺乳头状癌治疗方面[5-6],与传统甲状腺切除术不同,射频消融术能够促使甲状腺乳头状癌细胞丧失活性,凝固组织,而后坏死组织被机体免疫系统所吞噬、病灶逐步消退,其是一种原位灭活癌细胞的有效治疗手段[7]。另外,射频消融术还可促使甲状腺乳头状癌周边血管凝固,防控其向肿瘤细胞提供血液,从而预防肿瘤转移,抑制肿瘤细胞生长[8]。射频属于无线电频率,其主要是通过热效应作用于生物体。当射频频率>100 kHz 时,可引起组织内部带电荷离子运动并形成摩擦,温度可达60℃~100℃,而一旦温度>60℃便可导致肿瘤组织坏死。射频消融设备频率通常为200~500 kHz,输出功率为100~200 W。超声引导下射频消融术在甲状腺乳头状癌治疗中具有便捷、微创、准确等优势[9]。超声技术由于其具有经济、安全、操作简单等特征,在甲状腺乳头状癌诊疗中占据重要地位,通过超声技术的应用,可动态化观察射频针穿刺过程,实时观察射频消融术操作,这不仅能够最大程度地保留周边正常组织,还可实现肿瘤灭活的彻底性与充分性[10]。除此之外,超声造影技术可准确地显示病灶血管毁坏程度,评估射频消融术治疗后病灶坏死程度与病灶残留状况,从而为其治疗提供科学指导。
微波消融术与射频消融术虽然作用原理不同,但两者均是通过热效应,促使肿瘤细胞死亡,而在热效应作用下,极易出现发热、声音嘶哑等并发症。本研究结果显示,两组术后并发症总发生率比较无差异,提示两种治疗方式在甲状腺乳头状癌的运用方面安全性相当。两组术后1 周、1 个月、3 个月、6 个月和1 年病灶体积较术前缩小,且两组术后1 个月、3 个月、6 个月和1 年病灶缩小率较术后1 周增大,比较有差异;两组术前、术后1 周、1 个月、3 个月、6 个月和1 年病灶体积、病灶体积缩小率比较无差异,说明上述两种治疗方式均能促进患者病灶缩小。本研究结果还显示,两组术后随访1、2 年复发率比较无差异,表明以上两种治疗方式的长期治疗效果相当。
综上所述,在甲状腺乳头状癌治疗超声引导下微波消融术、射频消融术的长期治疗效果均较为理想,但后者治疗费用更低、治疗技术更加成熟,值得临床推广应用。
