不同Stanford分型急性主动脉夹层临床及CT血管成像特征分析*
2021-12-19李金平韦传斌关文华
李金平,韦传斌,关文华
(新乡医学院第三附属医院,河南 新乡 453000)
急性主动脉夹层(acute aortic dissection,AAD)是主动脉腔内的血液通过破裂的主动脉内膜撕裂口进入主动脉壁,并沿主动脉的纵向长轴撕裂主动脉内膜结构,将主动脉腔分离为了真假两个管腔[1]。AAD 之所以凶险,主要是随着疾病的进展极易发生破裂从而引起大出血、出血性休克和急性心包填塞等致命并发症[2]。但AAD 的临床表现往往缺乏特异性易造成误诊,且不同Stanford 分型AAD 患者治疗及预后等存在一定差异,因此提高临床对AAD 的认识对其早期诊断、治疗具有重要意义[3]。本研究为回顾性研究,通过对比不同Stanford 分型AAD 患者的临床及CT 血管成像(CT angiography,CTA)表现的特征,以期为临床有效诊治AAD 提供依据。
1 资料与方法
1.1 临床资料
将2011 年1 月至2020 年6 月新乡医学院第三附属医院收治的150 例AAD 患者作为研究对象,其中男110 例(73.3%),女40 例(26.7%),男女比例为2.75∶1;平均年龄(55.70±14.36)岁。收集临床资料:临床表现与体征包括胸痛、背痛、腹痛、疼痛性质(突发疼痛、转移性疼痛)、意识障碍、肢体障碍等。了解既往病史,主要包括有无高血压、心脏瓣膜病、马凡综合征等病史。记录CTA 检查前收缩压与舒张压。记录并发症发生情况:心包积液、胸腔积液,急性心力衰竭、急性肾功能不全。
1.2 影像资料
均采用64 排CT 进行胸腹联合CTA 扫描,原始图像经后处理工作站进行容积再现(volume rendering,VR)、最大密度投影(maximum intensity projection,MIP)、多层面重组(multplanar reconstruction,MPR)、曲面重建(curved planar reformation,CPR)。采用Stanford 分型[4],①Stanford A 型:夹层的初始部位(破口)位于升主动脉、主动脉弓或近段降主动脉,假腔范围广泛(图1);②Stanford B 型:初始部位(破口)位于降主动脉,假腔不涉及升主动脉(图2)。观察项目:①是否能够显示内膜破口;②真假腔识别;③假腔出口显示情况;④假腔内血栓形成情况;⑤主动脉主要分支受累情况,分别计数每位患者AAD 累及的动脉分支数。均由两名高年资诊断医师共同阅片,进行影像学判断及数据测量,诊断意见不一致时,协商后作出统一认定。
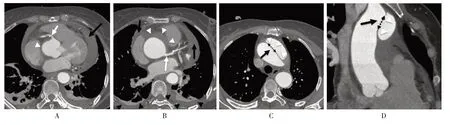
图1 Stanford A 型AAD

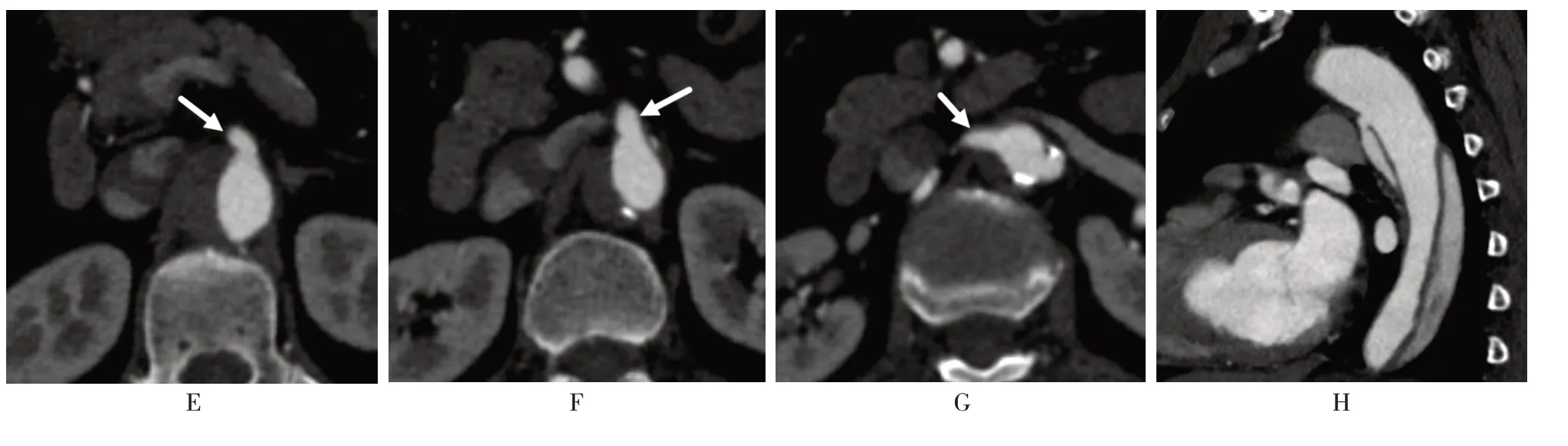
图2 Stanford B 型AAD
1.3 统计学方法
采用SPSS 19.0 软件进行数据统计分析。计量资料以均数±标准差()表示,组间比较应用独立样本t检验;计数资料以百分率(%)表示,用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 不同分型AAD 患者临床资料比较
Stanford B 型AAD 的初诊误诊率高于Stanford A 型AAD,差异有统计学意义(P<0.05)。在胸痛、突发疼痛、急性心功能不全、心包积液方面,Stanford A 型的发生率均高于Stanford B 型,而背痛的发生率低于Stanford B 型AAD,差异有统计学意义(P<0.05)。见表1。
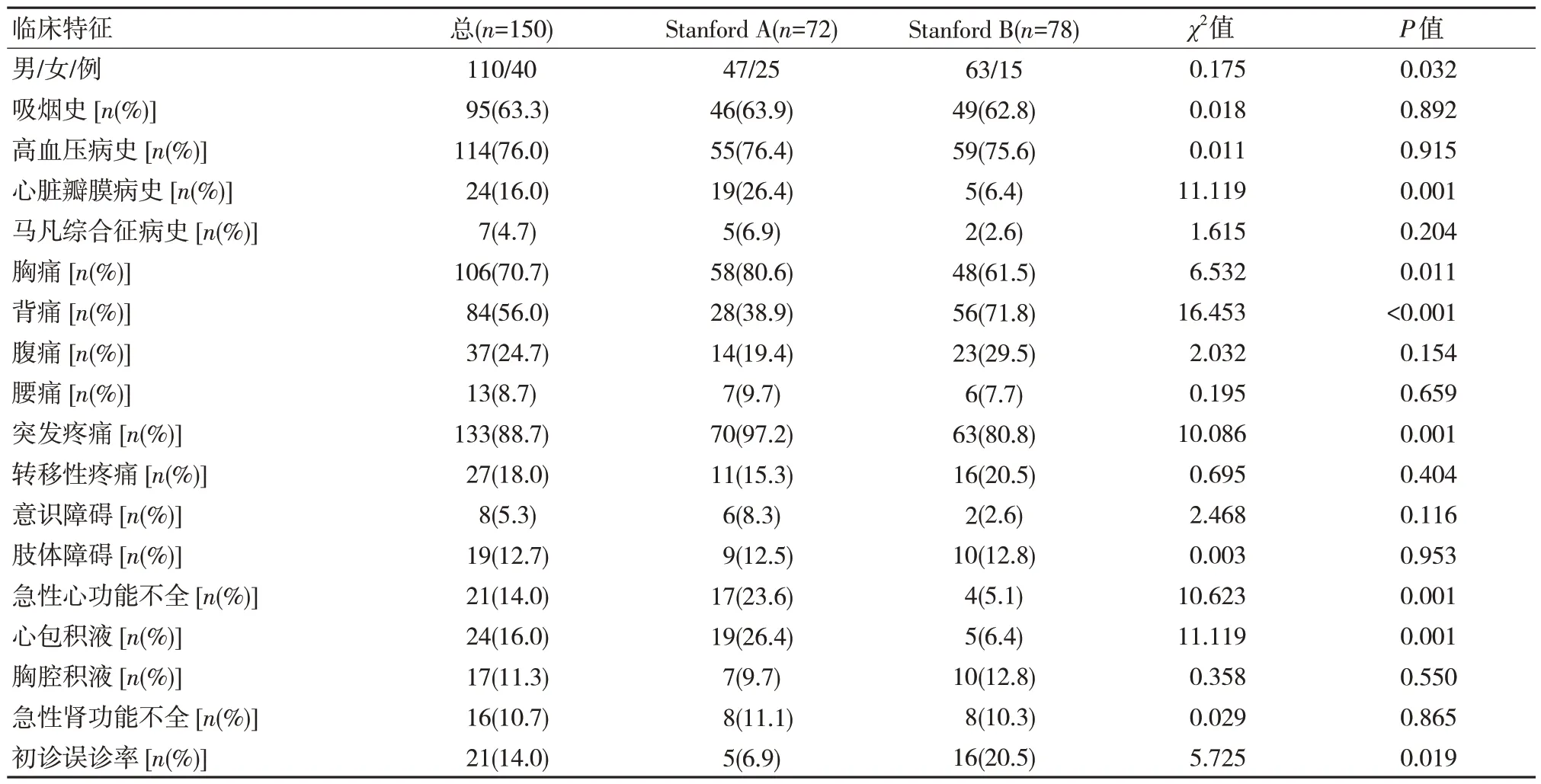
表1 不同Stanford 分型AAD 患者临床资料比较
2.2 不同分型AAD 的CTA 影像学评估
CTA 对于AAD 的分型准确性为100%。Stanford A 型AAD 累及分支血管、假腔出口的显示率以及假腔血栓的发生率均高于Stanford B 型,差异有统计学意义(P<0.05)。见表2。
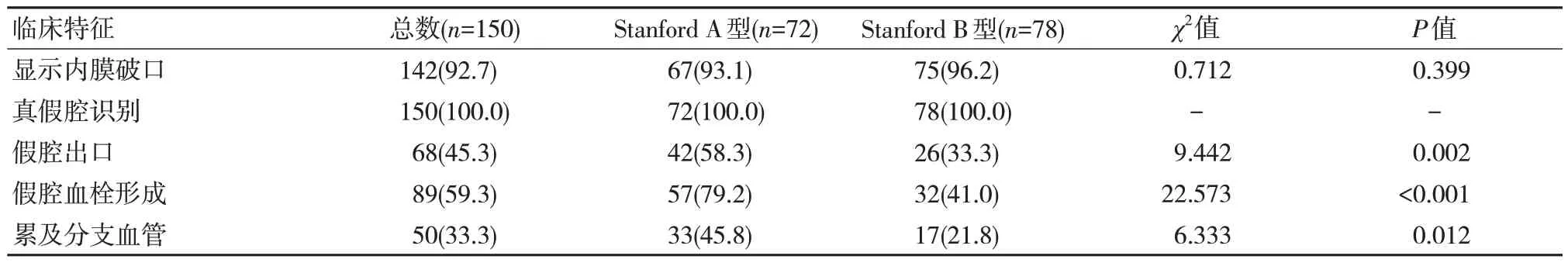
表2 不同Stanford 分型AAD 患者CTA 特征比较 [n(%)]
3 讨论
按照2014 欧洲心脏病学会(ESC)指南推荐的AAD 分期方法,将发病<14 d 的AD 定义为急性期,此时间段内AAD 病情变化快,易发生严重的并发症导致病情恶化甚至死亡[1]。AAD 30 d 的总体死亡率约为55.8%,其中Stanford A 型AAD 为73.0%,明显高于Stanford B 型AAD(13.3%)[5]。AAD 的预后很大程度上依赖于疾病的早发现、早诊断、早分型和早治疗。
AAD 患者常常伴有高血压病史,本研究中有114 例(76.0%)患者伴有高血压,但对于Stanford A 型和Stanford B 型这两种不同分型之间的高血压患病率没有明显差异(P>0.05)。在基础病方面,Stanford A 型AAD 患者具有心脏瓣膜病史多于Stanford B 型患者(P<0.05)。由于升主动脉血流为湍流,血管应力较大,若患者有心脏瓣膜病史,会增加血管应力,再加上血管壁基础病的存在则更易撕裂内膜发生AAD。
AAD 的临床表现较为复杂,易造成误诊[6-7]。本研究中总体初诊误诊率为14.0%,而Stanford B型AAD 的误诊率(20.5%)明显高于Stanford A 型AAD(6.9%)(P<0.05)。对比显示临床症状中Stanford A 型患者胸部疼痛发生率80.6%明显高于Stanford B 型患者(61.5%),并且突发疼痛的发病率97.2%高于Stanford B 型(80.8%),加之伴发急性心功能不全(23.6%)和心包积液(26.4%)的发病率较高,均有利于临床对Stanford A 型AAD的识别。其原因在于Stanford A 型AAD 夹层的初始破口部位位于升主动脉、主动脉弓或近段降主动脉,假腔范围广泛,升主动脉位置靠前,故患者多表现为前胸疼痛。同时发生Stanford A 型AAD 时,极易破坏心脏的正常解剖结构或造成心脏正常活动的受限而引起相应的严重的心脏相关的症状,其原因在于[8]:①主动脉根部的扩张和主动脉瓣的配合不良,造成主动脉瓣关闭不完全,严重时会引起心力衰竭,甚至引起心源性休克;②假腔影响冠状动脉的开放并压迫冠状动脉管腔,导致冠状动脉血流量减少,可能导致急性心肌梗塞和心功能异常,可导致衰竭或恶性心律失常、胸痛、胸闷、呼吸困难、ST 段抬高和T 波改变;③假腔血管壁发生血液的渗漏或破裂造成心包积液或心包压塞。加之升主动脉受累,极易引发急性心功能不全的发生。伴发这些情况的时候,有助于临床对ADD 的正确识别,但需要注意与急性心肌梗死进行鉴别,本组Stanford A 型AAD 中误诊的4 例病例误诊为了急性心肌梗死,1 例误诊为急性肺栓塞。而Stanford B 型AAD 夹层初始部位(破口)往往位于降主动脉,靠近背部,假腔不涉及升主动脉,故患者临床多表现为背部疼痛(71.8%),临床易误诊为急性胰腺炎及急性泌尿系梗阻。本组Stanford B 型AAD 中误诊的病例中,7 例误诊为急性胰腺炎、4 例误诊为泌尿系结石、3 例误诊为消化道穿孔、2 例误诊为急性肠梗阻。
CTA 能够准确识别AAD 的真、假腔,目前已成为AAD 诊断的首选检查方式,本研究CTA 的准确率达到100%。对比不同分型ADD 发现,Stanford A 型AAD 的内膜破口显示率为93.1%,略低于Stanford B 型(96.2%),但差异无统计学意义(P>0.05)。分析其原因在于初期采取的CTA 扫描方式是非心电门控方式,造成升主动脉容易出现动脉搏动伪影,一定程度上影响了内膜的观察[9]。
CTA 的优势不仅在于准确识别AAD,还在于能够全面的反映出AAD 疾病的严重程度。本研究显示Stanford A 型患者分支血管的受累率为45.8%(115 支)明显高于Stanford B 型患者(21.8%,54支)(P<0.05)。通过对脏器动脉起始部的观察,有利于早期发现因夹层的形成造成的诸如脑、胃肠道、肝脏、肾脏的低灌注表现,进而尽早采取相应干预措施。AAD 形成的假腔里面容易出现血栓的形成,临床可以表现出D-2 聚体的升高[10],其主要原因推测与假腔的血流相对缓慢以及流体性状的改变相关。本研究发现Stanford A 型AAD 假腔血栓形成率79.2% 高于Stanford B 型(41.0%)(P<0.05)。推测主要和A 型AAD 假腔范围往往较大相关。
综上所述,Stanford A 型AAD 较为凶险,但Stanford B 型AAD 更易发生误诊,及时采取CTA检查有助于对AAD 进行准确的诊断、分型和疾病严重程度的评估。
