西格列汀对NOD小鼠甲状腺基因表达的影响*
2021-12-19赵云娟谢云亮何欣燃陈旖鹛李万根
赵云娟,谢云亮,何欣燃,陈旖鹛,李万根
(广州医科大学附属第二医院1.内分泌科;2.体检中心,广东 广州 510260)
自身免疫性疾病包括对一系列对自身抗原的免疫反应导致靶器官损伤或功能障碍的慢性疾病。各种自身免疫性疾病具有某些共同的遗传因素和免疫过程,这些疾病往往共存于同一个人或家庭[1]。1 型糖尿病是由T 细胞介导的胰岛β 细胞破坏导致胰岛素分泌缺乏,最终导致高血糖的慢性自身免疫性疾病。甲状腺是最容易受自身免疫性疾病影响的器官。在80 余种不同的自身免疫性疾病中,肠道疾病和甲状腺功能减退是1 型糖尿病最常合并的自身免疫性疾病[2-3]。芬兰的一项全国性研究显示1 型糖尿病的患者中有五分之一患有另一种自身免疫性疾病[4]。一项为期13 年的临床随访研究发现,在1 型糖尿病患者中,自身免疫性甲状腺炎的患病率更高[5]。并发自身免疫性甲状腺炎可使儿童非复杂性1 型糖尿病患者的皮肤微循环功能显著恶化,且这一过程与患者年龄、糖尿病病程和发病年龄无关[6]。同样,自身免疫性甲状腺炎患儿中,1 型糖尿病自身抗体流行率和新诊1 型糖尿病发病率显著高于普通儿童,提示儿童自身免疫性甲状腺炎患1 型糖尿病的风险增加[7]。提示1 型糖尿病和甲状腺自身免疫异常可能存在相互作用。
本研究前期的研究发现二肽基肽酶4(DPP-4)抑制剂(西格列汀)能延缓成人隐匿性自身免疫糖尿病患者胰岛β 细胞功能的衰竭[8]。长期西格列汀干预可减轻1 型糖尿病NOD 小鼠胰岛炎症浸润,同时下调血清白细胞介素(IL)-1β 及IL-12水平[9]。DPP-4 抑制剂对1 型糖尿病NOD 小鼠胰岛β 细胞自身免疫破坏的保护作用与CD8+T 效应记忆亚群的改变相关[10],还可增加调节性T 细胞数目[11]。体外试验显示西格列汀抑制人淋巴细胞增殖和Th1/Th17 细胞分化[12]。DPP-4 抑制剂通过抗感染作用减轻1 型糖尿病动物肾脏损伤[13-14]。利格列汀(另一种DPP-4 抑制剂)上调基质细胞衍生因子对进展期糖尿病肾病起保护作用[15]。DPP-4 抑制剂可保护1 型糖尿病大鼠肠系膜动脉内皮功能[16],提示DPP-4 抑制剂对1 型糖尿病胰腺以外的器官存在生物学作用。由于甲状腺组织是1型糖尿病患者除了胰岛外最容易受到免疫攻击的靶器官,本研究将DPP-4 抑制剂干预和生理盐水干预的NOD 小鼠的甲状腺组织进行分离并纯化,利用基因芯片技术筛选甲状腺组织中的差异表达基因(differentially expressed genes,DEGs),通过生物信息学方法进行聚类和功能富集分析,筛选出关键表达基因。
1 材料与方法
1.1 实验动物及主要试剂
3 月龄雌性NOD/LtJ 小鼠6 只,购自南京大学动物模式研究所,动物合格证号:32002100000007,平均体重(24.4±1.7)g。所有动物饲养于广州医科大学实验动物中心,动物饲养级别为SPF 级。NOD 小鼠以标准饲料分笼喂养,自由饮水及进食,饲养条件:12 h 光照周期,室温维持在18~22℃,相对湿度40%~70%。所有有关动物操作均遵守广州医科大学相关动物伦理规定及条例。小鼠随机分成两组,实验组采用DPP-4 抑制剂(西格列汀)灌胃,对照组采用等体积的生理盐水灌胃。连续干预12 周,第13 周处死小鼠。DPP-4 抑制剂(西格列汀)购自美国默沙东公司。
1.2 研究方法
1.2.1 甲状腺组织分离 颈椎脱臼法处死小鼠,解剖小鼠。小鼠仰卧位固定,充分暴露颈部,切开颈部皮肤,充分暴露皮下器官,看到淡粉色的甲状腺组织,完整分离甲状腺组织,放入冻存管,之后移至-80℃冰箱保存。
1.2.2 微阵列芯片杂交与数据分析 微阵列芯片杂交实验委托北京博奥晶典生物技术有限公司完成。取DPP-4 抑制剂组和对照组NOD 小鼠甲状腺组织,根据TRIzol 试剂盒说明书提取总RNA,然后纯化,反转录成cDNA,体外转录合成cRNA,cRNA 反转录生成cDNA,纯化、定量反转录产物,通过荧光标记后进行芯片杂交。杂交结束后,取出芯片进行芯片清洗及扫描,得到杂交图片。使用Agilent Feature Extraction(v10.7)软件对杂交图片进行分析同时提取数据,最后采用Analyzer软件进行分析。基因表达的差异用P值和差异倍数(fold change,FC)表示。筛选mRNA 表达差异倍数≥2,且P<0.05 为DEGs。对DEGs 进行GO(Gene Ontology)功能分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析。
1.3 统计学方法
统计学分析采用Graph Prism 8.0 软件进行。计量资料以均数±标准差()表示,组间两两比较采用t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 筛选出NOD 小鼠甲状腺组织中差异表达的基因
NOD 小鼠甲状腺组织表达谱芯片杂交扫描以后的tiff 格式图片数据采用Feature Extraction 软件进行预处理分析,后通过GeneSpring GX 软件计算基因表达差异并计算P值。采用Cluster3.0 软件进行Cluster 分析和图形化展示。通过对DPP-4 抑制剂干预的NOD 小鼠及安慰剂干预的NOD 小鼠甲状腺组织中的差异基因进行筛选,采用火山图(图1)和聚类热图(图2)对结果进行分析。在初筛得到的差异基因中筛选服从mRNA 表达差异倍数≥2,且P<0.05,定义为差异基因,作为本次研究的目的基因。在实验组(DPP-4 抑制剂组)和对照组中,筛选出有表达差异的基因475 个,其中包含290 个基因的表达显著上调和185 个基因的表达显著下调(差异≥2 倍)。聚类热图表示这些基因在DPP-4 抑制剂组和对照组中的表达情况。
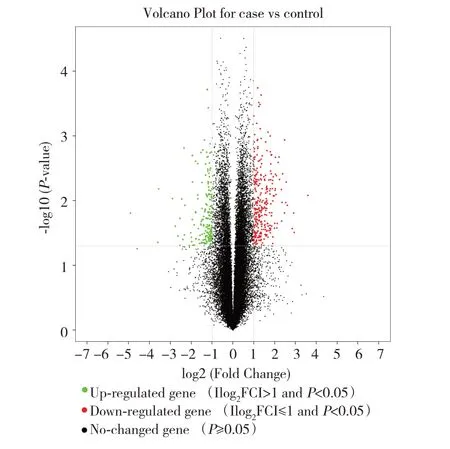
图1 DPP-4 抑制剂与安慰剂干预NOD 小鼠DEGs 的火山图分析
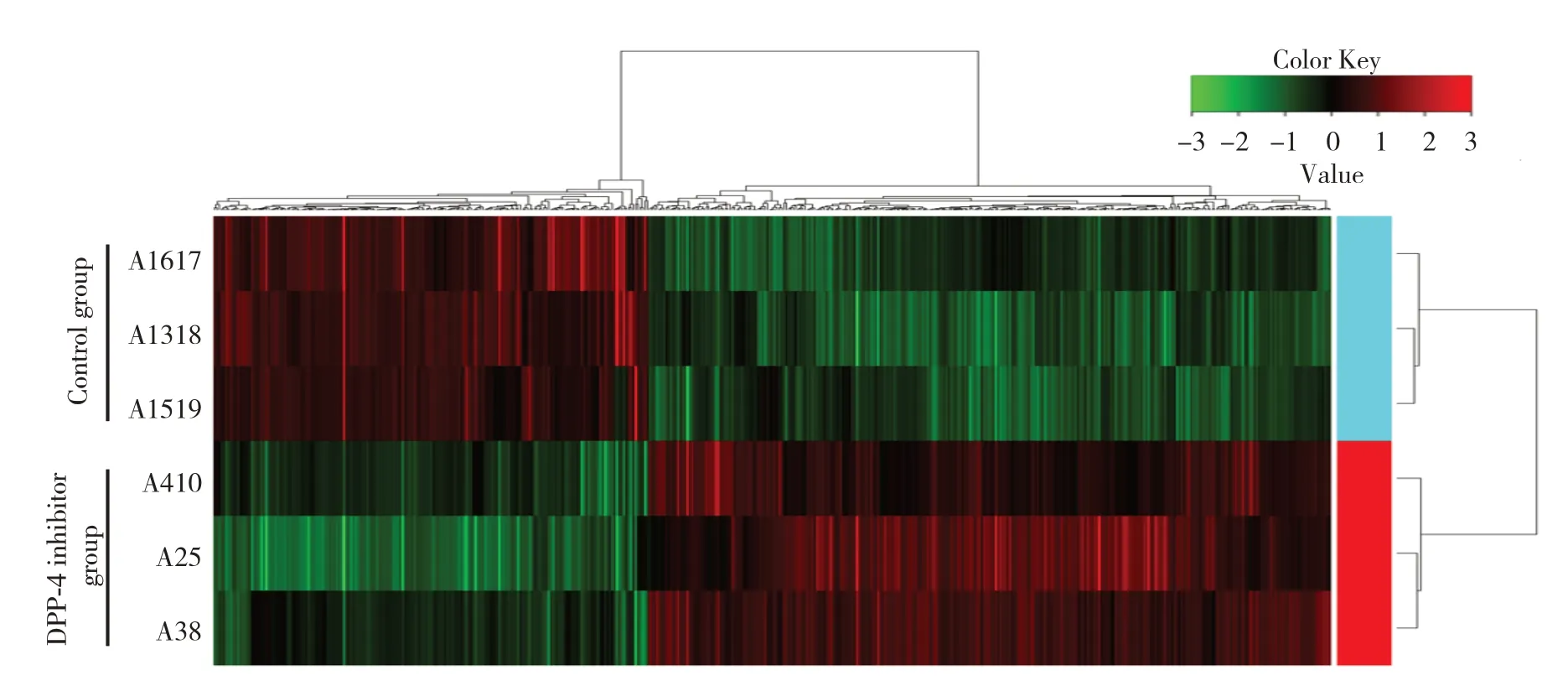
图2 安慰剂与DPP-4 抑制剂干预NOD 小鼠的差异基因的聚类热图
2.2 GO 富集分析
本研究采用clustersetup 3.0.exe 软件进行GO功能分析,以P<0.05 为筛选标结果(图3)显示DEGs 主要富集于T 细胞分化、皮肤功能调节、神经系统突触及突触后功能、浓缩核染色体着丝点功能及泛素结合酶活性等生物功能密切相关。
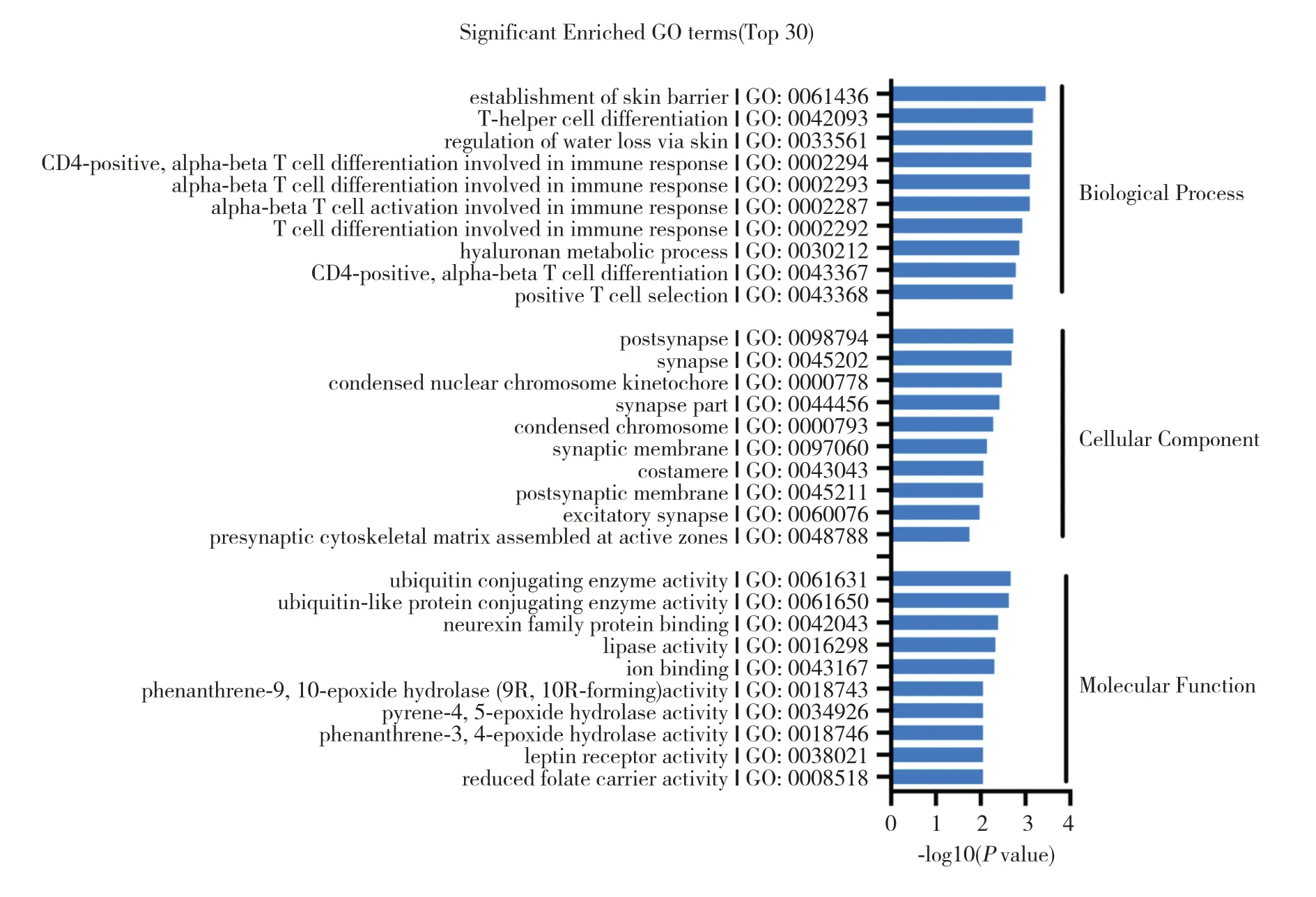
图3 DEGs 的GO 功能分析
2.3 KEGG 通路分析
笔者使用KEGG 对DEGs 进行了通路富集分析(图4)。结果显示这些基因主要富集在细胞周期后期促进复合物的转换、磷酸化、激活及介导相关蛋白的降解,有丝分裂细胞周期调节,甲基化和花生四烯酸代谢通路。进一步分析显示KEGG信号途径显著富集于花生四烯酸代谢、炎症性肠病、代谢途径、糖基磷脂酰肌醇(GPI)锚定的生物合成、血管平滑肌收缩及Janus 激酶/信号转导与转录激活因子(JAK/STAT)信号通路,差异有统计学意义(P<0.05)(表1)。通过对显著富集的miRNA 进行分析,筛选出miR-568 等10 个显著表达上调的基因和miR-686 等10 个显著表达下调的基因,差异有统计学意义(P<0.05)(图5)。
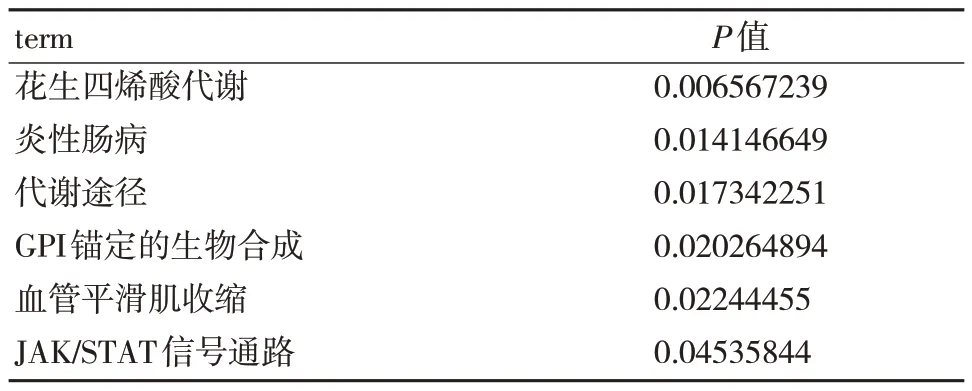
表1 mRNA 的KEGG 通路显著富集的条目(term)
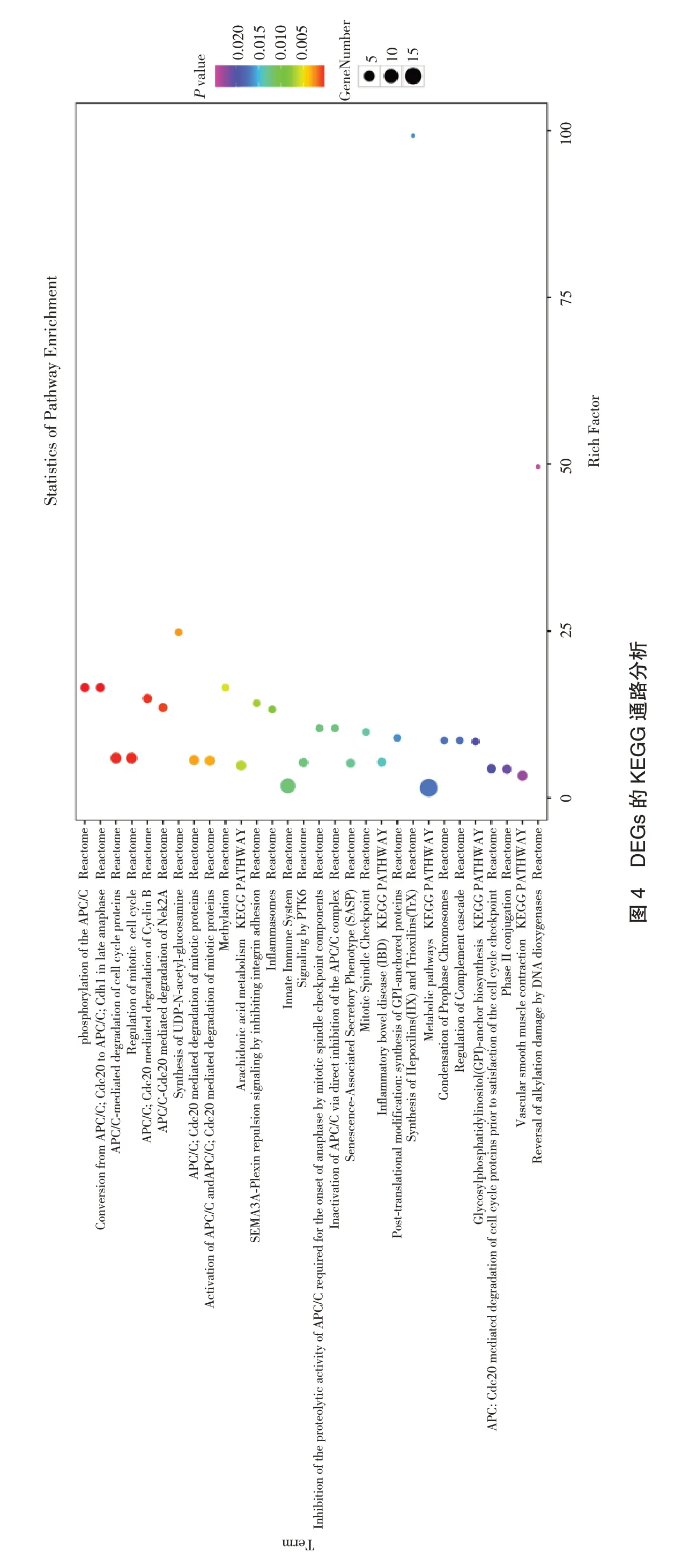
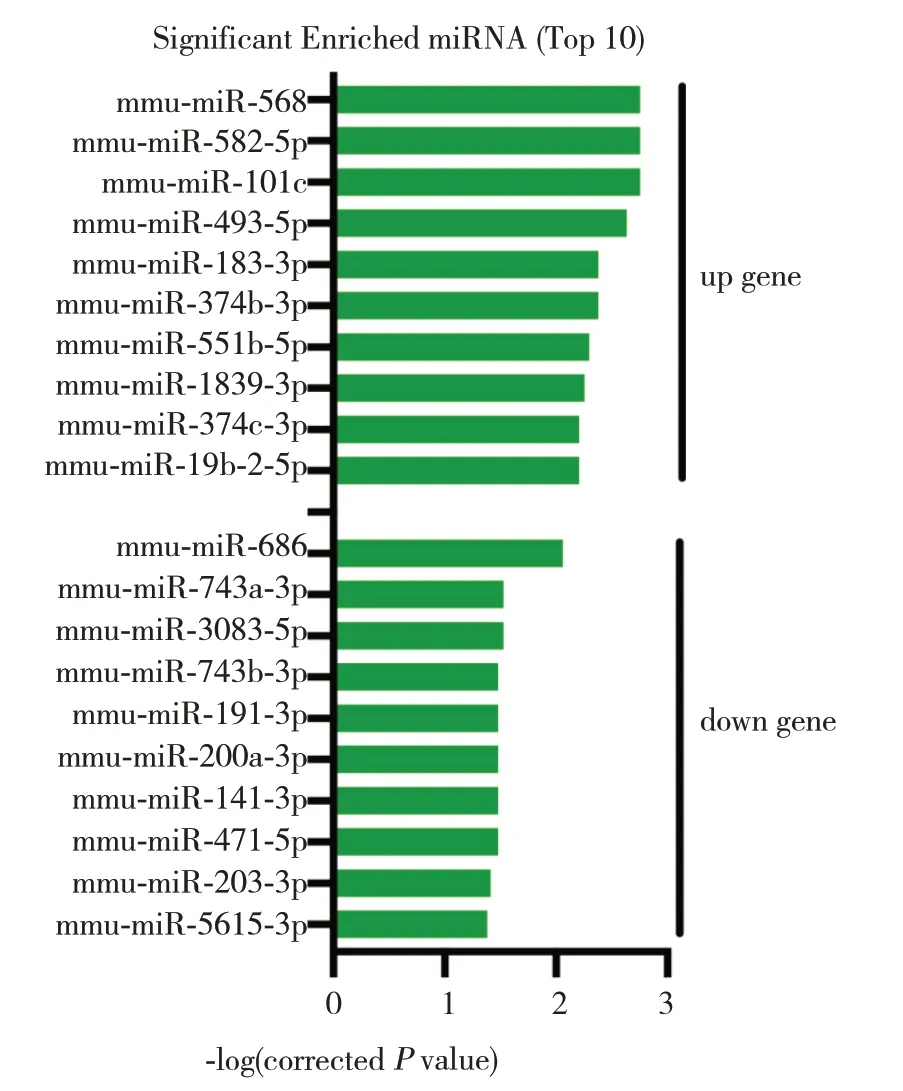
图5 显著富集的差异表达miRNA
3 讨论
通过对DEGs 进行GO 功能分析和KEGG 通路分析,发现DEGs 参与花生四烯酸代谢、炎症性肠病、代谢途径、糖基磷脂酰肌醇锚定的生物合成、血管平滑肌收缩及JAK/STAT 信号通路。花生四烯酸可减轻链脲霉素诱导的RIN5 F 细胞毒性,同时减轻链脲霉素诱导的1 型糖尿病[17]。花生四烯酸可能是内源性的抗糖尿病分子[18]。本研究显示DPP-4 抑制剂干预NOD 小鼠甲状腺组织,DEGs显著富集于花生四烯酸代谢通路,而花生四烯酸可减轻1 型糖尿病,提示DPP-4 抑制剂可能通过影响花生四烯酸代谢起到减轻1 型糖尿病的作用,这可能是除了免疫调节减轻胰岛炎以外的另一条旁路。花生四烯酸代谢产物在调节甲状腺FRTL-5细胞ATP 诱导的钙调节中起重要作用[19]。本研究显示DPP-4 抑制剂对甲状腺花生四烯酸代谢通路存在影响,提示DPP-4 抑制剂可能影响甲状腺相关免疫及功能。
既往研究显示短期使用DPP-4 抑制剂不会增加炎症性肠病的风险[20]。一项纳入198 404 例患者的meta 分析研究显示:基于保守的随机效应分析,DPP-4 抑制剂不会增加炎症性肠病的风险[21]。另一项纳入13 个随机对照临床研究显示使用DPP-4 抑制剂和炎症性肠病之间没有相关关系[22]。在实验性结肠炎的动物模型中,阿格列汀能促进肠道粘膜损伤的恢复,从而加速愈合[23]。通过联合抑制DPP-4 和丙氨酰氨肽酶N 可以通过诱发内源性自身免疫抑制机制对炎症性肠病起到有效的治疗作用[24]。本研究显示DPP-4 抑制剂干预NOD小鼠甲状腺差异基因表达富集于炎症性肠病相关基因及通路,提示DPP-4 抑制剂干预可能与炎症性肠病相关,有待进一步的研究证实。
糖基磷脂酰肌醇(glycosylphosphatidylinositol,GPI)在MDCK 细胞中起着顶端靶向信号的作用。GPI 锚定蛋白优先靶向于Fischer 大鼠甲状腺上皮细胞基底的外侧面[25]。GPI 可能在猪的甲状腺细胞调控和膜信号系统中发挥作用[26]。GPI/肌醇磷酸聚糖(inositolphosphate glycan,IPG)是参与控制甲状腺细胞增殖的胞内信号系统[27]。以上研究均提示GPI 信号在甲状腺细胞增殖及功能调节中起重要作用,而本研究显示DPP-4 抑制剂干预后甲状腺基因表达改变显著富集于GPI-锚定蛋白合成相关信号,提示DPP-4 抑制剂可能对甲状腺细胞增殖及胞内信号调节等存在影响,值得下一步深入研究。对于长期使用DPP-4 抑制剂干预的患者,可进行甲状腺功能及抗体水平监测。
西格列汀通过调节JAK/STAT 信号通路减轻实验性糖尿病大鼠心肌病[28]。西格列汀和托法替尼通过调节JAK/STAT 和TLR4/NF-κB 信号通路的交叉作用改善佐剂诱导的关节炎[29]。JAK/STAT 信号通路是调节T 细胞分化的关键信号通路。而本研究GO 富集分析显示DPP-4 抑制剂干预对NOD 小鼠甲状腺DEGs 富集于T 细胞分化。由此提示DPP-4 抑制剂可能通过JAK/STAT 信号参与T 细胞分化。既往研究显示西格列汀体外抑制人淋巴细胞增殖及Th1/Th17 的分化[12]。DPP-4/CD26 高表达于T 细胞,尤其是CD4+T 细胞表面,并参与这些细胞分化、成熟和增殖调节。西格列汀干预12周显著减少2 型糖尿病患者循环CD4+T 细胞,尤其是Th17 和Treg 细胞数目[30]。综合上述,提示DPP-4 抑制剂可能参与T 细胞的分化、成熟、增殖和激活等环节。西格列汀通过激活Kv 通道和蛋白激酶a 诱导血管舒张[31]。利格列汀联合二甲双胍通过AMPK/Nox4 信号通路对血管平滑肌重构存在潜在保护作用,从而改善糖尿病大鼠新生内膜增生[32]。本研究显示DPP-4 抑制剂干预对NOD 小鼠甲状腺组织的血管平滑肌收缩相关基因存在影响,有待进一步研究证实。
小RNA(miRNA)在淋巴细胞的发展和功能中起重要作用。miRNA-568 的表达水平在T 细胞(包括Jurkat 细胞和人外周血CD4+T 细胞)激活过程中下降,而活化T 细胞核因子5(NFAT5),进一步的研究证实miRNA-568 通过靶向针对NFAT5抑制CD4+T 细胞的激活和功能[33]。本研究中,DPP-4 抑制剂干预显著上调miRNA-568 表达水平,提示其可能对CD4+T 细胞的激活和功能存在抑制作用。miRNA-582-5p 通过抑制TGF-β 信号通路抑制前列腺癌骨转移[34]。miRNA-582-5p 通过靶向AKT3 抑制胃癌细胞增殖[35]。miRNA-582-5p 通过下调NOTCH1 抑制非小细胞肺癌的生长和侵袭[36]。miRNA-582-5p 作为细胞遗传学正常的中危性急性髓系白血病的抗肿瘤生物标志,可抑制白血病细胞的增殖并诱导白血病细胞凋亡[37]。本研究中DPP-4 抑制剂干预显著上调miRNA-582-5p,提示其对肿瘤的生长、增殖和侵袭存在抑制作用,提示DPP-4 抑制剂在肿瘤治疗方面的潜在价值。
长链非编码RNA Gm15575 能阻断miRNA-686的功能,正向调控Th17 细胞中高表达的促炎趋化因子CCL7 的表达和Th17 的分化[38]。miRNA-743a介导氧化应激线粒体苹果酸脱氢酶的上调,提示其可能在氧化应激和神经变性中起作用[39]。在体外miRNA-743a 介导的WT1 抑制可阻止肾间充质细胞的增殖[40]。本研究显示DPP-4 抑制剂干预显著下调miRNA-686 和miRNA-743a,提示其对Th17 分化、氧化应激和神经变性存在作用,有待进一步研究。
综上所述,本研究通过基因芯片技术筛选DPP-4 抑制剂干预NOD 小鼠及对照组小鼠甲状腺组织的DEGs,并进一步行基因相关功能及通路分析,结果显示DEGs 主要富集于花生四烯酸代谢等信号通路。生物学功能方面与T 细胞的分化密切相关,可能对1 型糖尿病患者的甲状腺自身免疫功能存在影响。
