贝莱斯芽胞杆菌SDTB038与化学药剂协同防治草莓枯萎病的研究
2021-12-17孙守民李鑫荣王红艳
仇 月,孙守民,李鑫荣,杨 帅,王红艳
(山东农业大学植物保护学院,泰安 271018)
我国草莓栽培面积大,总产量高[1]。近年来,随着草莓的种植面积逐渐扩大,草莓枯萎病等病害危害加重。草莓枯萎病是由尖孢镰刀菌Fusarium oxysporumf. sp.fragariae专化型侵染维管束而导致的系统性土传病害[2],在苗期或开花至收获期发病。镰刀菌的防治策略通常依赖于培育无病植株和施用土壤熏蒸剂。但是,培育无病植株费时费力,土壤熏蒸成本较高且常造成环境破坏等问题。化学杀菌剂对草莓枯萎病防效较高,但常伴随着环境污染、食品安全等问题[3]。
植物根际促生菌(plant growth promoting rhizobacteria,PGPR)被认为能够有效减少化学肥料投入[4],改善土壤质量并增加农作物产量[5]。目前,已经有许多生防菌被报道,如苏云金芽胞杆菌Bacillus thuringiensis[6]、解淀粉芽胞杆菌Bacillus amyloliquefaciens[7]、甲基营养型芽胞杆菌Bacillus methylotrophicus[8]、枯草芽胞杆菌Bacillus subtilis[9]和多粘类芽胞杆菌Paenibacillus polymyxa[10]。生防制剂由于其环保、安全、方便的特点逐渐被广大农民接受,与化学药剂协同使用也具有广泛的应用前景。生物防治符合我国植物病虫害绿色防控的理念,为植物病害防治提供了新方向。
贝莱斯芽胞杆菌Bacillus velezensis作为一类重要的生物防治资源[11],可以产生次生代谢产物,对多种真菌和细菌有较高的抑制活性,在农业生产中具有广阔的市场前景[12]。目前,尚无贝莱斯芽胞杆菌防治草莓枯萎病的相关报道及产品登记。本研究采用课题组分离的贝莱斯芽胞杆菌,与化学药剂联合使用,验证其协同防治效果,评价生防菌 SDTB038对草莓枯萎病的防控效果。研究结果将为利用贝莱斯芽胞杆菌防治植物病害和后续微生态制剂的制备奠定理论基础,同时为生物防治提供技术支撑。
1 材料与方法
1.1 试验材料
多菌灵、己唑醇、吡唑醚菌酯、苯醚甲环唑、百菌清、肟菌酯、嘧霉胺和氟醚菌酰胺原药由山东农业大学农药环境毒理研究中心提供;草莓枯萎病病原菌尖孢镰刀菌专化型[2],菌株SDTB038由山东农业大学农药毒理与应用技术实验室提供;PDA培养基:200 g马铃薯、20 g葡萄糖、20 g琼脂和1 L去离子水,121 ℃灭菌30 min;LB培养基:1 L去离子水,10 g胰蛋白胨,10 g NaCl,5 g酵母粉,20 g琼脂粉,121℃灭菌30 min;盆栽试验所用草莓品种为妙香,由泰安市岱岳区房村镇种苗供货商提供。
1.2 菌株SDTB038的鉴定
形态学鉴定:观察菌株SDTB038在LB培养基中的形态特征,使用透射电镜JEM 1400 plus拍照观察SDTB038细胞形态。
生理生化鉴定:参考《常见细菌系统鉴定手册》[13]的方法,测试的生理生化指标包括革兰氏染色,对不同种类碳源、氮源能否单一利用,硝酸盐还原反应,甲基红反应,V-P反应等。试验试剂由南京诺唯赞生物科技有限公司(Nanjing Vazyme Biotech Co., Ltd)提供。
分子生物学鉴定:使用引物扩增菌株SDTB038的16S rRNA和gyrB基因序列[14],交由生工生物工程(上海)股份有限公司(Angon Biotech (Shanghai) Co., Ltd.)测序。测序结果通过NCBI数据库进行比对并用MEGA 7.0软件采用邻接法构建系统发育树。
1.3 菌株SDTB038平皿对峙试验
采用平板对峙法[12]测定菌株SDTB038对草莓枯萎病菌的抑菌效果。将培养5 d的草莓枯萎病菌用打孔器打取菌饼,放置于培养皿中央,将1 μL 108cfu/mL菌液接种于菌饼两侧,25 ℃黑暗培养5 d后观察试验结果。
1.4 室内毒力测定试验
采用菌丝生长速率法[15]测定杀菌剂对草莓枯萎病菌的室内毒力。药剂设计以下浓度梯度(表1),所选药剂除多菌灵用少量乙酸溶解外,其他药剂均用少量丙酮溶解,然后用灭菌水配制成1×104mg/L母液备用,并设置溶剂对照。25 ℃黑暗条件下倒置培养5 d后观察试验结果。生长抑制率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100。

表1 药剂浓度设置Table 1 Pesticide concentration settings
1.5 生防菌和化学药剂对病原菌菌丝形态的影响
参照1.3的方法,将病原菌在PDA平板对峙培养5 d,从距离SDTB038最近的边缘部位用无菌刀片切取长为5 mm的菌块。参照1.4的方法分别制作含肟菌酯和苯醚甲环唑的PDA平板,倒置培养5 d后,用无菌刀片从菌落边缘切取长为5 mm的菌块。样品经戊二醛和乙酸双重固定,乙醇系列脱水,并用离子溅射镀金后放入观察仓进行观察。
1.6 贝莱斯芽胞杆菌SDTB038与化学药剂相容性试验
制成含有肟菌酯和苯醚甲环唑的LB平板,肟菌酯的浓度设置为10、30、60和90 mg/L;苯醚甲环唑的浓度设置为25、50、75和100 mg/L。挑取SDTB038单菌落于液体LB培养基中恒温过夜培养获得种子液,将种子液以1%的接种量接种于液体LB中,35 ℃、180 r/min振荡培养12 h,用灭菌LB将发酵液浓度稀释到10-6。每个含药平板涂布100 μL稀释后的发酵液,以不含药剂的LB平板作空白对照,以含氨苄的LB平板作药剂对照,每个处理设3个重复,在35 ℃恒温培养箱中培养12 h,记录单菌落数。
1.7 贝莱斯芽胞杆菌SDTB038与药剂混用协同防治草莓枯萎病
将健康的、长势一致的2叶1心的草莓幼苗移栽于盛有121 ℃高压灭菌30 min的无菌土的150 mm×130 mm花盆中,每盆1棵草莓苗。试验共设8个处理:A:80%多菌灵可湿性粉剂作为药剂对照,无菌水配制成350 mg/L,每株喷施10 mL;B:SDTB038发酵液108cfu/mL,每株灌根处理30 mL;C:40%的苯醚甲环唑悬浮剂,无菌水配制成20 mg/L,每株喷施10 mL;D:40%的苯醚甲环唑悬浮剂,无菌水配制成40 mg/L,每株喷施10 mL;E:20 mg/L苯醚甲环唑,每株喷施10 mL并使用30 mL SDTB038发酵液108cfu/mL灌根;F:50%的肟菌酯水分散粒剂,无菌水配制成29 mg/L,每株喷施10 mL;G:50%的肟菌酯水分散粒剂,无菌水配制成42 mg/L,每株喷施10 mL;H:29 mg/L肟菌酯,每株喷10 mL并使用30 mL SDTB038发酵液108cfu/mL灌根。发酵液施用方法为灌根处理,SDTB038菌液浓度为108cfu/mL。化学药剂在灌根后进行喷雾处理,着重喷施根茎部位。每个处理设5个重复,以灭菌水处理作为阴性对照。草莓枯萎病的病情分级标准以叶片为单位,分为5级[15]:0级,无症状;1级,病株有1/4以下的叶片出现萎蔫状;2级,有1/4~1/2的叶片出现萎蔫状;3级,有1/2以上的叶片出现萎蔫状;4级,病株死亡或接近死亡;分别于药后处理7、14和21 d调查病情指数并计算防治效果,病情指数=∑(各级病叶数×代表数值)/(调查总叶数×最高病级值)×100,防治效果(%)=∑(对照病情指数-处理病情指数)/对照病情指数×100。
1.8 数据统计与分析
利用SPSS和Excel软件,采用Duncan氏新复极差法进行差异显著性检验。
2 结果与分析
2.1 菌株SDTB038的鉴定
菌株SDTB038的菌落在LB培养基上(图1)呈乳白色,凸起,且有规则的边缘;生理生化结果(表2)显示菌株SDTB038为革兰氏阳性细菌,不能够利用丙二酸,不能够产生硫化氢气体和荧光色素;透射电镜(图2)结果显示SDTB038细胞为杆状,有厚厚的荚膜,且周生鞭毛。根据形态学及生理生化特征,对照细菌鉴定手册和相关文献,初步将菌株SDTB038鉴定为芽胞杆菌[12,16]。
图1 菌株SDTB038菌落形态Fig. 1 Colony morphology of strain SDTB038

图2 25000×透射电镜菌株SDTB038细胞形态Fig. 2 The morphology of strain SDTB038 cell in 25000×transmission electron microscope
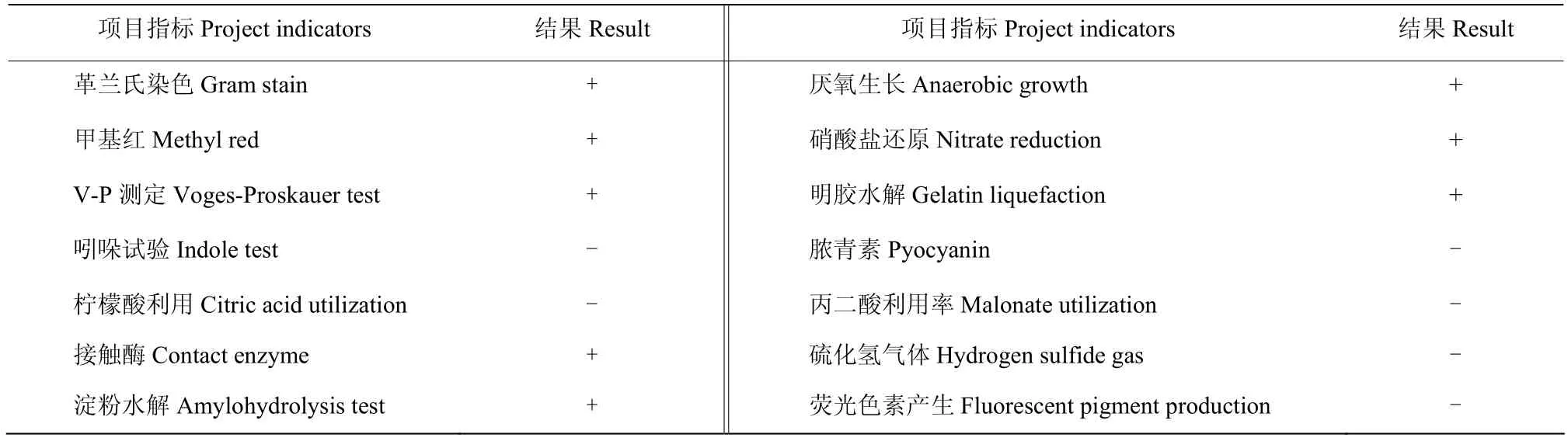
表2 菌株SDTB038生理生化指标Table 2 Physiological and biochemical indexes of strain SDTB038
菌株SDTB038的16S rRNA(图3)和gyrB(图4)基因系统发育树结果显示SDTB038与贝莱斯芽胞杆菌有90%以上一致性。通过上述试验结果,将菌株SDTB038鉴定为贝莱斯芽胞杆菌。

图3 菌株SDTB038的16S rRNA基因系统发育树Fig. 3 The phylogenetic tree of strain SDTB038 16S rRNA sequence
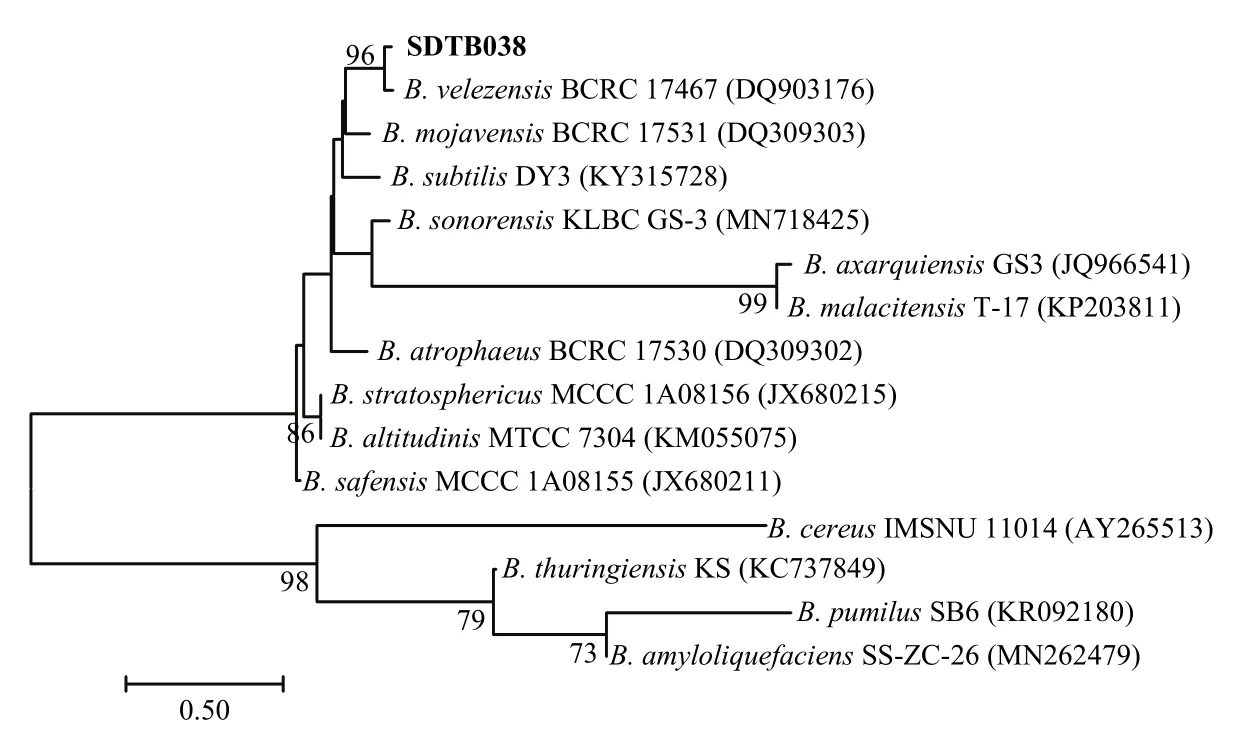
图4 菌株SDTB038的gyrB基因系统发育树Fig. 4 The phylogenetic tree of strain SDTB038 gyrB gene sequence
2.2 贝莱斯芽胞杆菌SDTB038的抑菌效果
贝莱斯芽胞杆菌 SDTB038对草莓枯萎病菌有抑制作用(图5)。
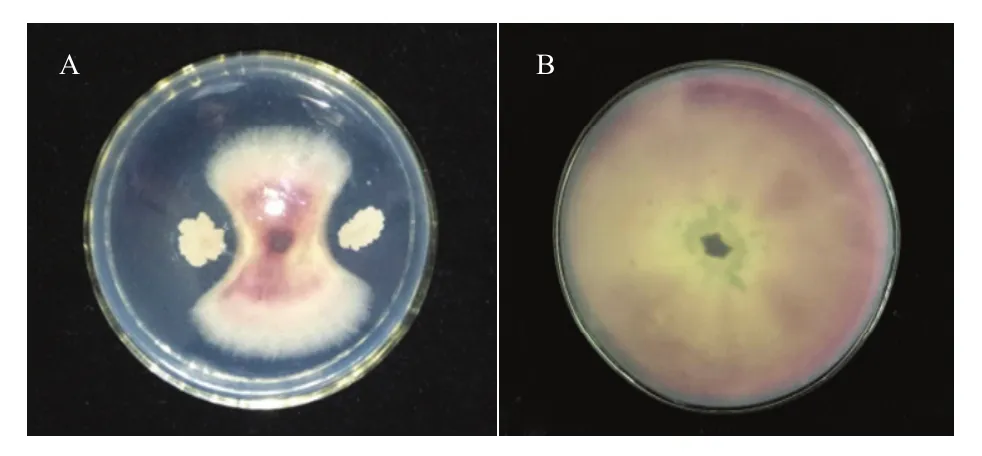
图5 菌株SDTB038对草莓枯萎病菌的抑制效果Fig. 5 Inhibitory effect of the strain SDTB038 on F. oxysporum
2.3 室内毒力测定试验
8种不同作用机制杀菌剂对草莓枯萎病菌毒力测定结果(表3)表明,多菌灵、己唑醇、吡唑醚菌酯、苯醚甲环唑、百菌清、肟菌酯、嘧霉胺和氟醚菌酰胺的EC50值分别为0.133、4.373、6.729、0.639、3.512、1.949、22.570和18.137 mg/L,其中多菌灵、苯醚甲环唑和肟菌酯的毒力更高,应为备选的高效药剂。
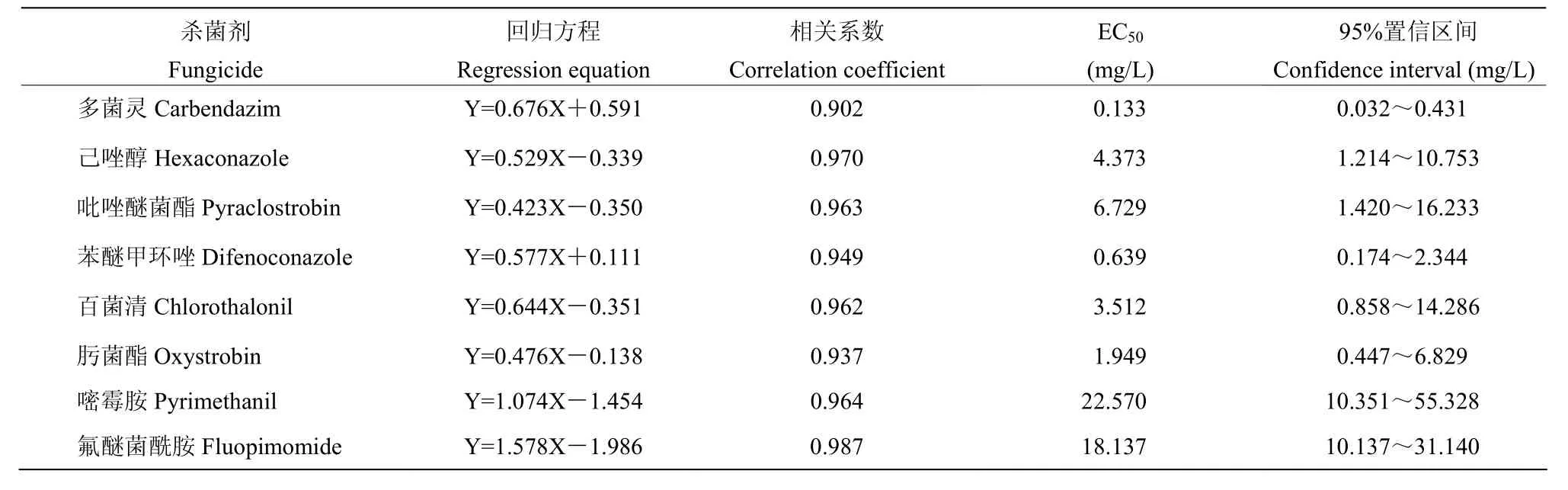
表3 杀菌剂对草莓枯萎病的室内毒力Table 3 Indoor toxicity of fungicides against F. oxysporum
2.4 生防菌和化学药剂对病原菌菌丝形态的影响
从图6可以看出,SDTB038处理后的草莓枯萎病菌的菌丝表面有大量细菌包被(图6B),病原菌生长受到明显的抑制;肟菌酯处理后的菌丝表面有明显的凹陷(图6C);苯醚甲环唑处理后的菌丝在形态上发生分支(图6D)。
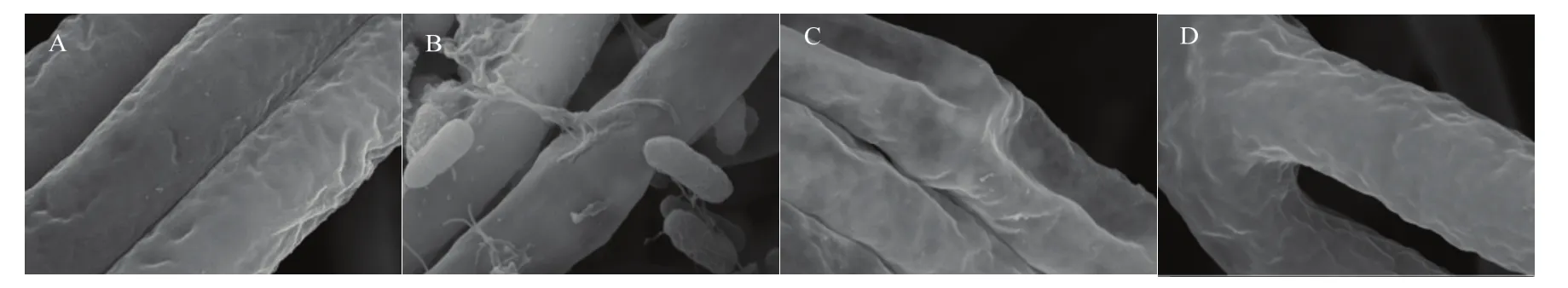
图6 20000倍扫描电镜图Fig. 6 20000×scanning electron microscope
2.5 相容性试验
相容性试验结果(表4)表明,贝莱斯芽胞杆菌SDTB038分别能够在10、30、60、90 mg/L肟菌酯和25、50、75、100 mg/L苯醚甲环唑的含药平板上正常生长,含药平板中的菌落数目与空白对照相比没有明显差异,且菌落生长形态与对照生长一致。
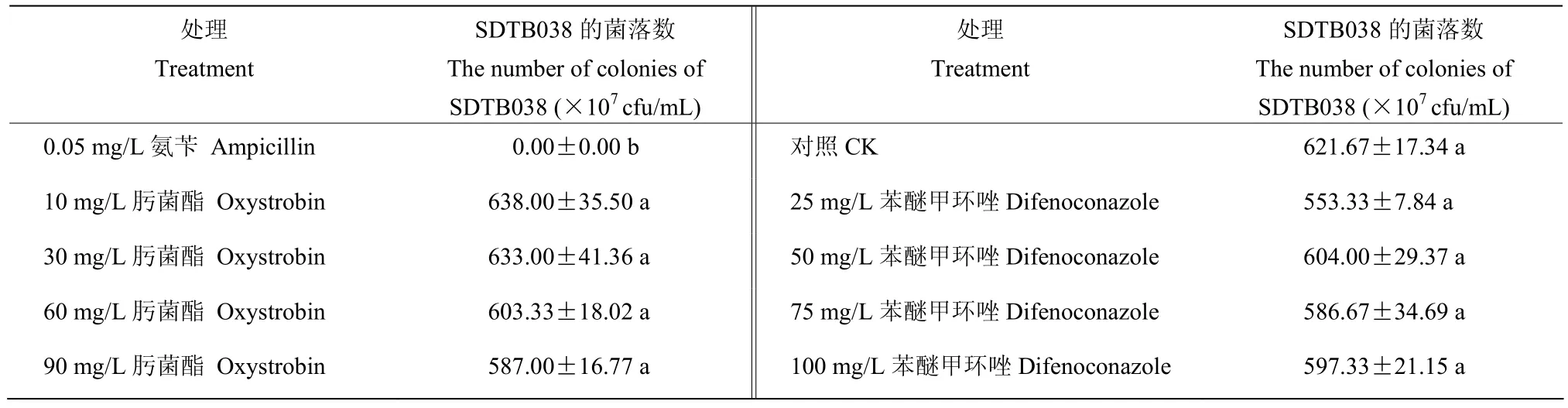
表4 菌株SDTB038与化学药剂相容性试验Table 4 Compatibility test of strain SDTB038 and chemical pesticides
2.6 贝莱斯芽胞杆菌SDTB038与化学药剂协同防治草莓枯萎病的温室试验
表5结果表明,化学杀菌剂苯醚甲环唑、肟菌酯分别与贝莱斯芽胞杆菌SDTB038联用对草莓枯萎病有较好的防治效果。施药后7 d,SDTB038发酵液处理的防效最低,仅为13.38%。单独使用化学杀菌剂40 mg/L苯醚甲环唑的防效最高,为56.36%;其次为20 mg/L苯醚甲环唑与生防菌发酵液联用的防效,为51.17%,并与对照药剂350 mg/L多菌灵处理49.79%的防效相当;再次分别为42 mg/L肟菌酯处理43.01%的防效及29 mg/L肟菌酯与生防菌发酵液联用40.94%的防效(P<0.05)。

表5 贝莱斯芽胞杆菌SDTB038与化学药剂协同防治草莓枯萎病的温室试验防治效果Table 5 Effect of the combination of Fungicide and Bacillus velezensis SDTB038 (108 cfu/mL) on strawberry Fusarium wilt in greenhouse
药后14 d,所有处理的防效均继续提高。其中防效最高的处理为施用40 mg/L苯醚甲环唑处理的防效以及20 mg/L苯醚甲环唑与生防菌发酵液联用处理的防效,分别为70.52%和69.48%,两处理防效相当,且显著高于多菌灵处理的防效;42 mg/L肟菌酯处理的防效及29 mg/L肟菌酯与生防菌发酵液联用的防效均与对照药剂多菌灵处理的防效相当(P<0.05)。
药后21 d,两种杀菌剂与生防菌联用处理的防效仍有明显提高,持效性较好。20 mg/L苯醚甲环唑与生防菌联用的防效达74.01%,29 mg/L肟菌酯与生防菌发酵液联用的防效为62.5%,均显著高于对照药剂多菌灵的防效(P<0.05)。
3 讨论
芽胞杆菌是一种重要的生物资源,是最广泛使用的生物防治剂之一,其生防机理主要有抗生、竞争、促生及诱导抗性(ISR)等[17]。本试验通过形态观察、生理生化试验和分子鉴定手段将实验室前期分离得到的菌株 SDTB038鉴定为贝莱斯芽胞杆菌。贝莱斯芽胞杆菌是一种环境友好的拮抗芽胞杆菌,由于其能促进植物生长,有效抑制农业生产中的多种植物病原菌,防治疫霉菌、茄子根瘤菌和尖镰孢菌等引起的植物病害,已被广泛应用于生物防治[18]。王雨等[19]报道了贝莱斯芽胞杆菌HN-2对杧果炭疽菌有较好抑菌作用的;李生樟等[20]分离鉴定了贝莱斯芽胞杆菌 504对黄单胞菌属的细菌具有较好的抑菌活性;王伟等[21]报道菌株 X-75对番茄灰霉病菌灰葡萄孢菌具有明显的拮抗作用。本研究不仅测定了贝莱斯芽胞杆菌SDTB038对草莓枯萎病菌的抑菌活性,还测定了SDTB038与化学药剂联合施用的盆栽防治效果,结果显示SDTB038菌株在草莓枯萎病防治中具有良好的应用前景。
生物防治对人畜安全、环境友好且不易引发抗药性[21,22],受到国内外学者关注,但因其田间效果不稳定、药效发挥慢、田间防效差等不足严重制约了生防制剂的推广应用[23,24]。研究表明,化学药剂能帮助生防菌克服包括病原菌在内的习居微生物的排斥作用,利于其在土壤中顺利定殖生存进而成为优势种群,从而发挥生物防治作用[25-27]。本研究通过室内毒力测定从8种化学药剂中筛选出了抑菌效果良好的苯醚甲环唑和肟菌酯,且生物相容性试验结果显示,SDTB038与苯醚甲环唑、肟菌酯相容性较好,SDTB038在药剂含量为100 mg/L的平板上仍能正常生长。盆栽试验结果表明,药后21 d,29 mg/L肟菌酯与SDTB038协同防治效果为62.56%,20 mg/L苯醚甲环唑与SDTB038协同防治效果为74.01%,显著高于生防菌及同剂量化学药剂单独施用的防治效果,与42 mg/L肟菌酯、40 mg/L苯醚甲环唑的防治效果75.77%和82.82%相近。目前,已有报道证实解淀粉芽胞杆菌与氟啶胺复配对草莓灰霉病的防效达 70.21%[25],枯草芽胞杆菌与吡唑醚菌酯混用对草莓枯萎病的防效为 72.42%~92.11%[28],但关于贝莱斯芽胞杆菌与化学药剂联合施用的报道较少,因此,探索SDTB038与化学药剂协同防治草莓枯萎病具有重要意义。
本研究证实贝莱斯芽胞杆菌 SDTB038发酵液与化学药剂联用对草莓枯萎病有较好的防治效果,能够减少化学药剂肟菌酯和苯醚甲环唑的用量,也会显著降低化学农药在草莓上的残留量,对草莓绿色生产中降低农药残留量,保护农业生态环境,实现健康栽培和保障农产品质量安全意义重大。但本试验仅在盆栽试验中进行了防效验证,其实际防治效果仍需要进行田间试验。贝莱斯芽胞杆菌 SDTB038具有较高的研究和应用价值,有潜力将其开发为一种生物农药或微生态制剂。本研究将为防治植物病害和后续微生态制剂的制备奠定理论基础,同时为生物防治提供技术支撑。
