羊奶源产细菌素乳酸菌筛选、鉴定及益生特性研究
2021-12-17杨珍珠潘秭琪陶乐仁
杨珍珠,潘秭琪,迟 海*,陶乐仁
(1 上海理工大学健康科学与工程学院 上海200093 2 中国水产科学研究院东海水产研究所 上海200090 3 大连海洋大学食品科学与工程学院 辽宁大连116023)
益生菌是一类具有改善宿主新陈代谢,增强免疫力,调节肠道菌群作用的活体微生物,当宿主摄入一定量益生菌时可以对宿主发挥有益作用[1]。由于乳酸菌(Lactic acid bacteria,LAB)被普遍认定为安全的微生物,同时其具有在低pH 值条件下存活、黏附能力强、产抑菌物质等特性,因此大多数乳酸菌常被看作益生菌[2]。其中,嗜热球菌、乳球菌、肠球菌、乳杆菌等都是当前研究较广、商业化集中的菌种[3-6]。
乳酸菌在生长过程中会产生许多抑菌物质,其中由乳酸菌核糖体合成产生的一类抑菌肽,命名为细菌素,对其亲缘较近的细菌有高效的抑制作用。也有部分细菌素具有广谱抑菌活性,可抑制食品腐败菌和致病菌[7]。与其它抑菌物质不同,细菌素的抑菌作用具有特异性,对它的靶细菌具有高效的杀灭作用[8]。此外,细菌素具有热和酸碱耐受,在体内易降解、安全、无残留的特点[9]。筛选产细菌素的乳酸菌,分析其潜在的益生特性,对于预防和治疗某些特定致病菌引起的肠道疾病具有重大的意义。
本研究以羊奶源中提取乳酸菌为指标菌,以3 种常见的食源性致病菌【单增李斯特菌(Listeria monocytogenes)、金黄色葡萄球菌(Staphylococcus aureus)、蜡样芽孢杆菌(Bacillus cereus)】为指示菌,筛选具有抑制上述食源性致病菌活性的乳酸菌,并对其进行分子、生化等特性分析。同时,通过模拟胃肠液的耐受性、聚集性试验,探讨羊奶源中筛选出的乳酸菌的益生特性,旨在对产细菌素的乳酸菌的益生性能进行评价,为微生态制剂开发提供基础数据。
1 材料与方法
1.1 试验菌株
单增李斯特菌LFM2813、金黄色葡萄球菌LFM3263、蜡样芽孢杆菌LFM2805、乳酸乳球菌LFM2122(Lactococcus lactisLFM2122)、大肠埃希氏菌LFM3704(Escherichia coliLFM3704),由中国水产科学研究院东海水产研究所保存。
1.2 培养基与试剂
鲜羊奶购于陕西渭南;脑心浸液培养基(Brain Heart Infusion,BHI),美国BD 公司;MRS 培养基、兔血清平板,北京陆桥技术有限责任公司;M17 培养基,青岛高科园海博生物技术有限公司,甘油、矿物油、盐酸、多黏菌素B、牛胆盐、氯霉素、胰蛋白酶、胃蛋白酶、乳糖,国药集团(上海)化学试剂有限公司;琼脂糖,美国Invitrogen 公司;琼脂粉、硫酸链霉素、氨苄青霉素、β-半乳糖苷酶试剂盒,北京索莱宝公司;呋喃妥因、萘啶酮酸,生工(上海)生物工程股份有限公司;DNA 提取试剂盒、Taq 酶,Takara 公司;API 50CH 细菌糖代谢试剂盒,法国梅里埃公司。
1.3 主要仪器与设备
YXQ-LS-50SII 立式灭菌锅,上海博讯实业有限公司医疗器械厂;MIR-153 恒温培养箱,日本三洋(SANYO)电机公司;SW-CJ-2FD 超净工作台,苏州安泰空气技术有限公司;水平电泳槽及成像系统,美国Bio-rad 公司;DK-524 水浴锅,上海精宏实验设备有限公司;TG16WS 高速离心机,长沙湘智离心机仪器有限公司;PHS-2F pH 计,上海仪电科学仪器股份有限公司;普通PCR 仪,美国thermo 公司;XY300C 电子天平,常州市幸运电子设备有限公司;QT-2 旋涡混合器,上海琪特分析仪器有限公司;Power Wave XS 酶标仪,美国伯腾仪器有限公司。
1.4 试验方法
1.4.1 乳酸菌筛选 无菌条件下将25 mL 鲜羊奶溶解于225 mL 生理盐水中,均质后静置30 min,进行梯度稀释,将100 μL 样品涂布在预先添加多黏菌素B(0.5 g/mL)的MRS 和LM17(M17 培养基中加入0.5%的乳糖)培养基上,30 ℃无氧条件下培养48 h 后选取培养基中的单菌落接种至LM17液体培养基中,厌氧条件下30 ℃过夜培养。通过革兰氏染色,过氧化氢酶反应和pH 值测定对乳酸菌进一步筛选,将筛选出的菌株划线并在体积分数13%甘油中保存。
1.4.2 抑菌活性测定 以3 种食源性致病菌(单增李斯特菌、金黄色葡萄球菌、蜡样芽孢杆菌)为指示菌株,以筛选出的乳酸菌为指标菌,根据琼脂扩散法,参考迟海等[10]的方法,筛选具有抑菌活性的乳酸菌。
1.4.3 抑菌稳定性测定 将有抑菌活性的指标菌在30 ℃下培养过夜后,10 000 r/min 条件下离心30 min,收集上清液,利用0.22 μm 膜去除残留的细菌,将上清液置于100 ℃水浴10 min,参考Chi等[11]的方法,利用96 孔板微量稀释法,测定指标菌的抑菌情况。
将指标菌在30 ℃过夜培养后,根据琼脂扩散法,参考迟海等[10]的方法,判断酶试剂(20 μg/mL的蛋白酶K 和1 mg/mL 的胰蛋白酶)对抑菌物质活性的影响。
1.4.4 基因组DNA 提取、PCR 扩增及菌种鉴定使用细菌基因组DNA 提取试剂盒对有抑菌活性的指标菌的DNA 进行提取,以提取的细菌基因组DNA 为模板,以12F:5'- AGGGTTGCGCTCGTTG-3' 和15R:5'-TACGGGAGGCAGCCAG-3' 为引物进行PCR 扩增,扩增条件为:94 ℃、2 min;94 ℃、30 s,50 ℃、30 s,72 ℃、1 min,30 个循环;72 ℃、5 min。然后将扩增产物送至生工生物工程(上海)股份有限公司进行测序。
1.4.5 基因组重复序列PCR 基因组重复序列PCR(Repetitive extragenic palindromic PCR,rep-PCR)参考Silva 等[12]的方法,以具有抑菌活性的指标菌的基因组学DNA 为模版,以BOX:5′-CTACGGCAAGGCGACGCTGACG-3′为引物,使用Taq 酶试剂,建立20 μL 扩增体系进行扩增。PCR扩增产物在1.5%琼脂糖凝胶下电泳并在UV 灯下观察电泳结果。
1.4.6 溶血性试验 参照Nayak 等[13]的方法对具有抑菌活性的指标菌进行溶血性分析。将指标菌在兔血清平板上划线,以蜡样芽孢杆菌为对照,30℃下培养24 h 后观察。
1.4.7 对抗生素的耐受性测定 参考Nallala 等[14]的方法,采用琼脂扩散法对有抑菌活性的指标菌的耐药性进行测定。
1.4.8 糖代谢能力的测定 参考迟海等[10]的方法对指标菌的糖代谢能力进行测定。
1.4.9 对胆盐耐受能力的测定 将不同质量分数的牛胆盐(0,0.2%,0.4%,0.6%,0.8%和1.0%)加入BHI 液体培养基中后灭菌,指标菌按4%的接种量接种于BHI 液体培养基中,30 ℃有氧条件下过夜培养后测定OD600nm。参考贾丽艳等[15]的方法判断具有抑菌活性的指标菌的胆盐耐受能力。
1.4.10 对模拟胃肠液耐受能力的测定 参考刘海天等[16]的方法对筛选的指标菌进行模拟胃肠液耐受能力的测定。将指标菌接种于BHI 液体培养基中,30 ℃培养过夜后于3 500 r/min 条件下离心15 min,收集菌体,用无菌生理盐水洗涤两次,彻底除去培养基后保存备用。取50 mL pH 值为2.5,3.0,3.5 的无菌生理盐水(含1%的胃蛋白酶)模拟人工胃液。取100 mL 0.68%的无菌KH2PO4溶液(含1%胰蛋白酶)模拟人工肠液。将制备好的细菌用人工胃肠液重悬,37 ℃培养,每隔1 h 测其培养液OD600nm值。
1.4.11 抑菌性质鉴别 用70%饱和硫酸铵沉淀对有抑菌活性的指标菌的细菌素进行粗提。参考Chi 等[11]的方法,用96 孔板微量稀释法,测定细菌素粗提物对单增李斯特菌的抑菌性质,并绘制OD600nm-t的生长曲线。
1.4.12 细菌的自聚集和共聚集性分析 参考
1.4.10 节的方法收集具有抑菌活性的指标菌、单增李斯特菌、大肠埃希氏菌,用磷酸缓冲液(PBS,pH 6.8)重悬,使细菌浓度为108CFU/mL。参照孙群等[17]和Reuben 等[18]的方法评价具有抑菌活性的指标菌的自聚集性和共聚集性。
1.4.13 β-半乳糖苷酶活性测定 采用β-半乳糖苷酶活性检测试剂盒进行活性测定,β-半乳糖苷酶的活力用U/104细胞表示。
1.4.14 数据分析 使用Excel 软件对试验数据进行分析并通过Origin 2018 作图。PCR 扩增产物鉴定后所得序列在NCBI 中的BLAST 检索系统数据库中进行比对确定。
2 结果与分析
2.1 产细菌素乳酸菌的筛选
乳酸菌具有革兰氏染色阳性、过氧化氢酶反应阴性、产酸的特点。从羊奶中共筛选出46 株符合上述特征的乳酸菌,并将全部的乳酸菌作为指标菌,筛选可以抑制单增李斯特菌、金黄色葡萄球菌、蜡样芽孢杆菌的乳酸菌,发现3 株潜在产细菌素的乳酸菌(命名为DH9003、DH9011、DH9012)可以抑制上述食源性致病菌。
2.2 乳酸菌的抑菌稳定性测定
由于乳酸菌具有产有机酸、细菌素等抑菌物质的特性。细菌素具有热稳定性强,易被蛋白酶分解的性质,根据这一特性可对指示菌的抑菌物质进行验证。表1 是在分别经过热和酶处理后的细菌素的抑菌稳定性。结果显示,经热处理后的细菌素都保留抑菌活性。然而,蛋白酶处理后的细菌素抑菌活性丧失。这一结果验证了筛选的3 株乳酸菌产的抑菌物质具有细菌素的基本特性。
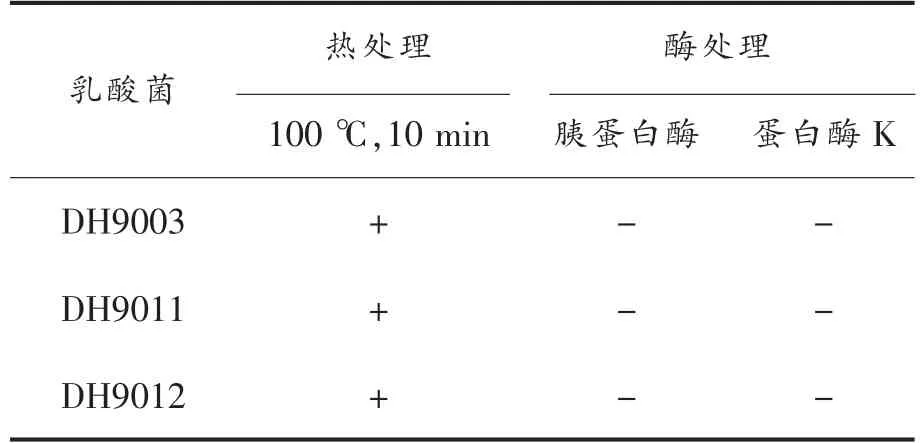
表1 不同处理后乳酸菌细菌素的抑菌稳定性情况Table 1 Antibacterial stability of bacteriocins produced by LAB via different treatments
2.3 产细菌素的乳酸菌的鉴定结果
通过与数据库进行同源性比对,发现乳酸菌DH9003 为粪肠球菌(Enterococcus faecalis),乳酸菌DH9011 为乳酸乳球菌(L.lactis),乳酸菌DH9012 为粪肠球菌,且上述乳酸菌鉴定结果与数据库比对相似度都达到99%以上。
2.4 产细菌素乳酸菌基因组重复序列差异分析
为了确定同一种属的细菌基因型是否一致,本试验通过利用特殊引物即BOX 对筛选出的乳酸菌的DNA 进行基因组重复序列PCR 扩增,确定其相应的基因图谱,以便进行进一步区分。图1为3 株产细菌素的乳酸菌的rep-PCR 电泳图。结果显示,2 株粪肠球菌PCR 扩增产物不同,且与乳酸乳球菌PCR 扩增产物存在较大差异,这说明3株乳酸菌的基因同源性较低。
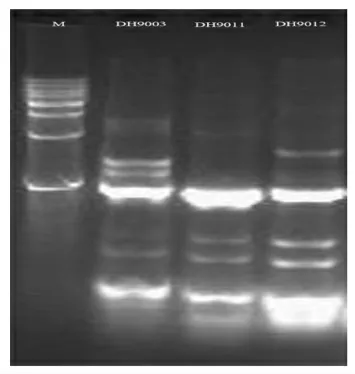
图1 3 株产细菌素乳酸菌rep-PCR 扩增产物电泳图Fig.1 Electrophoretic map of rep-PCR products of three bacteriocin producing lactic acid bacteria
2.5 产细菌素乳酸菌的抑菌性质
图2 分别是DH9003、DH9011、DH9012 对单增李斯特菌的抑菌生长曲线。结果显示,3 株乳酸菌细菌素的添加量为MIC50、4MIC50时,都能对单增李斯特菌产生一定程度的抑制作用,然而随着时间的延长,单增李斯特菌重新生长。这说明低质量浓度(MIC50和4MIC50)细菌素可以阻止单增李斯特菌生长。当乳酸菌DH9003 和DH9012 细菌素的质量浓度达到16MIC50时单增李斯特菌不生长,这说明高质量浓度条件下DH9003 和DH9012 产生的细菌素可以对单增李斯特菌完全抑制。

图2 不同质量浓度的3 株乳酸菌细菌素对单增李斯特菌的抑菌生长曲线Fig.2 Bacteriostatic growth curve of bacteriocin produced by three lactic acid bacteria on L.monocytogens at different mass concentrations
2.6 产细菌素乳酸菌的益生特性分析
3 株产细菌素乳酸菌的糖代谢能力如表2所示。同其它乳酸菌的糖代谢能力相似,3 株乳酸菌可以代谢葡萄糖等碳水化合物。然而,DH9003 对D-木糖、山梨醇、苦杏仁苷、淀粉、D-塔格糖、葡萄糖酸盐的代谢能力不显著,DH9011对L-阿拉伯糖、山梨醇、α-甲基-D-甘露糖苷、蜜二糖、D-塔格糖、葡萄糖酸盐的代谢能力不显著,DH9012 对D-木糖、α-甲基-D-甘露糖苷、苦杏仁苷、蜜二糖、海藻糖、淀粉代谢不显著。糖代谢试验结果表明3 株产细菌素乳酸菌糖代谢能力不同,同源性较低。

表2 3 株乳酸菌糖代谢能力比较Table 2 Comparisons on glucose metabolism of bacteriocin produced by three lactic acid bacteria
益生菌在肠道发挥益生作用,需经受住胃、小肠液对它的破坏才能在肠道中存活和增殖。同时,十二指肠中的胆汁酸盐对外源细菌有抑制作用,菌体只有具备较高的胆盐耐受性才能保持足够的活菌数,从而发挥益生作用[19]。由表3 可知,3株乳酸菌在胆盐环境下都能保持大量活菌,因此认为3 株乳酸菌均能适应肠道胆盐环境。另外,乳酸菌在动物胃肠道中存活和增殖的另一个瓶颈是胃液的低酸、胃蛋白酶以及肠液的胰蛋白酶对菌体的破坏作用[20]。试验结果表明3 株乳酸菌均能保持存活,说明3 株乳酸菌可以耐受肠道和不同pH 值条件(2.5,3.0 和3.5)下的胃液环境。

表3 产细菌素乳酸菌的益生菌特性研究Table 3 Probiotic properties of bacteriocin produced by lactic acid bacteria
自聚集与共聚集是益生菌的重要性质,它反应了在肠道上皮细胞上形成生物膜的能力,且益生菌和肠道病原菌的结合有助于抗菌物质对病原菌的杀灭[21]。试验结果表明3 株乳酸菌有较好的自聚集性,范围集中在30%~55%。在单增李斯特菌和大肠杆菌的共聚集性试验中,粪肠球菌DH9003和DH9012 相对较高,分别为52.6%,63.2%和68.5%,57.6%,而乳酸菌DH9011 与单增李斯特菌的共聚集性为15.6%,与大肠杆菌不聚集,说明粪肠球菌DH9003 和DH9012 可能有较好的黏附潜力。
乳糖不耐症是由于十二指肠内膜缺乏β-半乳糖苷酶所致,3 株产细菌素乳酸菌都具有β-半乳糖苷酶活性,这有助于缓解乳糖不耐症的现象。同时这3 株乳酸菌都无溶血性(γ 溶血),对人体安全。最后,在对抗生素耐受性的测定中发现,3株乳酸菌都对氨苄青霉素(50 mg/mL)和硫酸链霉素(100 mg/mL)敏感,对氯霉素(2.5 mg/mL)、萘啶酸(10 mg/100 mL)和呋喃妥因(10 mg/100 mL)不敏感。
FAO/WHO 标准认定的益生菌必须满足3 个基本特点:耐受胃肠黏膜的选择环境、黏附宿主的肠壁细胞、分泌物或者分解产物为抗菌物质[22]。本试验中从羊奶中分离的3 株乳酸菌产生可以抑制常见的食源性致病菌的细菌素,对胃肠道环境耐受,具有良好的黏附能力。同时,这3 株乳酸菌安全(无溶血性)、可控(无耐药性),具备益生菌的潜在特质。
3 结论
本研究通过对羊奶中提取的46 株乳酸菌进行抑菌试验分析,获得3 株可以同时抑制单增李斯特菌、金黄色葡萄球菌和蜡样芽胞杆菌的乳酸菌。经过16S rDNA 分子鉴定,这3 株乳酸菌分别鉴定为粪肠球菌(DH9003 和DH9012)和乳酸乳球菌(DH9011)。rep-PCR 和糖代谢能力分析结果表明,3 株乳酸菌在基因型和表现型上存在一定差异。此外,这3 株乳酸菌所产细菌素在低质量浓度(MIC50、4MIC50)条件下可以阻止单增李斯特菌生长,且DH9003 和DH9012 产生的细菌素在高质量浓度条件下(16MIC50)对单增李斯特菌有完全抑制作用。重要的是,这3 株细菌素乳酸菌具有安全(无溶血性)、可控【对氨苄青霉素(50 mg/mL)和硫酸链霉素(100 mg/mL)敏感】的特点。同时,3株乳酸菌能适应胆盐、模拟肠道和不同胃液条件(pH 分别为2.5,3.0,3.5)的环境,具有较好的自聚集性,自聚范围集中在30%~55%,DH9003 和DH9012 与单增李斯特菌和大肠埃希氏菌有较好的共聚集性,范围集中在50%~70%,而DH9011与单增李斯特菌共聚集性差(15.6%),与大肠埃希氏菌不聚集。最后,3 株乳酸菌还具有较高的β-半乳糖苷酶活力。试验结果发现,3 株乳酸菌具有较强抑菌能力,且具备良好的模拟胃肠液耐受性和黏附肠道的能力,符合益生菌的潜在特征,为进一步开发益生菌资源和后期益生菌的体内试验提供了理论基础。
