刺激因子对桦褐孔菌胞外多糖体外降血糖活性的影响
2021-12-17赵喆禛王梦雅张嘉铭
赵喆禛,王梦雅,薛 娇,张嘉铭,刘 萍
(中国农业大学食品科学与营养工程学院 北京100083)
桦褐孔菌(Inonotus obliquus)是一种珍稀的药用真菌,属担子菌亚门、层菌纲、多孔菌目[1]。桦褐孔菌多糖是桦褐孔菌中的主要化学物质,具有抗氧化、抗肿瘤及免疫调节等活性功能,在糖尿病防治方面受到越来越多关注[2-7]。
由于野生桦褐孔菌子实体在自然生长状态下要经10~15年才能具有药用价值,资源非常有限,无法满足人们日益增长的需求,因此解决桦褐孔菌资源短缺问题迫在眉睫。液体深层发酵法培养桦褐孔菌具有周期短、产量高、价格低的优势,被广泛使用。目前,对液体深层培养的研究大多集中在如何提高代谢产物产量上,对于如何提高其活性的研究不多,而液体发酵桦褐孔菌产生的代谢产物活性与天然生长子实体中的相比还存在一定差距。近年研究表明,添加刺激因子能改变次生代谢途径中催化酶的活性,从而达到提高次级代谢产物产量和活性的目的[8-9]。桦褐孔菌通过寄生在桦树皮上进行自身生长繁殖,桦树皮中含有多种营养成分,能够确保桦褐孔菌生长及合成生物活性物质。采用高效液相色谱方法研究桦树汁液的营养物质,发现白桦液中含有近70 种化合物,主要包括各种维生素、氨基酸、脂肪酸和矿物质元素等[10]。Wang 等[11]研究发现添加桦树皮水提取物(0.01 g/L)能够刺激液体深层培养的桦褐孔菌菌丝体生长,且其产生的类固醇产量达(225.5±8.7)mg/L,比对照组高97.0%,说明白桦树皮的提取物可作为桦褐孔菌类固醇生物合成的诱导剂。
II 型糖尿病(Type 2 diabetes mellitus,T2DM)又称非胰岛素依赖型糖尿病,其重要发病机制之一为胰岛素抵抗(Insulin resisitance,IR)[12-13]。HepG2 细胞被广泛用作胰岛素抵抗发病机制和糖尿病治疗药物作用机制的体外研究细胞模型[14]。本试验通过探究不同刺激因子(桦树浸提汁、VB1、VB6和白桦脂醇)作用下桦褐孔菌液体深层发酵产生的胞外多糖对HepG2 细胞及胰岛素抵抗HepG2 细胞(IR-HepG2)葡萄糖消耗量的影响,确定导致桦褐孔菌液体深层发酵与子实体多糖降血糖活性差异的主要刺激因子,为桦褐孔菌降血糖保健食品的研发提供理论依据。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 材料 桦褐孔菌菌种购于四川省绵阳市食用菌研究所,HepG2 肝癌细胞株购于北京博奥森生物公司。
1.1.2 试剂 DMEM 培养基、胰蛋白酶消化液,北京科奥试剂有限公司;四甲基偶氮唑蓝(MTT)、胰岛素,美国Sigma 公司;胎牛血清(FBS),杭州四季青生物工程材料有限公司;二甲基亚砜(DMSO),天津市富宇精细化工有限公司;葡萄糖测定试剂盒,南京建成生物科技股份有限公司;盐酸二甲双胍(Met),北京中惠药业有限公司。
1.1.3 仪器 SW-CJ-2D 超净工作台、YCP-50 CO2 培养箱,北京三木科技仪器有限公司;M200 pro 多功能酶标仪,购自Tecan 集团奥地利有限公司。
1.2 试验方法
1.2.1 液体深层发酵 将桦褐孔菌接种到马铃薯斜面培养基(PDA)上,于28 ℃下培养7~9 d。在4℃条件下保存获得的斜面纯培养菌丝体,每3 个月传代一次。种子培养基由葡萄糖(20 g/L),胰蛋白胨(4 g/L),KH2PO4(1 g/L)和MgSO4(1 g/L)组成。将斜面纯培养菌丝体接种到含100 mL 种子培养基的250 mL 一级摇瓶中,并在28 ℃、150 r/min 条件下振荡培养7 d。将种子液接种到含100 mL 发酵培养基的250 mL 摇瓶中于28 ℃、150 r/min 条件下培养13 d。在种子培养基中分别依次添加4 μg/mL VB1、4 μg/mL VB6、2 μg/mL 白桦脂醇和40%桦树浸提汁(称取一定量桦木屑,常温水提8~12 h,抽滤去掉桦木屑渣得到)作为发酵培养基,并设不添加任何刺激因子组。在第13 天收集各种培养条件下的桦褐孔菌培养液,发酵液用旋转蒸发仪浓缩后加入4 倍体积的乙醇醇沉过夜后得到多糖。
1.2.2 桦褐孔菌胞外多糖对HepG2 细胞影响的测定
1.2.2.1 不同刺激因子发酵产生的胞外多糖对HepG2 细胞增殖影响的测定 冻存的HepG2 细胞经复苏后,培养于DMEM 培养基中(含10%FBS),于5% CO2、37 ℃培养箱中孵育,每3 d 传代一次。培养至对数生长期,用胰蛋白酶进行消化,加新鲜培养液吹打制成密度为1×105细胞/mL 的单细胞悬液,按100 μL/孔接种于96 孔板,置于5% CO2、37 ℃细胞培养箱中培养。细胞贴壁后,吸弃旧培养基,5 种多糖分别按照终质量浓度为20、40、80、120、160、320 μg/mL 添加,并设置空白对照组,于5% CO2、37 ℃培养箱中培养24 h 和48 h后,每孔加入20 μL MTT(5 mg/mL),再于培养箱中孵化4 h,弃去旧培养基,加入150 μL DMSO 终止反应。待结晶物充分溶解后,用酶标仪在波长490 nm 处测定吸光度,计算增殖率[15]。
1.2.2.2 不同刺激因子发酵产生的胞外多糖对正常HepG2 细胞葡萄糖消耗影响的测定 参照文献[16]的方法进行测定,以加入终质量浓度为20,40,80,160 μg/mL 的多糖样品组为试验组,并设置空白对照组以及Met 组(终浓度1×10-3mmol/L)和胰岛素组(终浓度1×10-8mmol/L)两组阳性对照,分别孵育24 h 和48 h 后,按试剂盒说明书检测葡萄糖含量。细胞葡萄糖消耗量(△GC)为空白组葡萄糖含量减试验组葡萄糖含量[17]。每孔加入5 mg/mL MTT 溶液20 μL,孵育4 h 后再加入150 μL DMSO,用酶标仪在波长570 nm 处测定吸光值,结果以△GC/MTT 表示,以去除因活细胞数量改变而引起的误差。
1.2.2.3 HepG2 细胞胰岛素抵抗模型的建立 采用高糖高胰岛素法建立胰岛素抵抗模型[18]。用胰蛋白酶消化HepG2 细胞后,加入新鲜DMEM 培养液吹打制成细胞密度为2×105细胞/mL 的单细胞悬液,接种于96 孔培养板中,待细胞贴壁后,更换为含胰岛素的培养液培养24 h,通过葡萄糖消耗测定判断胰岛素抵抗细胞模型是否建立成功。
1.2.2.4 不同刺激因子发酵产生的胞外多糖对胰岛素抵抗(IR)-HepG2 细胞葡萄糖消耗影响的测定 参考文献[19]的方法,将细胞以2×105细胞/mL 的密度接种于96 孔板,以含诱导浓度(10-6mmol/L)胰岛素的培养液诱导培养24 h。以加入不同质量浓度的多糖组为试验组,并设置空白对照组、阳性对照组(二甲双胍组)、阴性对照组(IR 模型组),在处理24 h 和48 h 后,同1.2.2.2 节处理,结果以△GC/MTT 表示。
1.2.3 统计学处理 计算结果用平均值±标准差(±s)表示,采用Excel、SPSS 22.0 统计分析软件进行分析,并用ANOVA 方差分析进行多组间比较。
2 结果与讨论
2.1 不同刺激因子发酵生产的胞外多糖对HepG2 细胞增殖的影响
由表1 可以看出,细胞培养24 h 后,随着多糖质量浓度的增加,细胞存活率逐渐下降。与对照组相比,无刺激因子组、桦树浸提汁组、VB1组、VB6组以及白桦脂醇组发酵多糖,在低(20~40 μg/mL)、中质量浓度(80~160 μg/mL)时对HepG2细胞增殖无显著影响,细胞死亡率小于6%,表明其对细胞没有毒性。当质量浓度为320 μg/mL 时,细胞死亡率绝大多数大于6%,但均低于10%,说明多糖质量浓度越高,对细胞增殖的影响越大。

表1 不同刺激因子发酵产生的胞外多糖对HepG2 细胞增殖的影响Table 1 Effect of extracellular polysaccharides produced by different stimulating factors on the proliferation of HepG2 cells
细胞培养48 h 后,除白桦脂醇组外,细胞死亡率均低于10%,说明多糖对HepG2 细胞毒性较小。白桦脂醇组细胞死亡率大于10%,且当多糖质量浓度达到320 μg/mL 时,细胞存活率下降显著(P<0.01),说明过高质量浓度的多糖对细胞具有一定的毒性影响。
综上,添加刺激因子发酵产生的胞外多糖与不添加刺激因子产生的胞外多糖对HepG2 细胞的增殖影响效果相近。当多糖质量浓度为20~160 μg/mL 时,对细胞存活率无显著影响,培养24 h 后,与阳性对照组(二甲双胍组和胰岛素组)无显著差异,因此,选择20,40,80,160 μg/mL 为安全范围进行进一步研究。
2.2 不同刺激因子发酵产生的胞外多糖对HepG2 细胞葡萄糖消耗的影响
由表2 可知,与空白对照组相比,阳性对照组(10-8mmol/L 胰岛素组、10-3mmol/L 二甲双胍组)葡萄糖消耗量显著提高。无刺激因子组发酵产生的多糖,仅在质量浓度为80 μg/mL 时显著促进HepG2 细胞葡萄糖消耗率(与对照组相比,P<0.01),培养24 h 和48 h 后分别提高了80.46%和40.80%。
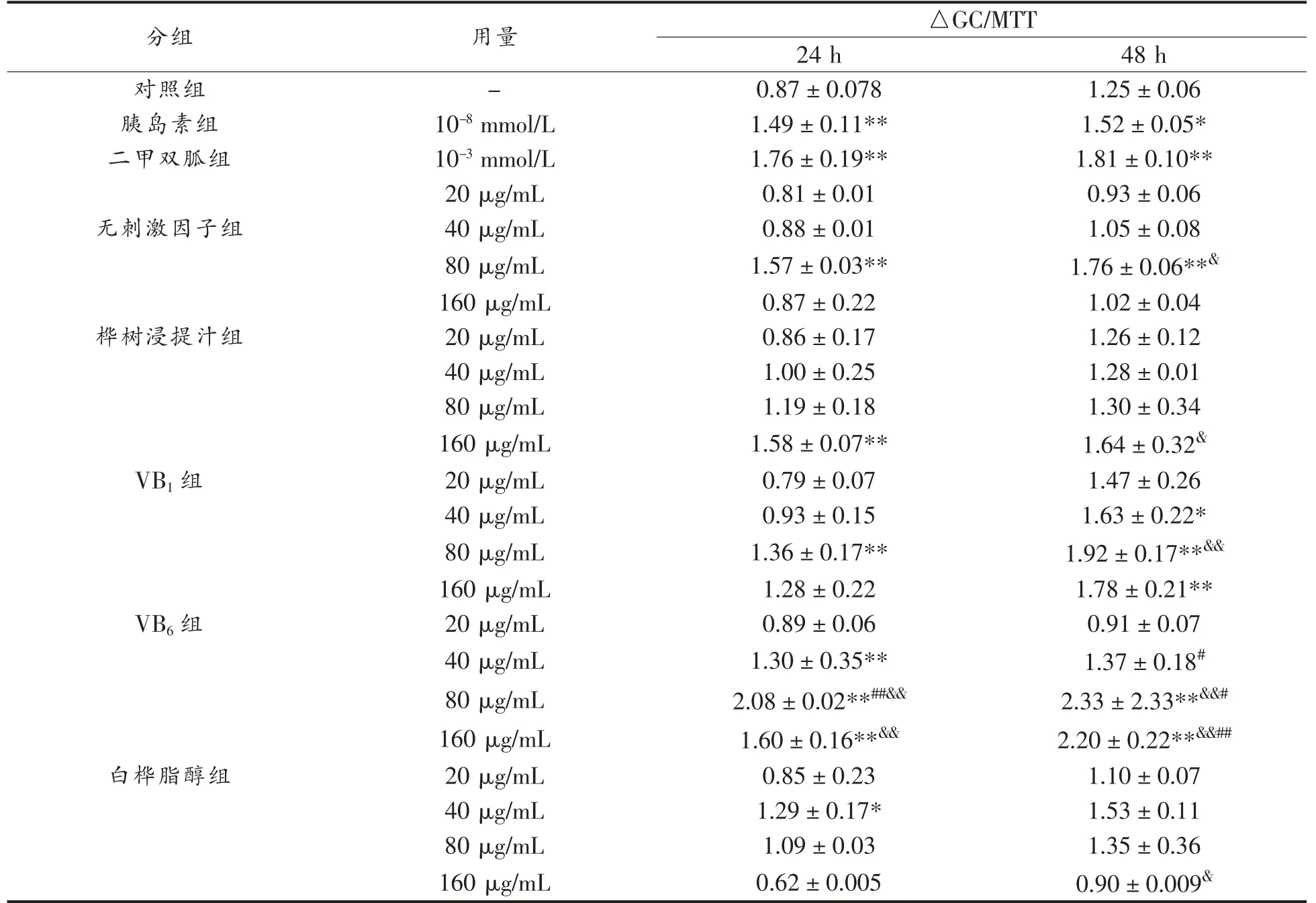
表2 不同刺激因子发酵多糖对HepG2 细胞葡萄糖消耗的影响Table 2 Effect of fermented polysaccharides with different stimulating factors on glucose consumption in HepG2 cells
桦树浸提汁发酵组随着多糖质量浓度的增加,HepG2 细胞葡萄糖消耗率呈现逐渐上升的趋势,培养24 h 和48 h 后,与对照组相比,40~160 μg/mL 胞外多糖均能促进细胞葡萄糖摄取,其中葡萄糖摄取率最高处理组为160 μg/mL 样品组,培养24 h 和48 h 后,摄取率分别提高81.61%和31.20%,分别显著高于对照组(P<0.01)和胰岛素组(P<0.05),但较二甲双胍组的效果差。
使用VB1发酵产生的胞外多糖培养细胞24 h 后,低质量浓度(20~40 μg/mL)时葡萄糖消耗量与对照组相比无显著差异(P>0.05),而80 μg/mL时可显著提高HepG2 细胞的葡萄糖消耗量,葡萄糖消耗率比对照组提高了56.32%;培养48 h 后,20~160 μg/mL 的多糖均能够促进HepG2 细胞的葡萄糖消耗,其中80 μg/mL 处理组的葡萄糖摄取率较对照组提高了53.60%,差异具有显著性(P<0.01),且高于相同试验条件下胰岛素的效果(P<0.01)[20]。此外,80 μg/mL 多糖培养细胞48 h 后,HepG2 细胞的葡萄糖消耗量高于无刺激因子组。
VB6发酵组随着多糖质量浓度的增加,葡萄糖的消耗率呈现先上升后下降的趋势,与对照组相比,低质量浓度组样品组(40 μg/mL)和中质量浓度组(80~160 μg/mL)的胞外粗多糖均能促进细胞对葡萄糖摄取,其中80 μg/mL 样品组培养24 h和48 h 后的葡萄糖摄取率最高,比对照组分别提高了139.08%,86.40%,比无刺激因子组分别提高了32.48%,32.39%,且显著高于胰岛素组和二甲双胍组[21]。
添加白桦脂醇发酵产生的胞外多糖,与对照组相比,40 μg/mL 和80 μg/mL 的胞外粗多糖均能促进葡萄糖摄取,葡萄糖摄取率最高的处理组为40 μg/mL 样品组,培养24 h 和48 h 后对HepG2细胞的摄取率较对照组分别提高了48.28%和22.40%,然而160 μg/mL 处理下的细胞葡萄糖摄取率较对照组低,可能与细胞存活率有关。此外有研究发现,将白桦脂醇添加到桦褐孔菌发酵培养基中能显著提高三萜类、类固醇类代谢产物产量,这也说明白桦脂醇可作为桦褐孔菌液体发酵的刺激因子[19]。
综上,在细胞培养24 h 和48 h 后,添加不同刺激因子发酵产生的多糖均能在一定质量浓度范围内促进HepG2 细胞的葡萄糖消耗,但不同刺激因子影响体外降血糖活性效果不一致,推测可能是由于不同刺激因子产生的多糖种类和单糖组成等不同,导致其体外降血糖活性不同[22]。160 μg/mL桦树浸提汁组、80 μg/mL VB1组和VB6组、40 μg/mL 白桦脂醇组多糖均能显著提高HepG2 细胞24 h 的葡萄糖消耗量,且VB6的促进效果最好。其原因可能是维生素常以辅酶或辅基的形式参与生物催化剂-酶系的活动,能够促进甲基的形成和转移,促进细胞周围组织的碳水化合物代谢,参与蛋白质及脂肪代谢等重要生命活动,故在液体深层发酵培养中常加入VB1、VB6、VB12等作为生长因子刺激菌丝体生长以及代谢产物的生成[23-25]。
2.3 不同刺激因子发酵产生的胞外多糖对IRHepG2 细胞葡萄糖消耗的影响
根据表3 结果显示,IR 组的葡萄糖消耗量与对照组相比显著降低,说明模型建立成功,且阳性对照二甲双胍组(10-3mmol/L)能够促进HepG2 细胞对葡萄糖的摄取。无刺激因子组胞外多糖细胞培养24 h 后,40~160 μg/mL 的样品组均能提高IR-HepG2 细胞的葡萄糖消耗量,然而当继续培养细胞48 h 后,其促进IR-HepG2 细胞葡萄糖消耗的效果下降,与IR 组无显著差异,且低于空白对照组。
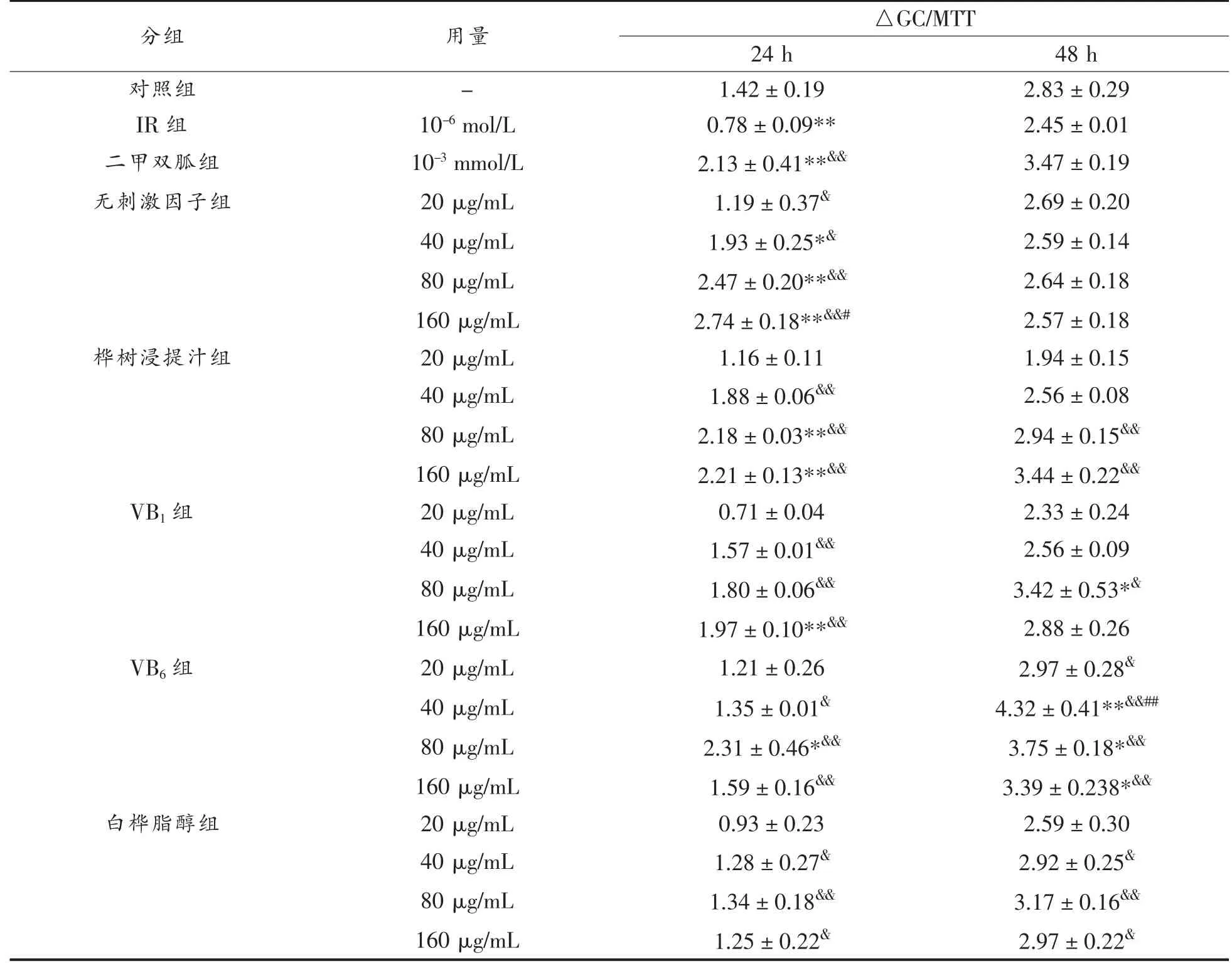
表3 不同刺激因子发酵多糖对IR-HepG2 细胞葡萄糖消耗的影响Table 3 Effect of fermented polysaccharides with different stimulating factors on glucose consumption in IR-HepG2 cells
使用桦树浸提汁组产生的胞外多糖培养细胞24 h 后,与IR 组相比,20~160 μg/mL 的胞外多糖均能促进IR-HepG2 细胞葡萄糖的摄取,其中160 μg/mL 样品组的葡萄糖摄取率最高,较IR 组提高183.33%;培养48 h 后,40~160 μg/mL 的胞外多糖均能促进葡萄糖消耗,其中160 μg/mL 样品组的葡萄糖摄取率最高,较对照组提高21.55%,较IR组提高40.41%(P<0.01),但较相同试验条件下二甲双胍的促进效果差。
使用VB1组产生的胞外多糖培养细胞24 h后,样品组在40~160 μg/mL 时能提高葡萄糖摄取率,且在160 μg/mL 时促进效果最好,较IR 组提高152.56%(P<0.01);培养48 h 后,样品组在40~160 μg/mL 范围能提高葡萄糖消耗率,其中当质量浓度为80 μg/mL 时,葡萄糖消耗量显著提高(P<0.05),较IR 组提高39.59%,较无刺激因子组提高29.55%。
添加VB6发酵产生的胞外多糖,与IR 组相比,20~160 μg/mL 多糖均能促进IR-HepG2 细胞的葡萄糖消耗,培养24 h 后,当质量浓度为80 μg/mL 时,葡萄糖消耗量显著升高(P<0.01),较IR组提高196.15%;培养48 h 后,当质量浓度为40 μg/mL 时,葡萄糖消耗量与IR 组相比提高76.33%,与无刺激因子组相比提高66.80%,且显著高于相同试验条件下二甲双胍组的葡萄糖消耗量(P<0.01)。
添加白桦脂醇发酵产生的胞外多糖在20~160 μg/mL 范围均能促进IR-HepG2 细胞的葡萄糖消耗量。其中多糖质量浓度为80 μg/mL 时(细胞培养24 h),葡萄糖消耗量较IR 组显著提高(P<0.01),但略低于对照组;培养48 h 后,其葡萄糖消耗量较IR 组显著提高(P<0.01),且高于对照组,较无刺激因子组提高20.08%。
综上,在细胞培养24 h 和48 h 后,添加不同刺激因子发酵产生的胞外多糖均对IR-HepG2 细胞的葡萄糖消耗具有促进作用,但促进效果不一致,与IR 组相比,160 μg/mL 桦树浸提汁组、40 μg/mL VB6组、80 μg/mL VB1组和白桦脂醇组发酵多糖均能显著提高胰岛素抵抗HepG2 细胞48 h 的葡萄糖消耗量,且效果均好于无刺激因子组,其中VB6组的促进效果最为显著。
3 结论
在液体深层发酵培养基中添加桦树浸提汁后,产生的桦褐孔菌能够促进桦褐孔菌液体深层发酵产多糖培养的正常及胰岛素抵抗HepG2 细胞葡萄糖的消耗量,证明桦树中确实含有促进桦褐孔菌子实体产生活性多糖的刺激因子,且桦树浸提汁中的白桦脂醇、VB1和VB6均能在一定质量浓度范围内对多糖的降血糖活性起到不同程度的促进作用,其中VB6的促进效果最显著,可能是由于添加不同刺激因子产生的发酵胞外多糖种类和其单糖组成不同所致。后续可深入研究不同刺激因子对于桦褐孔菌活性多糖生成的调节机理,或对其纯化多糖的构效关系进一步讨论,以期为调控桦褐孔菌高降血糖活性多糖的产生提供新的思路和理论基础。
