果蔬多糖的免疫调节作用及其机制
2021-12-17张名位张瑞芬
张名位,黄 菲,张瑞芬
(广东省农业科学院蚕业与农产品加工研究所 农业农村部功能食品重点实验室广东省农产品加工重点实验室 广州510610)
水果、蔬菜是人类饮食的重要组成部分,大量的流行病学和干预试验显示二者的摄入量与改善人体健康和降低慢性疾病风险呈正相关。水果、蔬菜的健康效应与其含有丰富的膳食纤维等多糖密不可分。果蔬中的多糖具有免疫调节、抗肿瘤、抗氧化、抗炎等多种生物活性,其中免疫调节作用被认为是果蔬多糖最主要的生理功效。本文综述近年来果蔬来源多糖的结构,对免疫系统的调节作用的最新研究进展。
1 果蔬多糖的结构
果蔬多糖的结构包括一级结构和高级结构,其中一级结构包括多糖的分子质量、单糖组成、糖链连接方式、糖链构型、枝化结构等。常采用气相色谱(GC)、高效液相色谱(HPLC)、高效阴离子色谱(HPAEC)、薄层色谱(TLC)等方法分析多糖的单糖组成;采用高效体积排阻色谱(HPSEC)和高效凝胶渗透色谱(HPGPC)检测多糖的分子质量;采用红外光谱(FT-IR)分析多糖的糖苷键和功能团;采用甲基化、高碘酸氧化、Smith 降解、质谱和核磁共振(NMR)分析糖苷键类型、异头异构形式、糖苷键连接位点、不同残基的连接顺序等[1]。多糖的高级结构包括分子尺寸、空间构象、凝聚态特征和溶液行为等。常采用分子排阻色谱-激光光散射(SEC-MALLS)、结合黏度法明确多糖在溶液中的构象;采用原子力显微镜观察多糖分子链的尺寸、构象和聚集态结构等微观形貌;采用刚果红试验、圆二色谱和X-射线衍射明确多糖的螺旋结构[2]。
果蔬多糖的结构与其原料来源以及分离纯化技术等密切相关。不同来源果蔬多糖的一级结构存在较大差异,见表1。苹果、柑橘、红枣、秋葵、苦瓜等来源的果蔬多糖富含(1→4)-α-GalpA、(1→2)-α-Rhap糖链结构,是典型的果胶类结构;龙眼、荔枝等来源的果蔬多糖主要含有(1→3,5)-Araf、(1→3,6)-β-Galp、(1→4/6)-β-Glcp、(1→3,4)-α-Rhap等糖链结构;山药、莲藕、紫薯等来源的果蔬多糖主要含有葡萄糖,由(1→4)-α-Glcp组成,含有少量的Man、Gal。此外,来源相同而采用不同纯化手段获得的果蔬多糖的一级结构也存在较大差异。从南瓜中分离得到2 个多糖组分,其中中性糖组分为由(1→3)-Glcp主链和(1→3,4)-Glcp支链组成的葡聚糖,酸性糖组分则为含有(1→3)-Galp、(1→6)-Glcp、(1→3,6)-Glcp和(1→4)-Glcp的杂多糖[3]。

表1 常见果蔬多糖的结构特征Table 1 Structural characteristics of common fruit and vegetable polysaccharides
不同来源果蔬多糖的高级结构存在较大差异。柑橘水溶性果胶多糖在溶液中为半柔顺链状[4],绿茶多糖为超支化结构的球形构象[5]。相同来源、采用不同纯化手段获得的果蔬多糖的高级结构也存在较大差异。从百香果果皮提取的果胶多糖在溶液中呈现半柔性线圈结构,具有不同分子质量的果胶组分的柔顺程度存在差异,分子质量小的果胶组分柔性差,表现出更刚性的形态[6]。不同龙眼多糖组分(LP I~IV)的高级结构存在较大差异,其中LP I 既有球形构象又有三螺旋结构,而LP II~IV 以柔性链的形式存在[7]。同样的,不同荔枝多糖组分(LP 1~3)具有不同的溶液行为,LP 1 具有超支化结构的球形构象,LP 2 呈现半柔性链,而LP 3 在溶液中交联形成网络状构象[8]。

(续表1)
2 果蔬多糖的免疫调节作用及构效关系
果蔬多糖作为免疫刺激剂可以刺激一种或多种免疫应答,如刺激固有免疫中巨噬细胞、自然杀伤细胞等细胞的吞噬活性,巨噬细胞分泌一氧化氮(NO)、细胞因子,活化补体途径等发挥免疫调节作用;也可通过增强获得性免疫中T/B 细胞的功能,促进抗体分泌和细胞因子分泌等发挥免疫调节作用。
2.1 巨噬细胞
巨噬细胞是固有免疫中重要的吞噬细胞,其功能活性也会影响适应性免疫。果蔬多糖可通过改变巨噬细胞的形态,如使其体积增大、伪足变多等激活巨噬细胞[22],增强巨噬细胞的吞噬作用[23],刺激巨噬细胞分泌NO[24]以及肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β)等促炎细胞因子,白介素10(IL-10)、白介素4(IL-4)等抗炎细胞因子[25],趋化因子2(CCL2)、趋化因子10(CXCL10)等趋化因子[23]。
2.2 T/B 淋巴细胞
T/B 淋巴细胞是机体重要的免疫细胞,T 淋巴细胞(即T 细胞)主要通过分泌细胞因子、杀灭靶细胞等介导细胞免疫,B 淋巴细胞(即B 细胞)通过产生免疫球蛋白抗体介导体液免疫。大部分果蔬多糖能刺激T/B 混合淋巴细胞增殖,其中少部分多糖对刀豆蛋白A(ConA)诱导的T 细胞无影响,只能促进脂多糖(LBS)诱导的B 细胞增殖[26]。果蔬多糖可提高辅助性T 细胞(CD4+T 细胞)含量及CD4+/CD8+比例,调节T 细胞亚群比例[27],促进淋巴细胞分泌白介素2(IL-2)、IL-4 等细胞因子,促进IgA、IgG、IgM 等抗体生成[28]。
2.3 树突状细胞/自然杀伤细胞
树突状细胞(DC 细胞)是机体重要的抗原提呈细胞,主要功能是对抗原进行摄取、加工、处理,将抗原信息提呈给T 细胞,启动抗原特异性T 细胞应答。果蔬多糖可诱导DC 细胞多核态和细长树突等结构变化,活化DC 细胞,促进其分泌IL-6、IL-1β 等细胞因子、趋化因子5(CCL5)、单核细胞趋化蛋白(MCP-1)等趋化因子[29]。
自然杀伤细胞(NK 细胞)也是免疫系统重要的组成部分,由骨髓造血干细胞发育而来,主要分布于外周血、脾脏和肝脏。NK 细胞主要通过识别和裂解肿瘤细胞、病毒或细菌感染的细胞等靶细胞发挥其免疫调节功能。一些果蔬多糖能显著促进NK 细胞的杀伤活性,如荔枝多糖[30]、龙眼多糖[31]、人参果多糖[27]等。
2.4 补体系统
补体是一类存在于血清、组织液、细胞膜表面的可介导免疫和炎症反应的蛋白质,包括30 多种可溶性蛋白和膜结合蛋白。补体可通过经典途径、旁路途径和凝集素途径这3 条既独立又交叉的途径被激活。补体活化过程及其活化的产物可介导细胞破溶,调节吞噬、炎症反应,消除病原微生物等重要的生物反应,也参与特异性或非特异性免疫免疫反应[32]。果蔬多糖通过调节补体系统发挥免疫调节作用。如红枣多糖可通过经典途径和替代途径调节补体活性[33],魔芋葡甘露聚糖及其衍生物亦可以调节机体的补体活性[34]。
2.5 果蔬多糖免疫调节的构效关系
果蔬多糖的分子质量、单糖组成、糖链结构(支链结构)、空间结构等均对其免疫调节活性有影响。果蔬多糖一般存在不同分子质量的多个级分,各级分的免疫活性有所差异,不同多糖产生最佳免疫调节活性的分子质量范围不同。如低分子质量的莲叶多糖组分相比其它组分具有更好的免疫活性[35],而大分子质量的仙人掌多糖组分比小分子质量组分具有更好的免疫活性[36]。多糖分子链的单糖组成、糖基连接方式和支链特性等决定其是否能被免疫细胞受体识别而引发免疫应答。甜菜果胶多糖中具有线性结构的阿拉伯聚糖(LA)促进骨髓树突状细胞(BMDCs)产生的细胞因子含量高于含有支链的阿拉伯聚糖(BA),当将BA 的支链去掉后,其免疫调节活性显著增强[37];而接骨木果胶多糖的阿拉伯半乳聚糖支链是影响其免疫活性的关键结构单元,当去掉支链时,其对巨噬细胞的刺激显下降[38]。此外,不同果蔬多糖的高级构象对其免疫活性的影响不同。具有紧密球型结构的多糖因有较好的流动性而易与细胞结合;单股螺旋结构多糖则可能通过立体相互作用与细胞表面受体匹配,再经表面的多羟基与受体通过电荷相互作用或氢键结合,进而诱导细胞免疫应答。上述研究表明,多糖的结构与其免疫调节活性具有很强的关联性,然而两者之间并无规律可循。
3 果蔬多糖的免疫调节机制
目前关于果蔬多糖免疫调节机制的研究主要包括2 个方面:一是果蔬多糖通过受体识别模式直接作用于免疫细胞,激活相关信号通路,发挥免疫调节作用;二是多糖通过调节肠道菌群及其代谢产物发挥免疫调节作用。
3.1 果蔬多糖通过识别受体调节巨噬细胞/淋巴细胞发挥免疫调节作用
果蔬多糖由于分子质量大,难以直接穿过细胞膜,因此主要通过识别免疫细胞上的特异性受体发挥作用。巨噬细胞中常见的多糖识别受体有Toll 样受体2/4(TLR2/4)、甘露糖受体(MR)、清道夫受体(SR)、补体受体(CR3)、树突状细胞相关C型凝集素(Dectin-1)等。T/B 淋巴细胞中的受体包括TLR2/4、T 细胞受体(TCR)和B 细胞受体(BCR)等。多糖通过识别免疫细胞上的特异性受体,激活相关的信号通路,调控基因表达,影响蛋白合成,实现免疫应答。3.1.1 巨噬细胞免疫应答的信号通路 在巨噬细胞中,植物多糖的受体比较丰富,包括TLR2/4、MR、SR、CR3 等,涉及的信号通路包括丝裂原活化蛋白激酶(MAPK)、核因子κB(NF-κB)、磷脂酰肌醇3 激酶(PI3K)/丝氨酸/苏氨酸蛋白激酶(AKT)(PI3K-AKT)和Janus 激酶(Jak)/转录激活因子(STAT)(Jak-STAT)等途径。
1)TLR2/4 介导的信号通路 Toll 样受体(TLRs)是一类广泛存在于巨噬细胞、中性粒细胞和淋巴细胞中的蛋白识别受体,目前发现有13 种TLRs,然而,只有TLR2 和TLR4 能识别糖配体。果蔬多糖与TLR2/4 结合后通过骨髓分化因子88(MyD88)依赖性途径或TLR 相关干扰因子(TRIF)依赖性途径介导信号转导。MyD88 依赖性途径为:TLR2/4 与MyD88 结合后,与丝氨酸/苏氨酸激酶(IRAK)结合,进而激活TNF 受体相关因子(TRAF6),TRAF6 通过活化NF-κB 或MAPK 两种途径调节核内转录因子。TRIF 依赖性途径为:TRIF 通过TRIF 相关接头蛋白分子(TRAM)与TLR4 结合后,既可以激活TRAF6,进而活化NFκB 和MAPK 介导信号转导,也可以刺激干扰素调节因子3(IRF3)调节相应基因转录(如图1)。其中MAPK 信号转导途径为:当细胞受到刺激时,MAPK 被激活,移位至细胞核,磷酸化c-Myc、c-Jun、c-Fos等转录因子,调节下游靶基因表达[39]。NF-κB 信号转导途径为:当细胞受到刺激时,与NF-κB 结合的抑制蛋白IκB 被其激酶降解,NFκB 被释放并转移至细胞核,进而被核激酶磷酸化,与DNA 结合诱导相关基因转录[40]。许多果蔬多糖通过TLR2/4 受体及其介导的信号通路发挥免疫调节作用,如桑葚多糖通过TLR4 活化NFκB、MAPK 途径,诱导巨噬细胞分泌NO、TNF-α等细胞因子[41];紫薯多糖通过TLR2/4 介导MyD88依赖性和TRIF 依赖性途径,激活MAPK、NF-κB、活化剂蛋白-1(AP-1)等信号,调节巨噬细胞活性[22]。

图1 果蔬多糖活化巨噬细胞相关的信号通路Fig.1 Signal pathway related to activation of macrophages by fruit and vegetable polysaccharides
2)白细胞分化抗原14(CD14)和CR3 介导的信号通路 CD14 是一种表达于单核细胞、巨噬细胞和中性粒细胞表面的糖蛋白。CD14 被认为是几种TLRs 的共受体,这些受体与CD14 共同传递刺激信号,参与信号级联反应,促使机体做出免疫应答[42]。CR3 是一种补体蛋白,是β-葡聚糖的常见受体。果蔬多糖与CD14 和CR3 可形成跨膜复合物,激活磷脂酶(PLC),进而活化蛋白激酶(PKC)或者PI3K 及其下游AKT,介导MAPK 或NF-κB信号通路发挥免疫应答。研究发现龙眼多糖通过CR3 受体介导PI3K-AKT 和MAPKs 信号转导途径激活巨噬细胞功能[43],南瓜多糖则通过CR3 和TLR4 介导MAPK 或NF-κB 信号通路诱导巨噬细胞分泌IL-1β,TNF-α 和IL-6 等细胞因子[44]。
3)SR 介导的信号通路 SR 是一种跨膜糖蛋白,存在于多种免疫细胞中。研究发现SR 可能与CR3 通过相似的通路激活巨噬细胞。SR 和CR3活化PLC,PLC 的酶解产物激活PKC 和PI3K,进而激活MAPK 和NF-κB 触发基因转录[45]。研究发现岩藻多糖是典型的SR 糖配体,能通过SR-A介导PKC、PAK 和MAPKs 活化,激活巨噬细胞功能[46-47]。岩藻多糖是一类含有岩藻糖和硫酸基团的多糖,主要来源于褐藻,在果蔬中很少见,目前关于果蔬多糖通过SR 激活巨噬细胞功能的研究鲜见报道。
4)MR 介导的信号通路 MR 主要由巨噬细胞表达,可识别甘露糖残基、岩藻糖残基和乙酰氨基葡萄糖残基,具有多种免疫相关功能。MR 在固有免疫反应中通过识别细胞壁多糖,促进巨噬细胞摄取细菌、酵母菌和寄生虫等微生物,发挥固有免疫调节作用[48]。MR 与多糖结合后增加巨噬细胞的吞噬活性,产生ROS,激活转录因子NF-κB,诱导细胞因子分泌,发挥适应性免疫调节作用。如玛咖多糖可与巨噬细胞中MR 结合,通过刺激巨噬细胞吞噬作用或刺激IκB 激酶(IKK)表达,激活NF-κB 信号通路,从而增强巨噬细胞功能[49]。
5)Dectin-1 介导的信号通路 Dectin-1 主要识别β-1,3、β-1,6 连接的葡聚糖,介导巨噬细胞的吞噬作用以及对葡聚糖的免疫反应[50]。多糖配体与Dectin-1 结合后可调节MAPK 或NF-κB信号通路。Hu 等[21]研究发现含有→4)-α-D-Glcp(1→主链、(1→6)-α-D-Glcp支链的莲藕残渣多糖可与Dectin-1 结合,活化MAPK 和PI3K/Akt 信号通路,激活巨噬细胞分泌NO、TNF-α 和IL-2。
此外,果蔬多糖还可通过诱导Jak-STAT 途径发挥免疫应答。Jak-STAT 信号转导途径主要由细胞因子诱导,可调节下游超过50 种细胞因子和生长因子,被视为免疫系统中心的通信节点[51]。如莲叶多糖可通过TLR 和Jak-STAT 信号通路发挥免疫调节作用[52];覆盆子多糖通过TLR2 受体,介导MAPK、NF-κB 和Jak-STAT 途径刺激巨噬细胞功能[23]。
3.1.2 T/B 淋巴细胞免疫应答的信号通路 T/B细胞通过TLR2/4、TCR、BCR 等受体介导的信号通路与巨噬细胞相似,均包括MAPKs、NF-κB、PI3K-AKT 和Jak-STAT 等途径,具体涉及的部分信号因子存在一定的差异。
1)TCR 介导的信号通路 TCR 是T 细胞表面受体,也是T 细胞表面的特征性标志。TCR 对抗原的亲和力相对较弱,一般与CD3 形成复合体,再结合主要组织相容性复合体I/II(MHC I/II)分子形成TCR 共受体,从而介导T 细胞激活。多糖与TCR 共受体结合后,激活蛋白酪氨酸激酶(PTK),从而通过PI3K 或MAPK 途径激活T 细胞。此外,激活的PTK 会受到Ca2+流动的影响,进而激活活化T 细胞核因子(NFTA)或AP-1 转录因子,发挥免疫调节作用。如枸杞多糖能促进T 细胞跨膜蛋白CD25 表达,激活NFTA 和AP-1 转录因子,诱导IL-2和INF-γ 基因的转录和蛋白质合成[53]。
2)BCR 介导的信号通路 BCR 是一种位于B 细胞膜表面的跨膜受体,由IgM 和CD79 组成。BCR 介导的信号调节还涉及一些共受体,如B 细胞特异性糖蛋白CD19 和CD38。多糖与IgM 和CD79 结合后,激活PTK,进而通过PI3K 或MAPK途径激活B 细胞[54]。
3)TLR2/4 介导的信号通路 T/B 细胞中均含有TLR2/4 受体,其中T 细胞含量相对较低。果蔬多糖与T/B 细胞中TLR2/4 结合后,涉及MAPKs、NF-κB、Jak-STAT 等多条信号转导途径。如松花粉硫酸化多糖结合B 细胞中TLR4 后,激活MyD88,进而激活TRAF6 及下游NF-κB 和MAPK 信号通路[55]。
3.2 果蔬多糖通过调节肠道微生物及其代谢产物发挥免疫调节作用
虽然大量的动物实验或细胞试验证实果蔬多糖具有免疫调节活性,但是其难以直接被人体内的消化酶水解,作为一种生物大分子很难透过肠黏膜直接被机体吸收利用。它是如何发挥生理功效的,一直存在质疑。近年来,随着肠道微生物组学技术的发展,人们发现多糖等碳水化合物成为调节肠道菌群结构和功能的关键因素。多糖可通过调节肠道菌群来影响机体免疫,维持机体健康。因而,关于多糖的免疫调节作用研究,从以淋巴组织为中心的免疫系统逐渐转变为以肠道菌群为核心的肠黏膜免疫系统。
人体不能编码足够的碳水化合物酶(CAZymes)来降解复杂碳水化合物,而肠道菌群可以提供大量的CAZymes 降解肠道中的多糖。肠道菌群可利用果蔬多糖作为发酵底物产生短链脂肪酸(SCFA),降低肠道环境中的pH 值,为有益健康的肠道微生物群提供好的生长环境。同时,肠道中产SCFA 的微生物可以利用果蔬多糖的降解产物进行生长繁殖,从而增加菌群数量。果蔬多糖通过增加有益菌以及产SCFA 肠道菌数量,降低有害菌数量,调节肠道微生物的组成和丰度[56-57]。肠道菌群酵解多糖产生的主要代谢产物为乙酸、丙酸、丁酸等短链脂肪酸。由于肠道菌群通过分泌特异性的CAZymes 降解果蔬多糖,针对不同结构的果蔬多糖,各肠道菌株分泌酶的能力不同,因此对多糖的降解利用也不同,进而导致产生的代谢产物亦存在差异;且不同菌株代谢产生乙酸、丙酸、丁酸的能力不同,有一些菌株能将乙酸转化为丁酸[58]。摄食不同果蔬多糖会导致机体短链脂肪酸的含量发生变化。
肠道菌群及其代谢产物SCFA 都能调节机体免疫反应。肠道菌群可以调节固有免疫和适应性免疫,如分节丝状细菌(SPF)被报道具有调节免疫系统的作用[59]。当SPF 黏附到肠上皮细胞时,能特异性地作用于肠黏膜DC 细胞,诱导MHC II 产生,促进IL-23 分泌,而IL-23 会进一步诱导IL-22 产生,IL-22 在肠黏膜免疫中发挥重要作用;SPF 也能诱导淋巴小结生发中心的扩张,从而促进具有分泌潜力的B 细胞成熟,促进IgA 合成。SCFA 既影响固有免疫,又影响适应性免疫。在固有免疫中,SCFA 通过短链脂肪酸受体(GPR43)活化MAPK 信号通路,促进中性粒细胞增加[60];也可以通过抑制NF-κB 信号通路,从而抑制DC 细胞和巨噬细胞分泌促炎因子[61]。在获得性免疫中,SCFA 通过诱导调节性T 细胞(Tregs)产生,影响T细胞分化和增殖,调节辅助型T 细胞1(Th1 细胞)、辅助型T 细胞2(Th2 细胞)、辅助型T 细胞17(Th17 细胞)分化和活化[62];也可促进B 细胞中Xbp1和Aicda基因表达,从而促进抗体生成[63]。
果蔬多糖可调节肠道菌群及其代谢产物发挥免疫调节作用(表2)。目前主要采用环磷酰胺(CTX)和葡聚糖硫酸钠(DSS)/三硝基苯磺酸(TNBS)等诱导的肠黏膜损伤模型探究果蔬多糖基于肠道菌群的免疫调节作用。在CTX 诱导的免疫抑制模型中,肠黏膜受损导致肠道菌群发生位移、肠道菌群稳态失调;CTX 也会抑制机体的免疫功能,导致免疫系统紊乱。CTX 可增加机体中有害菌大肠杆菌(Escherichia coli)、肠杆菌(Enterobacteriaceae)、假单胞菌(Pseudomonas)和肠球菌(Enterococci)含量,降低胸腺、脾脏等器官指数,减少分泌型免疫球蛋白A(sIgA)分泌,促进肠道炎症因子分泌[64]。果蔬多糖能改善CTX 诱导的肠黏膜损伤,上调双歧杆菌(Bifidobacterium)、乳酸杆菌(Lactobacillus)等益生菌,以及芽孢杆菌(Bacillus)、副拟杆菌属(Parabacteroides)等产短链脂肪酸菌数量,增加乙酸、丙酸、丁酸等SCFA 含量,提高脾脏、胸腺等免疫器官指数,促进淋巴细胞增殖,促进IgA、sIgA 分泌,增强免疫系统功能[65-66]。在DSS 或TNBS 等诱导的结肠炎模型中,肠道屏障受损导致肠道菌群失调、机体发生炎症反应、免疫稳态失调。研究发现,在IBD 病人和结肠炎小鼠中,抗炎菌粪杆菌(Faecalibaterium prausnitzii)和一些产SCFA 菌食葡糖罗斯拜瑞氏菌(Roseburia inulinivorans)、扭链瘤胃球菌(Ruminococcus torques)和单形拟杆菌(Bacteroides uniformis)显著减少。果蔬多糖能显著降低病原菌大肠杆菌、肠球菌(Enterococcus)含量,提高产丁酸菌丁酸梭菌(Clostridium butyricum)以及乳酸杆菌、双歧杆菌(Bifidobacterium)等益生菌含量,减少促炎因子IL-6,IL-1β 表达,增加抗炎因子IL-10 表达,促进乙酸、丙酸和丁酸表达,介导抗炎作用,调节机体的免疫系统[56,67]。
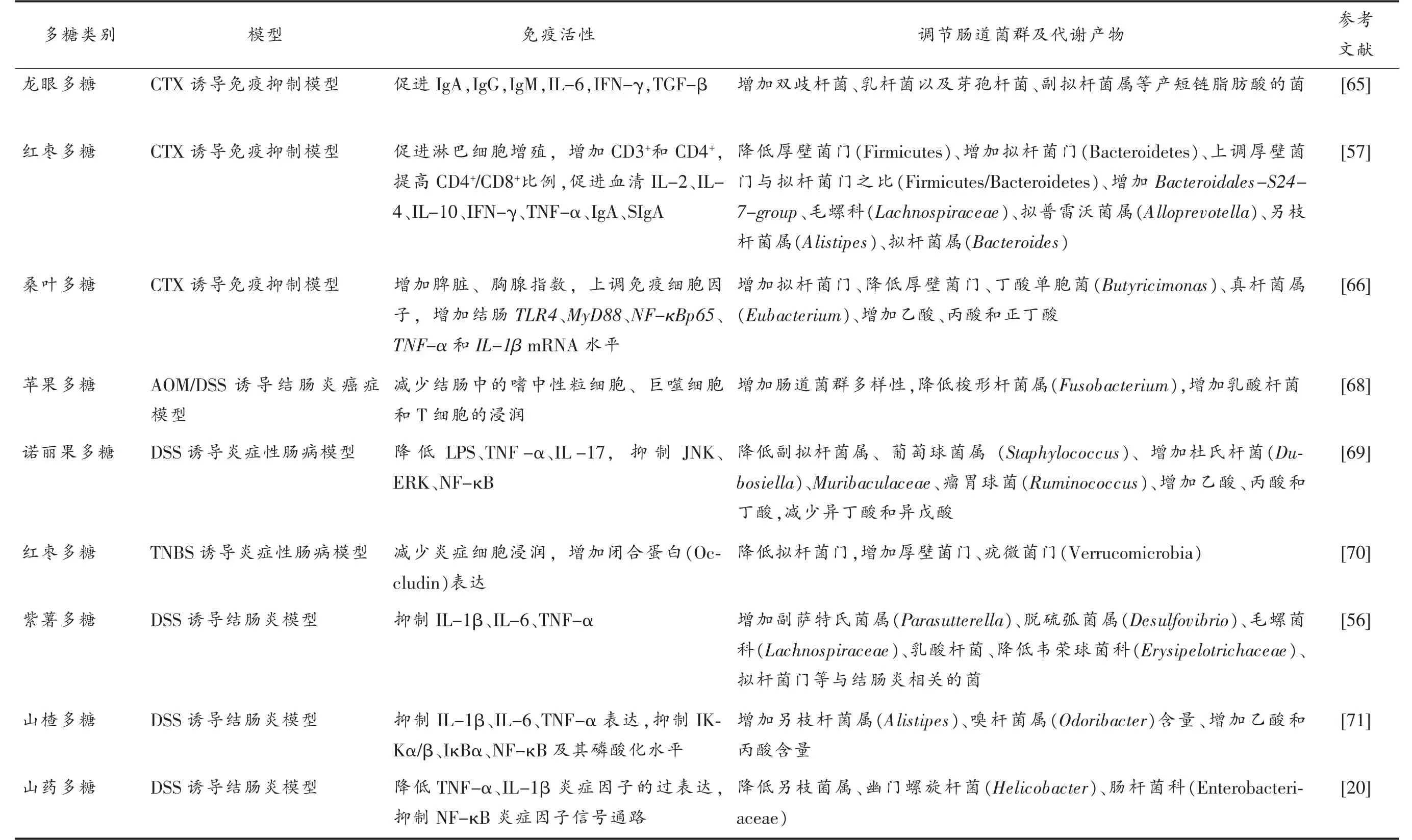
表2 果蔬多糖基于肠道菌群发挥免疫调节活性Table 2 Immunoregulatory activity of fruit and vegetable polysaccharides based on intestinal flora
4 展望
1)在果蔬多糖的结构与免疫活性构效关系方面 果蔬原料成分复杂,导致多糖的分离纯化、结构鉴定都非常困难。现有报道的很多果蔬多糖的精细结构特征并不清楚。需要建立一种系统、高效的果蔬多糖制备方法,使获得的多糖具有一致性、重复性、可靠性。此外,关于果蔬多糖的结构解析,有研究者提出以“部分降解-甲基化-NMR”为核心的多糖结构解析技术[1],然而,由于不同原料多糖的差异性,果蔬多糖的结构解析仍非常困难,获得的多糖精细结构信息也有限,还需拓展更多的分析方法来表征果蔬多糖的结构。明确果蔬多糖的结构特征是阐明其免疫调节构效关系的前提。多糖的分子质量、单糖组成、糖苷键连接方式、空间结构等均影响其免疫活性,这些影响因素之间并不是独立的,而是相互关联的,由此给其构效关系的探究带来了困难。后续可通过化学法或生物法制备系列不同结构的多糖,明确不同多糖的结构和免疫调节活性差异,建立多糖结构特征与免疫活性之间的关联网络,以阐明其构效机制。
2)在果蔬多糖的免疫调节作用机制方面 目前关于果蔬多糖的免疫调节作用机制研究包括多糖通过受体识别模式激活免疫细胞信号通路发挥免疫调节作用,以及通过调节肠道菌群及代谢产物发挥免疫调节作用两个方面。在识别受体介导的免疫细胞信号通路研究中,随着生物学技术的发展,高通量测序技术(RNA-seq)被用于分析多糖对免疫细胞的调节作用机制,可较为全面地阐明受多糖调控的细胞受体及信号通路,然而,相关的受体及信号通路只能基于已有的研究发现,对于是否存在新的作用受体及信号通路有待进一步确定。此外,目前关于果蔬多糖基于肠道菌群发挥免疫调节作用的研究更多停留在表面的现象观察,即多糖处理前、后免疫系统相关因子、肠道菌株、短链脂肪酸等代谢产物的变化,对于多糖、肠道菌群及代谢产物、免疫系统之间的互作机制并不清楚。肠道菌群利用果蔬多糖时,哪些特异性的肠道细菌降解特定结构的果蔬多糖,是否产生其它代谢产物等有待进一步探究。摄入果蔬多糖会引起肠道菌群构成谱变化,从而调节机体免疫状态。目前为止,只有少部分菌被发现具有调节机体免疫作用,需进一步探究其它微生物或多菌株协同的免疫调节功效。
