三种证型对哮喘小鼠特异性/非特异性免疫功能及气道炎症的相关性研究
2021-12-17孙雅妮陈诗唐寒葛月宾
孙雅妮,陈诗,唐寒,葛月宾
(中南民族大学 药学院, 武汉 430074)
支气管哮喘是由肥大细胞、嗜酸性粒细胞、淋巴细胞等炎性细胞和结构细胞(气道上皮细胞、平滑肌细胞)等多种细胞共同介导的一种在临床上常见的气道慢性炎症性异质性呼吸道疾病[1],其病理基础是机体免疫功能的紊乱,导致出现气道炎症、IgE分泌增加、肺部损伤等现象[2]. 支气管慢性气道炎症迁延日久,肺气渐虚,肺气虚可致中州脾土虚弱,则脾失健运,气血生化乏源,故日久可致脾肺俱虚[3].临床中医将哮喘缓解期归属为肺气虚型、脾气虚型、肺脾气虚型等几种类型. 本研究基于中医辨证理论,结合现代技术,通过建立三种证型结合卵蛋白致敏小鼠支气管哮喘模型,探讨分析三种不同中医证型对哮喘小鼠免疫功能、气道炎症、气道高反应性的影响,是否存在一定的关联性.
1 材料
1.1 实验动物
SPF级BALB/c小鼠(雌性,6~8周)购自华中农业大学实验中心,实验动物许可证号[SCXK(鄂)2015-0019]. 每5只小鼠一个实验笼,在标准动物实验中心室饲养[12 h光照/黑暗周期,(23±1) ℃,相对湿度(50±5)%],可自由获取食物和水,实验结束前12 h禁食仅可饮用水. 所有实验均严格按《实验动物的护理和使用指南》进行[4].
1.2 试剂及实验材料
鸡卵白蛋白(OVA)、脂多糖(LPS)、半刀豆球蛋白A(Con A)、乙酰胆碱(Ach)(美国Sigma);瑞氏-吉姆萨溶液、AntiCD3+、AntiCD4+、AntiCD8+ (Biosharp);胎牛血清(浙江天杭);液态铝佐剂(哈药集团);小鼠ELISA 试剂盒OVA-IgE、IgE、IL-4、IL-5、IL-13、IgA、IgG、IgM(达科为).
1.3 主要仪器
FACSCalibur流式细胞仪(美国BD);FlexiVent小鼠肺功能仪(上海赛睿克);多功能酶标仪(美国Thermo Scientific);BPN-150CW-CO2细胞培养箱(上海一恒).
2 实验方法
2.1 动物造模
BALB/c小鼠适应性喂养3 d后 , 将50只小鼠随机分为5组:对照组、哮喘组、脾气虚哮喘组、肺气虚哮喘组、肺脾气虚哮喘组,每组10只. (1) 哮喘组模型建立:在实验第1、3、5天以3 mg/mL OVA+ 5% Al(OH)3等体积的液态铝溶液腹腔注射致敏,200 μL/只,在第6天以 6 mg/mL OVA+5% Al(OH)3液态铝溶液滴鼻激发引喘,按25 μL/10g计算,1次/d ,共 7 d,以激发时出现呼吸急促、腹肌抽动及肢体呈团等症状为哮喘模型成功.(2)脾气虚哮喘模型建立:按照《中医实验动物学》方法先复制“脾气虚证动物模型”[5],采用“饮食不节+疲劳过度+苦寒泻下”三种综合因素构建脾虚证模型,持续14 d,与对照组相比,以出现体重下降、饮食减少、便软或溏、游泳耐力下降表明脾气虚证模型复制成功,在造模第15天结合OVA抗原致敏激发,以达到出现哮喘等症状. (3)肺气虚哮喘模型建立:按照《中医实验动物学》复制“肺气虚证动物模型”[5],小鼠放置于自制的体积为400 mm×400 mm×800 mm烟薰箱中,每天以5支红金龙香烟烟熏30 min(焦油量为11 mg/支),上下午各一次/d,持续30 d,每天自由饮食喝水,每隔5 d观察记录体征变化,与对照组相比,表现出呼吸急促,咳嗽,精神疲劳,反应迟缓,鼻腔分泌物增多,毛发枯黄,没有光泽,体重下降,表明肺气虚证模型复制成功[5],在造模第12天结合OVA抗原致敏激发,以达到出现哮喘等症状.(4) 肺脾气虚哮喘建立:结合肺气虚证和脾气虚证模型,烟熏持续30 d,在造模第7天采用“饮食不节+疲劳过度+苦寒泻下”的方法造成脾虚证,持续14 d,在造模第10天结合OVA抗原致敏激发,至引喘成功.
造模期间,每周定时称量小鼠体重,最后一次OVA抗原致敏激发后,取肺组织并称重,计算其所占每只小鼠体重比值.
2.2 免疫器官指数
眼球取血后,无菌取脾和胸腺称重,脾脏和胸腺指数分别用组织重量(mg)/体重(g)的比值表示.
2.3 脾淋巴细胞增殖功能测定
MTT法测定脾细胞增殖[6],取脾脏置于冷磷酸盐缓冲液(PBS)中,研磨过40 μm细胞网筛,得到均匀的细胞悬液,210 r/min离心5min ,弃上清,加入红细胞裂解液,裂解5 min, PBS洗涤,悬浮于培养基中(RPMI1640加入0.05 mM 巯基乙醇,100 UI/mL青霉素,100 μg/mL链霉素和10%FCS),调整细胞浓度至5.0×106cell/mL ,台盼蓝染色计数,显示细胞活力超过95%. 将细胞悬液以100 μL/孔接种到96孔板中,加入5 μg/mL Con A、4 μg/mL LPS于培养基. 置于37 ℃,5% CO2培养箱中培养48 h后,每孔加入50 μL MTT, 孵育4 h,1000~1400 r/min离心5 min, 弃未结合的MTT上清液,最后每孔加入150 μL二甲基亚砜(DMSO),15 min后使用酶标仪570 nm下进行读数.
2.4 脾脏T淋巴细胞亚群测定
根据上述方法制备单细胞悬液,调整细胞浓度至1×106cell/mL,同时加入1 μL APC-CD3荧光抗体、1 μL FITC-CD4荧光抗体、1 μL PE-CD8荧光抗体,混匀,冰下黑暗孵育20 min,用冷PBS洗涤3次,将细胞悬浮于400 μL PBS中,2 h内上流式细胞仪进行分析[6].
2.5 BALF中白细胞分类计数
将小鼠眼球取血后,立即收集支气管肺泡灌洗液, “V”型口剪开气管,缓慢注入0.8 mL冰冷PBS,反复回抽3次,离心,收集上清液,加入1 mL PBS重悬细胞,用于细胞计数,并调整到1.0×105cell/mL,瑞氏-吉姆萨染色,计数[7].
2.6 肺组织病理形态观察
小鼠右肺下叶浸泡于4%中性多聚甲醛中固定过夜,石蜡包埋切片,H&E染色[8].
2.7 气道阻力测定
对最后一次滴鼻激发24 h后的各组小鼠气道阻力进行测定[1],麻醉 后小鼠仰面固定, “V”形切口剪开气管,气管插管,棉线固定气管,并连接到呼吸机,常规机械通气后,测量肺功能. 待小鼠呼吸基线稳定后,依次雾化递增浓度的30 μL乙酰胆碱溶液(0、3.125、12.5、25、50 mg/mL),雾化液体通过气管插管进入呼吸系统,测定气道阻力[6].
2.8 血清中IgE和OVA特异性IgE、血清中免疫球蛋白IgA、IgG、IgM含量测定以及BALF中细胞因子含量的测定
定量夹心酶联免疫分析试剂盒测定血清中IgE和OVA-IgE以及每组小鼠BALF中IL-4、IL-5、IL-13的含量[9].ELISA试剂盒测定每组小鼠血清中免疫球蛋白IgA、IgG、IgM的含量.
2.9 统计学分析
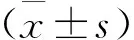
3 实验结果
3.1 三种证型对哮喘小鼠体重及肺系数的影响
从造模第15天开始(图1),四组模型小鼠的体重均出现下降,造模结束后,三种证型哮喘组较单纯哮喘组小鼠的体重下降更明显(P<0.05),表明三种虚证会导致哮喘小鼠的体重减轻,且肺脾气虚证哮喘小鼠体重较另外两组病证小鼠体重下降更明显,进一步说明三种证型哮喘小鼠模型复制初步成功;同时,与空白组相比(图2),四组模型小鼠肺重量系数显著上升(P<0.01),且肺气虚证哮喘组较单纯哮喘组肺重量系数上升明显(P<0.05),说明哮喘的发作会引起肺部肿胀,且虚证会影响哮喘小鼠肺部肿胀状态.
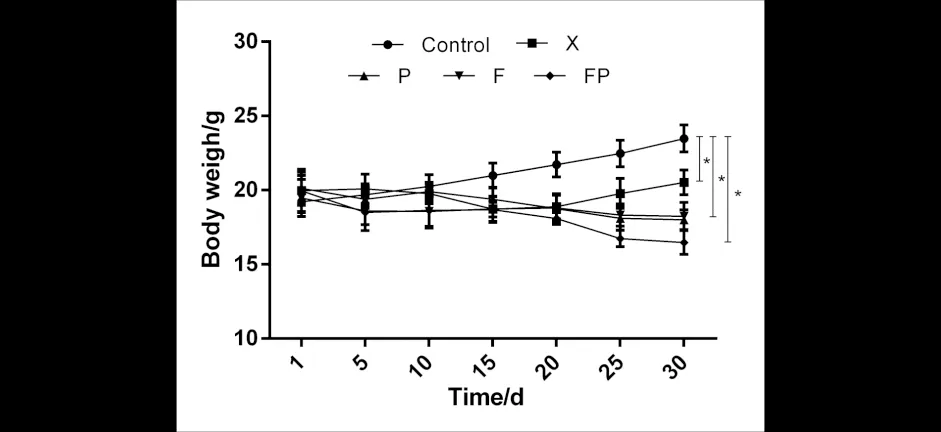
图1 小鼠体重
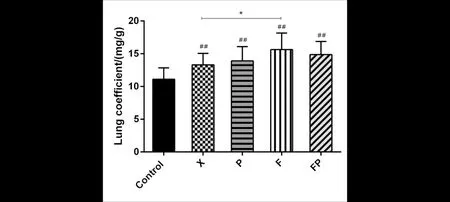
图2 肺系数
3.2 三种证型对哮喘小鼠免疫器官指数的影响
胸腺和脾脏质量变化及淋巴细胞增殖功能亦从一定程度上反应了免疫功能的变化[10],与空白组相比(图3).哮喘模型组和肺气虚哮喘组免疫器官指数均无差异,没有统计学意义;脾气虚哮喘组脾指数下降(P<0.05),胸腺指数无差异;肺脾气虚哮喘组脾指数和胸腺指数均下降(P<0.05). 模型组之间相比,肺脾气虚哮喘组较哮喘组和肺气虚哮喘组脾指数和胸腺指数均下降(P<0.05);脾气虚哮喘组较哮喘组的脾指数和胸腺指数均下降(P<0.05). 说明脾气虚证和肺脾气虚证对哮喘小鼠的免疫器官指数有所影响.

图3 免疫器官指数
3.3 三种证型对哮喘小鼠脾淋巴细胞增殖功能的影响
与空白组相比(图4),除哮喘组外,其他三种虚证哮喘模型由ConA诱导的T淋巴细胞增殖功能显著下降(P<0.01);与哮喘组相比,肺脾气虚哮喘组T淋巴细胞增殖反应显著下降(P<0.01).与空白组相比(图5),脾气虚哮喘组由LPS诱导的B淋巴细胞增殖功能下降(P<0.05),肺脾气虚哮喘组B淋巴细胞增殖反应显著下降(P<0.01). 说明三种证型会影响哮喘小鼠的天然免疫功能,肺脾气虚型的影响更显著.
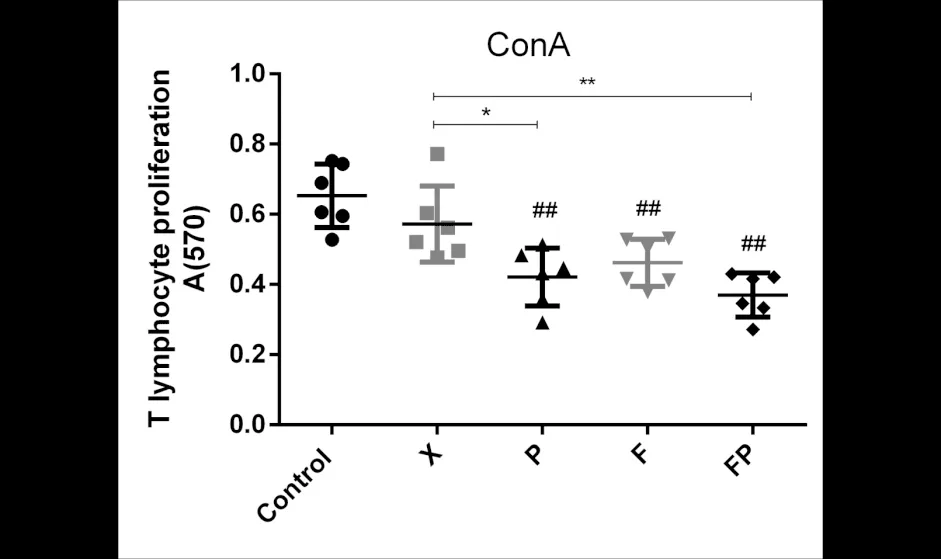
图4 T淋巴细胞增殖

图5 B淋巴细胞增殖Fig. 5 Proliferation of B Lymphocytes n=6)
3.4 三种证型对哮喘小鼠脾脏T淋巴细胞亚群的影响
T细胞亚群是支气管哮喘发病机制中的主要调节细胞[10-11],流式细胞术分析脾脏组织中免疫细胞亚型的表达(表1,图6),与空白对照组相比,除哮喘组外,三种病证模型组中CD3+、CD4+占比减少(P<0.05),CD8+比例和CD4/CD8比值无显著性差异;与哮喘组相比,脾气虚哮喘组和肺脾气虚哮喘组中CD3+、CD4+比例下降(P<0.05),CD8+比例和CD4/CD8比值无显著性差异;肺脾气虚哮喘组CD3+占比低于另外两组证候哮喘模型(P<0.05). 说明三种证型会不同程度影响哮喘小鼠的特异性免疫功能.

表1 脾脏T淋巴细胞亚群中CD3、CD4、CD8、CD4/CD8的占比Tab.1 The proportions of CD3、CD4、CD8、CD4/CD8 in splenic T Lymphocyte subsets n=3)
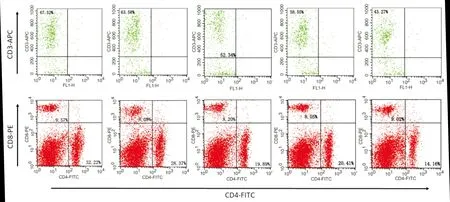
图6 脾脏T淋巴细胞亚群中CD3、CD4、CD8、CD4/CD8的占比Fig.6 Proportion of CD3, CD4, CD8, CD4/CD8 in splenic T lymphocyte subsets
3.5 三种证型对哮喘小鼠气道炎症的影响
致敏小鼠经OVA抗原多次攻击激发后,BALF中白细胞总数增加,以嗜酸性粒细胞、中性粒细胞及巨噬细胞为主,说明出现明显的气道炎症[12]. 如图7所示,与空白对照组相比,除脾虚哮喘组外,单纯哮喘组和其他两种病证模型组白细胞总数、嗜酸性粒细胞、中性粒细胞数目显著增加(P<0.01);模型组之间相比,肺脾气虚哮喘模型组较单纯哮喘组和脾气虚哮喘组的白细胞总数、嗜酸性粒细胞数目明显增多(P<0.05),巨噬细胞、淋巴细胞无显著性差异(表2). 说明三种虚证会加重炎性细胞对哮喘小鼠气道上皮组织的浸润,且肺脾气虚型对哮喘小鼠气道炎症的影响更为严重.

表2 三种证型对哮喘小鼠BALF中白细胞分类计数的影响 Tab. 2 The effects of three types of syndromes on the classification and count of white blood cells in BALF of asthmatic

图7 BALF中白细胞分类计数 Fig.7 Classification of white blood cell counts in
组织学评估显示,与空白对照组相比,其他模型组经OVA刺激后引起明显的气道炎症征象,并伴有明显的炎性细胞浸润和支气管壁增生.如图8所示,肺脾气虚哮喘模型组较其他三组模型组,支气管周围区域炎性细胞的浸润更加明显.

图8 三种证型对哮喘小鼠肺组织病理的影响Fig.8 The influences of three types of syndromes on lung tissue pathology in asthmatic mice(a)空白对照组;(b)哮喘组;(c)脾气虚哮喘组;(d)肺气虚哮喘组;(e)肺脾气虚哮喘组
3.6 三种证型对哮喘小鼠气道阻力的影响
用Rrs值的变化来反应支气管哮喘小鼠气道高反应性[13]. 如图9所示,乙酰胆碱的浓度为0 mg/mL时,各组小鼠Rrs基础值相当,与空白组相比,各模型组小鼠Rrs值随吸入乙酰胆碱的浓度的增加而增加,乙酰胆碱的浓度为25、50 mg/mL时,模型组的Rrs值升高(P<0.05);模型组间相比,乙酰胆碱浓度为50 mg/mL,肺脾气虚型哮喘小鼠Rrs值高于单纯哮喘组和脾气虚哮喘组(P<0.05). 结果表明:肺脾气虚证在活体水平更大程度地增加了Ach引起的小鼠气道平滑肌收缩.
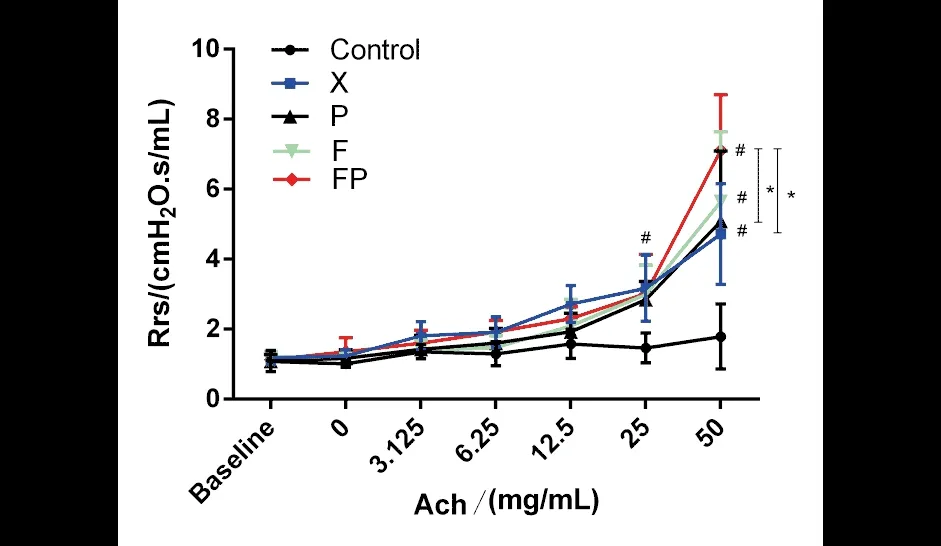
图9 小鼠气道阻力的测定Fig.9 Determination of airway resistance of n=6)
3.7 三种证型对哮喘小鼠血清中IgE和OVA特异性IgE以及BALF中细胞因子水平的影响
为了建立三种证型是否对哮喘小鼠在气道炎症中存在其他可能的作用机制,通过检测BALF中Th2细胞因子IL-4、IL-5、IL-13以及血清中IgE和OVA特异性IgE水平. 如图10所示,与空白组相比,各组模型组小鼠血清中总IgE和OVA-IgE以及BALF中细胞因子IL-4、IL-5、IL-13的浓度明显升高(P<0.01);模型之间相比,肺脾气虚型哮喘组较单纯哮喘组和肺气虚型哮喘组血清中总IgE及OVA-IgE水平上升(P<0.05),表明三种证型对哮喘小鼠气道炎症具有不同程度的影响.

图10 小鼠血清中IgE和OVA-IgE和BALF中IL-5、IL-4、IL-13的含量(¯ Fig.10 The contents of IL-5, IL-4 and IL-13 in serum of IgE and OVA-IgE and BALF in n=6)
3.8 三种证型对哮喘小鼠血清中免疫球蛋白IgG、IgA、IgM水平的影响
与空白组相比(图11),单纯哮喘组免疫球蛋白IgG、IgA、IgM水平无显著性差异,脾气虚哮喘组和肺脾气虚哮喘组IgG、IgA水平显著上升(P<0.01),肺脾气虚哮喘组IgM水平也具有显著性差异(P<0.01);模型组之间相比,肺脾气虚哮喘组和脾气虚哮喘组较哮喘组IgA水平下降.(P<0.05)、IgM水平显著下降(P<0.01). 表明三种证型会影响哮喘小鼠的体液免疫功能,肺脾气虚型较其他两种证型更为明显.

图11 小鼠血清中IgA、IgG、IgM的含量 Fig.11 The contents of IgA, IgG and IgM in the serum of n=6)
4 讨论
胸腺和脾脏是主要的免疫器官[14]. 脾脏内含有大量的T淋巴细胞和由骨髓干细胞发育而来的B细胞[10]. LPS是一种非胸腺依赖性抗原,可直接刺激B淋巴细胞增殖. ConA属于一种有丝分裂原,可刺激静止的T淋巴细胞增殖活化,T淋巴细胞活化后,产生相应的免疫应答过程[10]. 在本实验研究中,模型构建成功后,脾气虚与肺脾气虚会导致哮喘小鼠脾脏指数、胸腺指数、由ConA刺激的T淋巴细胞增殖、LPS刺激的B淋巴细胞增殖功能明显下降. 这表明脾气虚、肺脾气虚证候影响哮喘小鼠非特异性免疫功能.
T细胞亚群是支气管哮喘发病机制中的主要调节细胞,根据T细胞表面CD分子表达的不同,可分为两大表型,即为CD4+和CD8+细胞,CD4+细胞可在不同种类、剂量抗原的刺激下分化为Th1、Th2细胞,CD3+分子的功能是转导T细胞抗原受体识别抗原所产生的活化信号[15],T细胞亚群CD3+、CD4+分子表达减少,表明特异性免疫功能下降. 本研究的脾气虚哮喘组和肺脾气虚哮喘组CD3+、CD4+占比低于单纯哮喘组,表明三种证型会不同程度地影响哮喘小鼠特异性免疫功能. B淋巴细胞介导的体液免疫应答增殖分化出多种免疫球蛋白. 观察到肺脾气虚证导致哮喘小鼠体内B细胞介导的体液免疫应答IgG、IgA、IgM水平下降明显,表明肺气虚累及于脾时致肺脾气虚哮喘小鼠之体液免疫功能较其他两组证型哮喘小鼠体液免疫功能下降.
气道高反应性是哮喘的重要临床表现,也是判断哮喘模型是否构建成功的重要指标[16]. 实验结果显示,各模型组随吸入Ach浓度梯度增加而升高;肺脾气虚证促使哮喘小鼠在Ach刺激下,气道阻力增加显著高于其他单因素证型哮喘模型组.
气道炎症与Th2细胞的增加有关,它们分泌IL-4、IL- 5、IL-13,最终增加IgE和嗜酸性粒细胞炎症的产生. 嗜酸性粒细胞是哮喘气道慢性炎症的关键效应细胞. 目前,IL-13是治疗过敏性哮喘的重要治疗靶点[8]. IL-4、IL-5和IL-13在OVA诱导的各证型哮喘小鼠中的浓度升高;肺脾气虚证导致哮喘小鼠血清中总IgE、OVA-IgE浓度高于其他单因素证候模型组. 表明三种虚证对哮喘小鼠的气道炎症有不同程度的影响.
本研究评价和探讨三种证型对OVA诱导的哮喘小鼠模型的影响.通过免疫、炎症、肺功能等相关的效应指标变化进行病证结合关联分析, 加入脾气虚累积于肺时是否会导致肺脾气虚各项指标的变化,探讨脾肺之间的关联性.结果表明:脾气虚累及于肺气虚致肺脾气虚哮喘小鼠较单因素证侯哮喘小鼠的非特异性免疫、细胞免疫、体液免疫功能更紊乱,从而造成哮喘小鼠气道高反应,增加气道炎症和肺损伤更显著,说明三种证型对哮喘小鼠特异性/非特异性免疫功能及气道炎症有影响且具有一定的关联性.
