东南地区猪圆环病毒2型检测及分子流行病学分析
2021-12-17魏春华邓小莺林志峰黄夏玲戴爱玲杨小燕罗满林刘建奎
魏春华,徐 叶,邓小莺,林志峰,毛 婉, 黄夏玲,戴爱玲,杨小燕,李 娜,罗满林,刘建奎
(1 龙岩学院 生命科学学院,福建 龙岩 364000;2 福建省家畜传染病防治与生物技术重点实验室,福建 龙岩 364000; 3 福建农林大学 动物科技学院,福建 福州 350002;4华南农业大学 兽医学院,广东 广州 510642)
PCV2是圆环病毒科圆环病毒属的成员,为无囊膜的单股闭合环状DNA病毒,其基因组大小为1 766~1 777 bp。根据抗原性和基因型的不同,前人将PCV分为PCV1、PCV2和PCV3等3个血清型[1-2],2019年我国学者证实猪群中存在PCV4[3]。PCV1对猪不具有致病作用,PCV2和PCV3在猪群中广泛存在。PCV2对猪具有致病性,由其引起的疾病称为猪圆环病毒相关疾病(porcine circovirus associated diseases,PCVAD), 主要包括断奶仔猪多系统衰竭综合征(PMWS)、猪皮炎与肾病综合征(PDNS)、猪呼吸道疾病综合征(PRDC)和母猪繁殖障碍等多种疾病,给世界养猪业造成巨大的经济损失[4-6]。研究表明,尽管猪场广泛使用灭活疫苗或亚单位疫苗来防控PCV2,但是其感染率在猪场仍呈现上升趋势。此外,PCV2基因组具有高突变性和重组性的特点,导致PCV2变异毒株不断出现,给猪场防控PCV2带来严峻挑战[7-8]。
PCV2基因组包含11个潜在的开放阅读框(ORF1~ORF11),其中对ORF1~ORF4的功能研究较为清楚。ORF1基因全长945 bp,是PCV2最大的开放阅读框,编码与病毒复制相关的Rep和Rep’蛋白[9-10]。ORF2基因全长为702,705或717 bp,编码病毒的核衣壳(Cap)蛋白,是主要的免疫保护性抗原,变异性较高,也是进行遗传变异分析和疫苗开发的靶基因[6,11-12]。ORF3、ORF4基因编码的蛋白与细胞凋亡相关[13-14]。目前,基于ORF2基因构建的遗传进化树将PCV2分为PCV2a、PCV2b、PCV2c、PCV2d和PCV2e等5种基因型,其中PCV2a、PCV2b和PCV2d在世界范围内广泛分布,PCV2c仅存在于丹麦和巴西[15-18]。PCV2e基因型于2015年在美国首次报道,其基因组全长1 777 bp,ORF2基因长度717 bp,其末端比PCV2a~PCV2d基因型毒株的ORF2基因多12~15 bp[15]。
目前,我国猪场PCV2呈现多种基因型(包括重组毒株)并存的局面,优势毒株是否发生变异需要从全基因组角度进一步研究,不能仅仅依靠ORF2基因。此外,PCV2e基因型在猪场的流行情况还不清楚,因此需要进一步了解当前PCV2的流行动态及主要流行毒株。东南地区是我国重要的养猪区域,为深入了解该区域猪群中PCV2的流行动态及其遗传演化,本研究对2012-2018年在福建、江西、广东、江苏及浙江等省规模化猪场采集的649份疑似断奶仔猪多系统衰弱综合症(PMWS)猪只的临床样本(淋巴结、脾脏、肾脏、血清等)进行PCV2检测,明确各个基因型毒株的流行情况,同时选取54份不同年份、不同地区的PCV2阳性样本进行PCV2全基因组的扩增,从全基因组角度分析我国部分地区PCV2的分子特征,以期为该病毒的致病机制、疫苗研究和PCVAD的防控提供理论依据。
1 材料与方法
1.1 样 本
2012-2018年在福建、江西、广东、江苏及浙江等省规模化猪场采集疑似PMWS猪只的组织(淋巴结、脾脏、肾脏等)样本及血清样本,总计649份(福建278份,江西102份,广东98份,江苏90份,浙江81份),保存于-80 ℃冰箱备用。
1.2 试 剂
Universal Genomic DNA Extraction Kit、DNA Marker 2000、ExTaqDNA聚合酶和pMD19-T克隆载体,购自TaKaRa公司;普通琼脂糖凝胶DNA回收试剂盒,购自天根生化科技有限公司。
1.3 引 物
为了解PCV2各基因型的流行特点,参照文献[19-21]合成可以区分PCV2a、PCV2b、PCV2d和PCV2e的鉴别引物;参照文献[22-24]合成用于扩增PCV2全基因组的引物。上述引物均由北京睿博兴科生物技术有限公司合成。
1.4 PCV2 DNA的提取及基因分型检测
对649份样品进行PCV2特异性PCR扩增。组织(淋巴结、脾脏和肾脏等)样品和血清样品的DNA提取按照DNA提取试剂盒说明书进行。以提取的DNA为模板进行PCV2基因分型检测,同时设不加模板的阴性对照。PCR反应体系25.0 μL:10×EXTaqBuffer 5.0 μL,2.5 mmol/L dNTP 2.0 μL,DNA模板2.0 μL,10 mmol/L PCV2a、PCV2b、PCV2d或PCV2e的上、下游引物各1.0 μL,EXTaq(5 U/μL) 0.25 μL,用ddH2O补至25.0 μL。PCR扩增程序为:95 ℃ 预变性4 min;94 ℃变性45 s,54.5~56.5 ℃(具体温度依引物而定,见参考文献[19-21])退火45 s,72 ℃ 延伸60 s,35个循环;72 ℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳检测。
1.5 PCV2全基因组序列的扩增与分析
选取54份检测阳性的样品(福建21份,江西9份,广东9份,江苏8份,浙江7份)进行PCV2全基因组的扩增。PCR反应体系25.0 μL:10×EXTaqBuffer 5.0 μL,2.5 mmol/L dNTP 2.0 μL,DNA模板2.0 μL,10 mmol/L PCV2全基因组的上、下游引物各1.0 μL,EXTaq(5 U/μL) 0.25 μL,用ddH2O补至25.0 μL。PCR扩增程序为:95 ℃预变性4 min;94 ℃变性45 s,50~55 ℃(具体温度依引物而定,见参考文献[22-24])退火45 s,72 ℃ 延伸120 s,35个循环;72 ℃延伸10 min。同时设不加模板的阴性对照。PCR产物用1%琼脂糖凝胶电泳检测。通过胶回收试剂盒回收纯化PCR产物并克隆至pMD-19T载体,转化至大肠杆菌感受态细胞DH5α。对转化后的菌液进行PCR鉴定,并提取质粒进行BamH Ⅰ和Hind Ⅲ双酶切(pMD19-T载体的酶切位点)鉴定,将鉴定正确的阳性重组菌株送往北京睿博兴科生物技术有限公司测序。利用DNAStar软件对54株PCV2全长序列与国内外19株PCV2参考毒株序列进行全基因组同源性比对分析及Cap蛋白氨基酸序列比对;利用Mega 6.0软件对PCV2全基因组及ORF2基因进行遗传进化分析;利用Simplot 3.51软件和RDP 4.24重组分析软件对本研究中54株PCV2进行重组分析。
2 结果与分析
2.1 PCV2基因分型检测结果
PCR检测结果(表1)表明,649份样品中有272份为PCV2阳性,阳性率为41.9%(272/649),表明猪群感染PCV2较为普遍,应当引起重视。在PCV2阳性样品中,PCV2a检出率为12.5%(34/272),PCV2b检出率为24.3%(66/272),PCV2d检出率为67.6%(184/272),PCV2e检出率为1.1%(3/272);部分猪场存在2种基因型毒株,检出率为5.5%(15/272)。
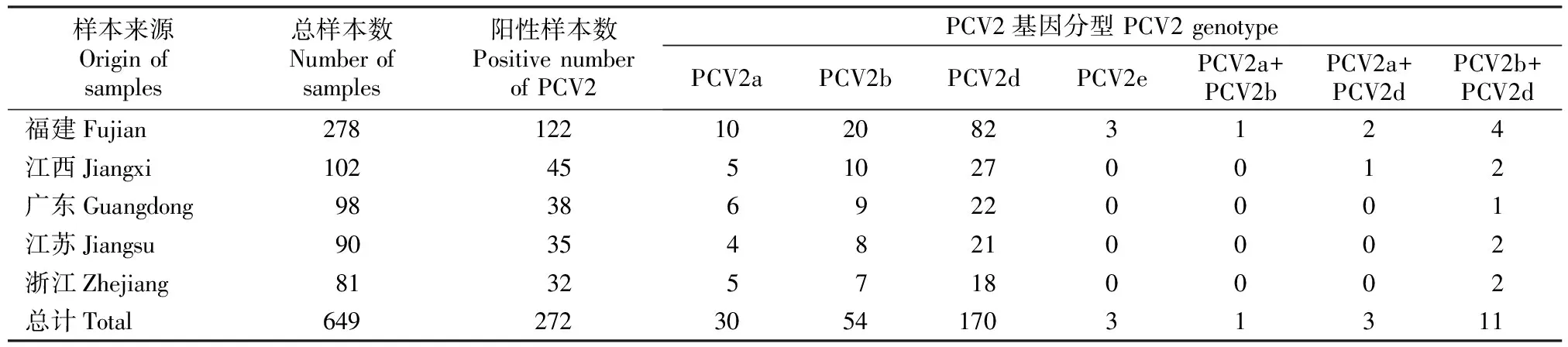
表1 2012-2018年中国东南地区规模化猪场的PCV2检测结果Table 1 PCV2 genotypes identified in 649 samples obtained from pig farms in Southeast China from 2012 to 2018
2.2 PCV2全基因组序列分析
全基因组序列分析结果显示,PCV2基因组长度为1 766~1 777 bp;尤其值得注意的是,本研究在福建省发现了新基因型PCV2e,其基因组全长为1 777 bp,与PCV2其他基因型序列差异较大。将54株PCV2全基因序列与国内外19株参考毒株进行同源性比较和遗传进化分析,结果表明54株PCV2全基因序列核苷酸同源性为91.6%~99.9%,基因组之间差异性较大,与PCV2a代表毒株SZ-AY(181948)、BF(AF381175)、AF055392、DQ397521的核苷酸同源性为91.2%~99.5%,与PCV2b代表毒株Zhuji2003(AY579893)、France(AF055394)、GD-TS(AY181945)、NL Control 1(AY484407)和16845(EU340258)的核苷酸同源性为91.0%~99.9%,与PCV2c代表毒株DK1980PMWSfree(EU148503)、DK1987PMWSfree(EU148504)和DK1990PMWSfree(EU148505)的核苷酸同源性为92.5%~95.0%,与PCV2d代表毒株BDH(HM038017)、22625-33(JX535296)、Shenzhen02(HQ113117)和TJ-AY(181946)的核苷酸同源性为92.5%~100%,与PCV2e代表毒株USA-45358(KT795290)、MEX-41238(KT795287)的核苷酸同源性为91.3%~99.7%。
将54株PCV2全基因组序列与19株国内外参考毒株进行比对构建系统遗传进化树,结果(图1)表明,54株PCV2分为PCV2a、PCV2b、PCV2d和PCV2e 4个基因型,其中6株属于PCV2a基因型,16株属于PCV2b基因型,2株属于PCV2e基因型,其余30株分离毒株属于PCV2d基因型。
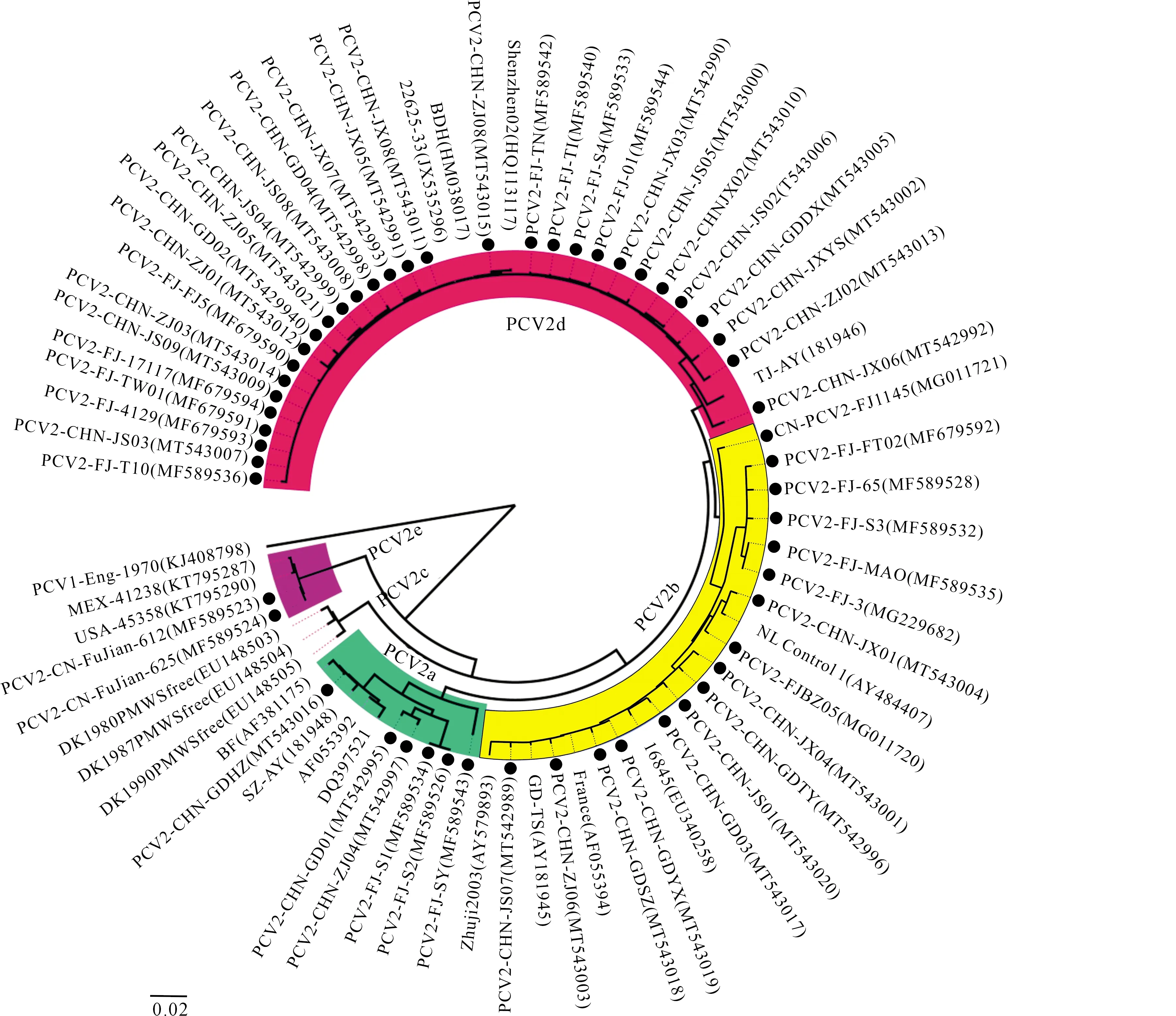
●代表本研究毒株;括号内为序列的GenBank登录号。下图同●indicate virus in this study;The data in brackets is the GenBank accession number of sequence.The same below
2.3 PCV2 ORF2序列分析
对54株PCV2 ORF2基因序列进行分析可知,基因长度为702 bp的有23株,为705 bp的有29株,为717 bp的有2株。
将54株PCV2 ORF2基因序列与国内外19株参考毒株的ORF2基因序列进行同源性比较和遗传进化分析,结果显示54株PCV2 ORF2基因序列的核苷酸同源性为81.8%~100%,差异性较大,其中与PCV2a代表毒株SZ(AY181948)、BF(AF381175)、AF055392、DQ397521的核苷酸同源性为81.5%~99.3%,与PCV2b代表毒株Zhuji2003(AY579893)、France(AF055394)、GD-TS(AY181945)、NL Control 1(AY484407)和16845(EU340258)的核苷酸同源性为84.8%~99.6%,与PCV2c代表毒株DK1980PMWSfree(EU14-8503)、DK1987PMWSfree(EU148504)和DK1990-PMWSfree(EU148505)的核苷酸同源性为84.8%~90.7%,与PCV2d代表毒株BDH(HM038017)、22625-33(JX535296)、Shenzhen02(HQ113117)和TJ(AY181946)的核苷酸同源性为84.0%~100%,与PCV2e代表毒株USA-45358-2015(KT795290)、MEX-41238-2014(KT795287)的核苷酸同源性为81.6%~99.9%。
将54株PCV2 ORF2序列与国内外19株参考毒株的ORF2序列进行比对并构建系统遗传进化树,结果(图2)表明基于ORF2核苷酸序列所绘制的遗传进化树结果与基于 PCV2 全长基因组的结果基本一致,即54株PCV2可分为4个基因型,属于PCV2a、PCV2b、PCV2d和PCV2e的毒株数分别为6,16,30和2株,说明PCV2d基因型为猪场的优势毒株。
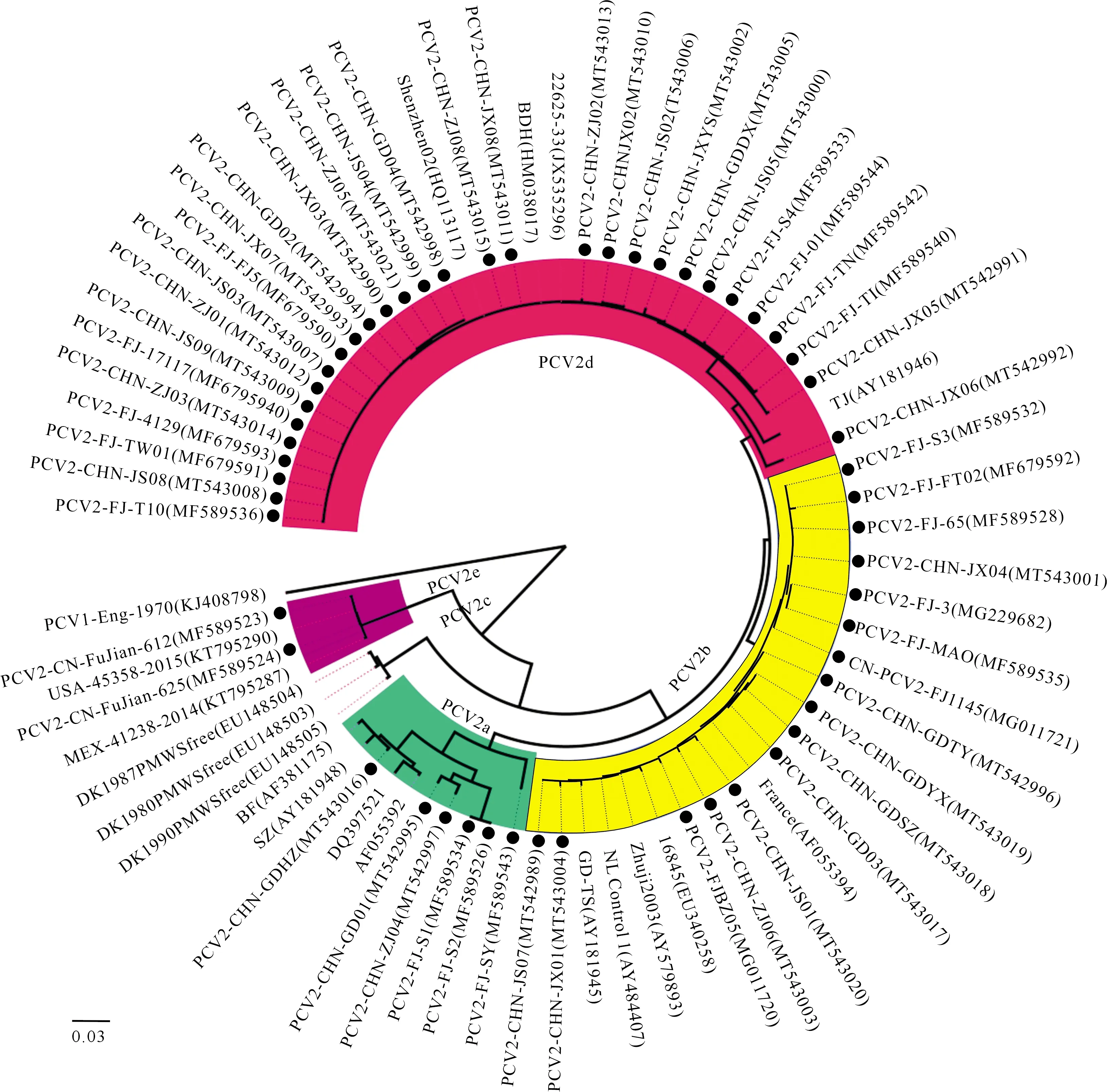
图2 基于ORF2基因的PCV2遗传进化分析Fig.2 Phylogenetic trees based on sequences of PCV2 ORF2 sequences
2.4 PCV2 Cap蛋白序列分析
本研究54株PCV2基因编码的Cap蛋白长度为233个氨基酸的有23株,为234个氨基酸的有29株,为238个氨基酸的有2株,氨基酸同源性为82.1%~100%,与参考毒株的氨基酸同源性为81.6%~100%。
对54株PCV2 Cap蛋白的氨基酸序列进行分析,结果表明不同基因型PCV2 Cap蛋白差异显著,同一基因型毒株则存在一些特征性的突变位点(图3)。
由图3可以看出,与其他PCV2基因型毒株相比,PCV2a基因型的毒株主要发生了N77D、V91I和T151P突变,PCV2b基因型的毒株主要发生了V57I、L89R和D210E突变,PCV2d 基因型的毒株主要发生了F53I和A68N突变。PCV2e基因型毒株ORF2基因全长为717 bp,是编码238个氨基酸的Cap 蛋白,与PCV2a~PCV2d核苷酸和氨基酸的同源性较低(约为85%),主要发生了K58V、K59T、N77G、T131N、A133T、A135N、T137S、T170I、V196T、N204H、Y207L和L226M突变。
此外,5个PCV2基因型中Cap蛋白唯一的糖基化位点NYS(143-145位氨基酸)非常保守,没有发生突变。
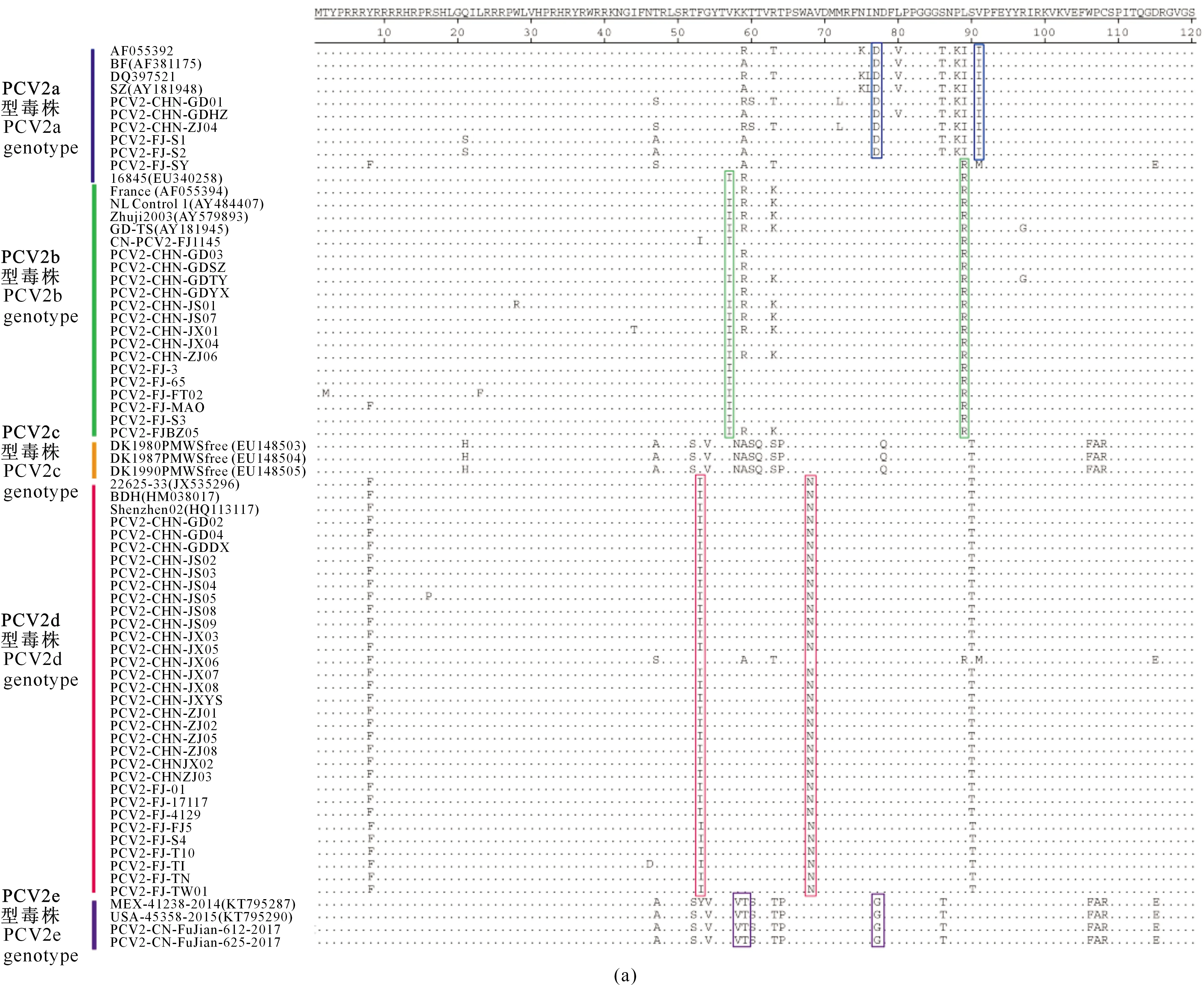
方框示氨基酸主要突变情况,灰色部分标示糖基化位点The regions marked with solid box are representative mutation sites. Experimentally confirmed glycolysation sites are marked with grey rectangles
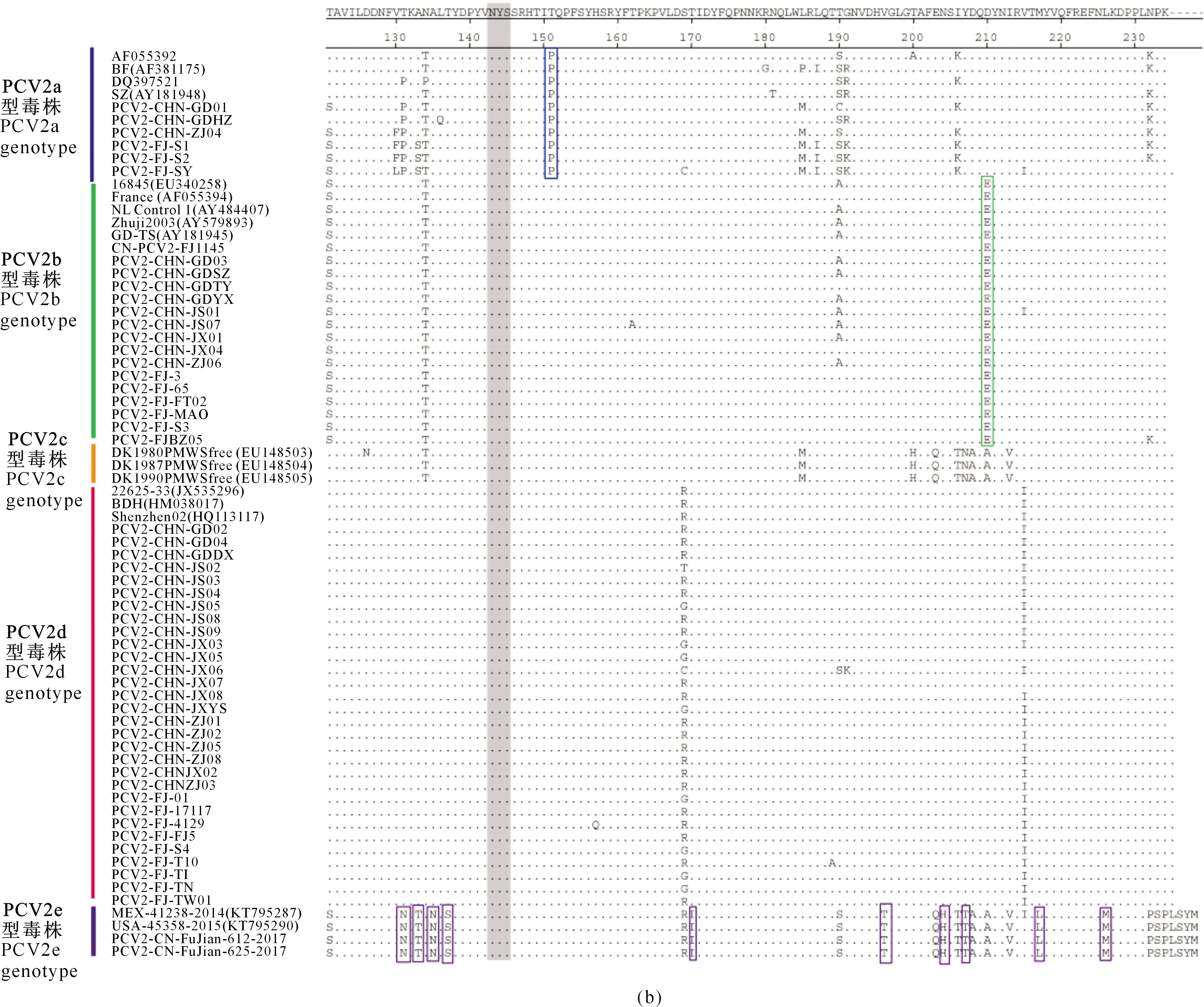
图3 PCV2 Cap蛋白氨基酸多序列比对分析(续)Fig.3 Multiple alignment of amino acid sequences of PCV2 Cap protein (continued)
2.5 PCV2重组分析
重组分析结果表明,CN-PCV2-FJ1145毒株来自PCV2b基因型毒株(代表毒株Zhuji2003)和PCV2d基因型毒株(代表毒株BDH)的自然重组,PCV2-FJBZ05毒株来自PCV2a基因型毒株(代表毒株AF055392)和PCV2b基因型毒株(代表毒株Zhuji2003)的自然重组。经重组检测软件分析,CN-PCV2-FJ1145重组位点(nt 1 040、nt 165) 和PCV2-FJBZ05重组位点(nt 1 061)均发生在ORF2 区域。基于重组区域序列构建的进化树进一步证实了重组的可能性,重组毒株CN-PCV2-FJ1145和PCV2-FJBZ05在基因组断裂点前后的不同区域分别处于遗传进化树中不同的进化分支,CN-PCV2-FJ1145在基因组断裂点两侧的碱基序列(nt 1-1 040和nt 1 652-1 794)与PCV2d基因型毒株处于同一进化分支(图4-A),而基因组裂点之间的碱基序列(nt 1 041-1 651)与PCV2b基因型毒株处于同一进化分支(图4-B)。PCV2-FJBZ05在基因组断裂点前的碱基序列(nt 1-1 061)与PCV2a基因型毒株处于同一进化分支(图4-C),而基因组断裂点后的碱基序列(nt 1 062-1 794)与PCV2b基因型毒株处于同一进化分支(图4-D)。
3 讨 论
PCV2是引起PCVAD的主要病原,给各国养猪业造成了严重的经济损失[4-6,24-29]。研究表明,PCV2侵入动物机体后,主要破坏猪的免疫系统,导致机体出现免疫抑制,从而引起PCV2与其他病毒混合感染,增加猪只的发病率和死亡率。PCV2于2000年在我国大陆首次被检测到,随后该病迅速蔓延至全国,成为我国规模化养猪场主要疫病之一。东南地区是我国重要的生猪产业基地,因此研究该区域猪场PCV2的流行特征具有非常重要的意义。本研究对2012-2018年从福建、江西、广东、江苏及浙江等省规模化猪场疑似PMWS猪只收集的组织样本(淋巴结、脾脏、肾脏等)及血清样本,采用PCR方法进行系统检测,结果表明样本中PCV2的阳性率为41.9%(272/649),说明东南地区猪场PCV2感染已非常普遍,应引起猪场高度重视,加强对PCV2的防控。
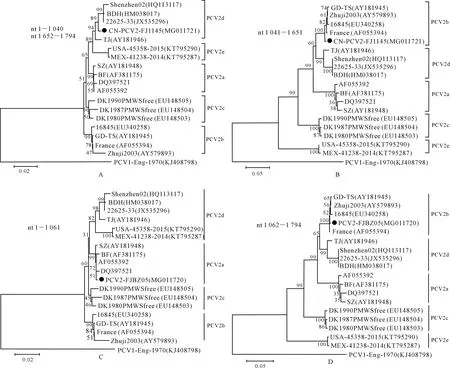
A.基于CN-PCV2-FJ1145断裂点前(nt 1-1 040)后(nt 1 652-1 794)序列的聚类分析;B.基于CN-PCV2-FJ1145断裂 点之间(nt 1 041-1 651)序列的聚类分析;C.基于PCV2-FJBZ05断裂点前(nt 1-1 061)序列的聚类分析; D.基于PCV2-FJBZ05断裂点后(nt 1 062-1 794)序列的聚类分析A.Cluster analysis based on the sequence before (nt 1-1 040) and after (nt 1 652-1 794) the breakpoint of CN-PCV2-FJ1145;B.Cluster analysis based on the sequence between the breakpoint (nt 1 041-1 651) of CN-PCV2-FJ1145; C.Cluster analysis based on the sequence before the breakpoint (nt 1-1 061) of PCV2-FJBZ05; D.Cluster analysis based on the sequence after the breakpoint (nt 1 062-1 794) of PCV2-FJBZ05图4 CN-PCV2-FJ1145 和PCV2-FJBZ05毒株的分段遗传进化分析Fig.4 Incongruent phylogenetic trees between two strains(CN-PCV2-FJ1145 and PCV2-FJBZ05) and representative viruses
目前PCV2至少存在5种基因型,其中PCV2e是最近新发现的一种基因型毒株,其核苷酸序列与其他4种基因型毒株PCV2a~PCV2d的核苷酸序列差异较大,而PCV2c基因型毒株仅在少数国家流行。研究表明,PCV2基因组核苷酸替换情况为每年每位点1.2×10-3~6.6×10-3个替换,其突变率与单链RNA病毒相近[7,26-27]。新基因型PCV2e的出现进一步支持PCV2是目前变异速度最快的DNA病毒,但是该基因型病毒的复制和感染机制研究尚不清楚,需进一步研究。本研究表明,虽然我国东南地区猪场存在4种基因型毒株,但是以PCV2d型为主(67.6%),这与之前研究结果[28-29]相似。PCV2e基因型毒株检出率仅为0.46%(3/649),表明PCV2e在猪场流行范围较小,可能与其复制水平及传播能力较低有关[15]。PCV2可通过毒株之间的基因重组持续进化,导致变异毒株不断出现[27-31]。本研究发现,部分猪场存在2个或2个以上基因型毒株,这为毒株发生重组提供了可能,CN-PCV2-FJ1145和PCV2-FJBZ05可能来源于2种不同基因型毒株(PCV2b和PCV2d、PCV2a和PCV2b)之间的自然重组,导致PCV2持续进化,从而出现新的变异株。不同基因亚型PCV2重组产生的毒株的抗原性和复制能力会发生改变,这进一步加剧了PCV2的变异,为猪场防控PCV2带来严峻挑战[27-31]。
ORF2编码的衣壳蛋白即Cap蛋白,是病毒的主要结构蛋白,参与病毒的复制和宿主的免疫应答。研究表明,Cap蛋白部分氨基酸突变可能导致毒株抗原变异或致病力增强[12,30,32]。本研究测得54株Cap蛋白之间的氨基酸同源性为 82.1%~100%,与参考毒株的同源性为81.6%~100%,其中PCV2a、PCV2b、PCV2d型毒株与PCV2c和PCV2e型毒株的同源性较低。氨基酸序列分析表明,不同亚型毒株的Cap 蛋白差异明显,即使是同一基因型的毒株也存在一些代表性突变位点,这可能导致PCV2不断进化和变异毒株的出现[12,30,32]。与其他亚型毒株相比,PCV2e基因型毒株ORF2基因编码238个氨基酸,发生了K58V、K59T、N77G、T131N、A133T、A135N、T137S、T170I、V196T、N204H、Y207L和L226M突变,尤其是在抗体识别关键点N77G和Y207L的突变可能会影响PCV2 产生中和抗体的能力[33]。此外,所有基因型毒株Cap蛋白唯一的糖基化位点NYS(143-145位氨基酸)非常保守,未发生变异。目前,国内猪场为防控PCV2 感染接种的商品化疫苗多基于PCV2a和PCV2b基因型而研制,其是否会对新出现的PCV2e起到交叉保护作用,尚需深入研究。
4 结 论
我国东南地区猪场PCV2感染非常普遍,PCV2d为优势基因型,出现了新基因型PCV2e,但其检出率较低。部分猪场存在2个以上的毒株,应引起猪场高度重视,本研究为PCVAD的防控提供了参考依据。
