小麦条锈菌诱导的TaRRP4基因的克隆与表达
2021-12-17任惠文杨子璠郭双元张艳琴康振生张新梅
任惠文,杨子璠,郭双元,张艳琴,康振生,张新梅
(西北农林科技大学 a 生命科学学院,b 植物保护学院,c 旱区作物逆境生物学国家重点实验室,陕西 杨凌 712100)
RNA转录与降解密切影响生物体的生长发育,在真核细胞中,mRNA的成熟主要依靠两种途径,即5′→3′ RNA降解和3′→5′ RNA降解,这两种途径均起始于多聚腺苷-poly(A)尾部的脱腺苷化[1],随后5′→3′ RNA降解由5′→3′ RNA外切核糖核酸酶家族Xrn完成[2-3],3′→5′ RNA降解由多亚基3′→5′外切核糖核酸酶复合物——RNA外切体催化[4-5]。真核生物和古生菌的外切体均由六聚体核心和三聚体帽子结构组成[4,6]。外切体在人类、酵母和古细菌中,主要参与RNA的加工和降解过程,包括正常细胞质mRNA周转[7]、mRNA质量控制[8]和小非编码RNA的加工[9]。真核RNA外切体由9~11个不同蛋白组成,部分蛋白序列与细菌的3′→5′外切酶相似。其中RRP4亚基含有类核糖体蛋白S1 RNA结合结构域(S1)和K同源(K Homology,KH)RNA结合结构域,RRP4协同其他2个RNA结合亚基RRP40和CSL4形成外切体顶端帽子结构,不仅稳定了外切体结构,而且增加了其对多聚腺苷酸(polyA)底物的特异性结合及催化效率[6]。
RNA加工过程中防御基因的调节是植物免疫的一个重要方面,RNA结合蛋白含有RNA结合结构域(RNA binding domain,RBD),通过与RNA互作形成复合体,直接或间接参与RNA加工过程[10]。KH结构域是最常见最丰富的RNA结合结构域,在人源核不均一核糖核蛋白K(hnRNPK)中最先发现[11],其广泛存在于古细菌、细菌和真核生物中[12],大约包含70个氨基酸,通过识别RNA或ssDNA参与多种生物学过程,如选择性剪接、控制翻译等[13]。含有3个KH结构域的马铃薯RNA结合蛋白StKRBP1能与晚疫病菌(Phytophthorainfestans)效应子Pi04089互作,过表达StKRBP1能够促进晚疫病菌侵染马铃薯叶片;当StKRBP1 KH结构域上的RNA识别位点GXXG突变为GDDG时,StKRBP1会失去识别和结合RNA的能力,影响植物的可变剪接,进而抑制晚疫病菌对马铃薯叶片的侵染[14]。作为免疫负调控因子,马铃薯RNA结合蛋白StKH17同样能促进晚疫病菌侵染[15]。U-box类E3泛素连接酶StPUB17可以正调控马铃薯对晚疫病菌的抗性[16]。Mclellan等[15]通过酵母双杂交和免疫共沉淀发现,StPUB17与StKH17相互作用,有可能将StKH17降解,从而提高马铃薯叶片对晚疫病菌的抗性。上述研究表明,含KH结构域的RNA结合蛋白在植物与病原菌的互作过程中发挥着重要作用。
小麦(TriticumaestivumL.)作为重要的粮食作物,养育了全球近40%的人口,而由条形柄锈菌小麦专化型(Pucciniastriiformisf. sp.tritici,Pst)引起的小麦条锈病严重影响小麦生产。因此,解析小麦与小麦条锈菌互作的分子机理,对小麦抗病品种的选育与合理利用至关重要。本研究以TaRRP4为候选目的基因,采用qRT-PCR技术分析该基因在小麦品种水源11与小麦条锈菌生理小种CYR23和CYR31互作及非生物胁迫、外源植物激素处理下的表达特征,以期为小麦与小麦条锈菌互作中该基因功能的验证以及小麦抗病育种提供参考。
1 材料与方法
1.1 供试材料
供试小麦品种为水源11(Suwon 11),供试小麦条锈菌菌种为条中23号(CYR23)和条中31号(CYR31),均由西北农林科技大学植物免疫团队提供。其中CYR23与水源11构成非亲和体系,CYR31与水源11构成亲和体系。
1.2 小麦RNA提取与cDNA合成
使用总RNA提取试剂盒(天根,北京)提取CYR23和CYR31诱导处理的小麦叶片总RNA。使用反转录试剂盒(Thermo Fermentas,美国)合成cDNA第一条链,引物使用Oligo d(T)18。
1.3 TaRRP4基因的克隆
在小麦与小麦条锈菌CYR23和CYR31构建的非亲和与亲和互作体系中,筛选出小麦TaRRP4基因的EST序列,结合NCBI(https://www.ncbi.nlm.nih.gov/)等公共数据库,得到目标基因序列。利用Primer Premier 5.0设计扩增引物TaRRP4-ORF-F(5′-ATGAGAGACCTCCACCTCCC-3′)和TaRRP4-ORF-R(5′-CCTCTTCTTTCCCAGGAGGT-3′),以1.2节反转录得到的cDNA为模板进行PCR扩增。PCR反应体系(40 μL)为:cDNA(200 ng/μL) 2 μL,2×Prime STAR Max DNA Polyme-rase(TaKaRa,大连)20 μL,TaRRP4-ORF-F/TaRRP4-ORF-R(10 μmol/L)各1 μL,ddH2O 16 μL。PCR反应程序为:98 ℃预变性5 min;98 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,37个循环;72 ℃延伸10 min,16 ℃保存。目标条带纯化后进行双向测序。引物合成和测序均由西安擎科泽西生物科技有限责任公司完成。
1.4 TaRRP4的生物信息学分析
用ProtParam(https://web.expasy.org/protparam/)对TaRRP4的理化性质进行在线分析;用NCBI(https://www.ncbi.nlm.nih.gov/Structure/cdd/cdd.shtml)分析TaRRP4的保守结构域;用Phobius(http://phobius.sbc.su.se/)分析TaRRP4的跨膜结构和信号肽;在NCBI blastp搜索TaRRP4的同源序列,然后使用MEGA 7软件构建TaRRP4的系统进化树,分析其亲缘关系;用DNAMAN6.0.40软件分析TaRRP4同源序列之间的保守性。
1.5 TaRRP4表达特征的分析
1.5.1 小麦苗培养 挑选600粒小麦种子,均匀撒播于装有育苗基质(莘县鲁源育苗基质有限公司)的花盆中,每盆12粒,置于16 ℃光照培养箱中培养(光/暗周期为16 h/8 h,光照强度20 000 lx)。
1.5.2 小麦条锈菌诱导处理 将150株生长至一叶一心的小麦等分为3组,参照康振生等[17]的方法给第1组和第2组分别接种CYR31和CYR23,第3组作为对照,只涂抹灭菌水。接种后,将小麦立即置于16 ℃恒温培养箱中黑暗保湿,24 h后正常培养。分别采集接种0,12,24,48,72,96和120 h的小麦叶片,在液氮中速冻,存储于-80 ℃冰箱,用于小麦条锈菌诱导下TaRRP4基因的表达特征分析。
1.5.3 非生物胁迫处理 将200株生长至一叶一心的小麦等分为5组,第1组和第2组分别使用200 mmol/L NaCl溶液和0.2 g/mL PEG6000溶液浇灌小麦,进行高盐和干旱胁迫处理(溶剂为霍格兰营养液);第3组将小麦置于4 ℃培养,作为低温处理;第4组使用消毒的刀片水平轻柔划割小麦叶片,进行机械损伤处理;第5组为对照组,使用霍格兰营养液处理[18]。分别采集处理后0,2,6,12,24和48 h的小麦叶片,在液氮中速冻,存储于-80 ℃冰箱,用于非生物胁迫下TaRRP4基因的表达特征分析。
1.5.4 外源植物激素处理 将200株生长至一叶一心的小麦等分为5组,前4组分别使用100 mmol/L脱落酸(abscisic acid,ABA)、100 mmol/L茉莉酸甲酯(methyl jasmonate,MeJA)、100 mmol/L乙烯利(ethrel,ETH)和2 mmol/L水杨酸(salicylic acid,SA)等体积均匀喷施于小麦及保湿桶四壁,16 ℃黑暗培养,溶剂均为体积分数0.1%乙醇;第5组作为对照组,使用体积分数0.1%的乙醇和吐温20混合液进行相同处理[18]。分别采集处理后0,2,6,12和24 h的小麦叶片在液氮中速冻,存储于-80 ℃冰箱,用于外源植物激素处理下TaRRP4基因的表达特征分析。
1.5.5 小麦组织采集 分别采集一叶一心小麦的第1叶、茎秆及根须在液氮中速冻,存储于-80 ℃冰箱,用于TaRRP4基因组织特异性表达特征分析,将小麦第1叶中TaRRP4基因的表达量作为对照。
1.5.6TaRRP4基因相对表达量测定 根据TaRRP4序列特点设计保守的定量引物TaRRP4-qF/TaRRP4-qR,选择TaEF-1α(GenBank:Q030-33)作为内参基因(表1)。使用qRT-PCR检测试剂盒(诺唯赞,南京),以1.2节反转录得到的cDNA为模板,用Bio-Rad CFX96定量仪(伯乐,美国)进行qRT-PCR。反应体系及程序参照qRT-PCR检测试剂盒说明书。试验进行3次生物学重复,用2-△△Ct法[18]对不同处理下小麦叶片和小麦不同组织的TaRRP4基因相对表达量进行分析。其中,TaRRP4基因的相对表达量是指不同处理下,各个时间点试验组与对照组中TaRRP4表达量的比值或者不同组织中TaRRP4表达量与对照(叶片)中TaRRP4表达量的比值。

表1 用于TaRRP4基因qRT-PCR的引物信息Table 1 Primer information for TaRRP4 gene qRT-PCR
2 结果与分析
2.1 TaRRP4基因的克隆与生物信息学分析
2.2.1TaRRP4基因的克隆及理化性质 利用引物TaRRP4-ORF-F/TaRRP4-ORF-R扩增得到小麦TaRRP4基因序列,其全长951 bp(图1),编码316个氨基酸。使用ProtParam对TaRRP4的理化性质进行分析表明,TaRRP4蛋白的分子质量为35.6 ku,等电点为6.6。

M.DL5000 DNA Marker;A.TaRRP4 PCR 扩增产物M.DL5000 DNA Marker;A.Amplification product of TaRRP4 gene图1 TaRRP4基因的扩增Fig.1 TaRRP4 amplification
2.2.2 TaRRP4蛋白结构的预测 使用NCBI对TaRRP4保守结构域进行预测,结果(图2)显示,TaRRP4属于外切体亚基RRP4家族,包含S1(第91-162位氨基酸)和KH(第180-305位氨基酸)2个RNA结合结构域及1个保守的RNA识别位点GXXG(第210-213位氨基酸),S1和KH结构域由保守的KYGKL连接。此外,使用Phobius对TaRRP4蛋白进行跨膜结构和信号肽分析,结果表明,该蛋白无信号肽,在第250-275氨基酸处可能有1个跨膜结构,但概率极低。

图2 TaRRP4保守结构域分析Fig.2 Conserved domain analysis of TaRRP4
2.2.3 TaRRP4及其同源蛋白序列分析 在NCBI blastp搜索TaRRP4的同源蛋白序列并使用MEGA 7进行聚类分析,结果(图3)显示,小麦TaRRP4与节节麦(Aegilopstauschii)AtRRP4、大麦(Hordeumvulgare)HvRRP4、二穗短柄草(Brachypodiumdistachyon)BdRRP4同属一个大分支,其中与AtRRP4的亲缘关系最近,与HvRRP4、BdRRP4的亲缘关系次之。用DNAMAN6.0.40进行多序列分析发现,TaRRP4与其同源蛋白序列高度相似,均含有保守的S1和KH结构域。其中TaRRP4与拟南芥(Arabidopsisthaliana)AtRRP4p的氨基酸序列相似性为62.96%。

括号中为各物种基因登录号Genetic entry number of each species is shown inside brackets图3 TaRRP4同源蛋白的聚类分析Fig.3 Clustering analysis of TaRRP4 homologous proteins
2.3 TaRRP4在转录水平上的表达特征分析
2.3.1 小麦条锈菌诱导下TaRRP4的表达特征 利用qRT-PCR分析小麦条锈菌诱导下TaRRP4的表达特征,结果(图4)显示,与接种0 h相比,TaRRP4在接种CYR31后24,48和72 h表达极显著上调;之后随着接种时间的延长,其表达量逐渐降低。与接种0 h相比,TaRRP4在接种CYR23后48 h表达显著上调,但上调倍数较小;接种后其他时间点均无显著上调趋势。
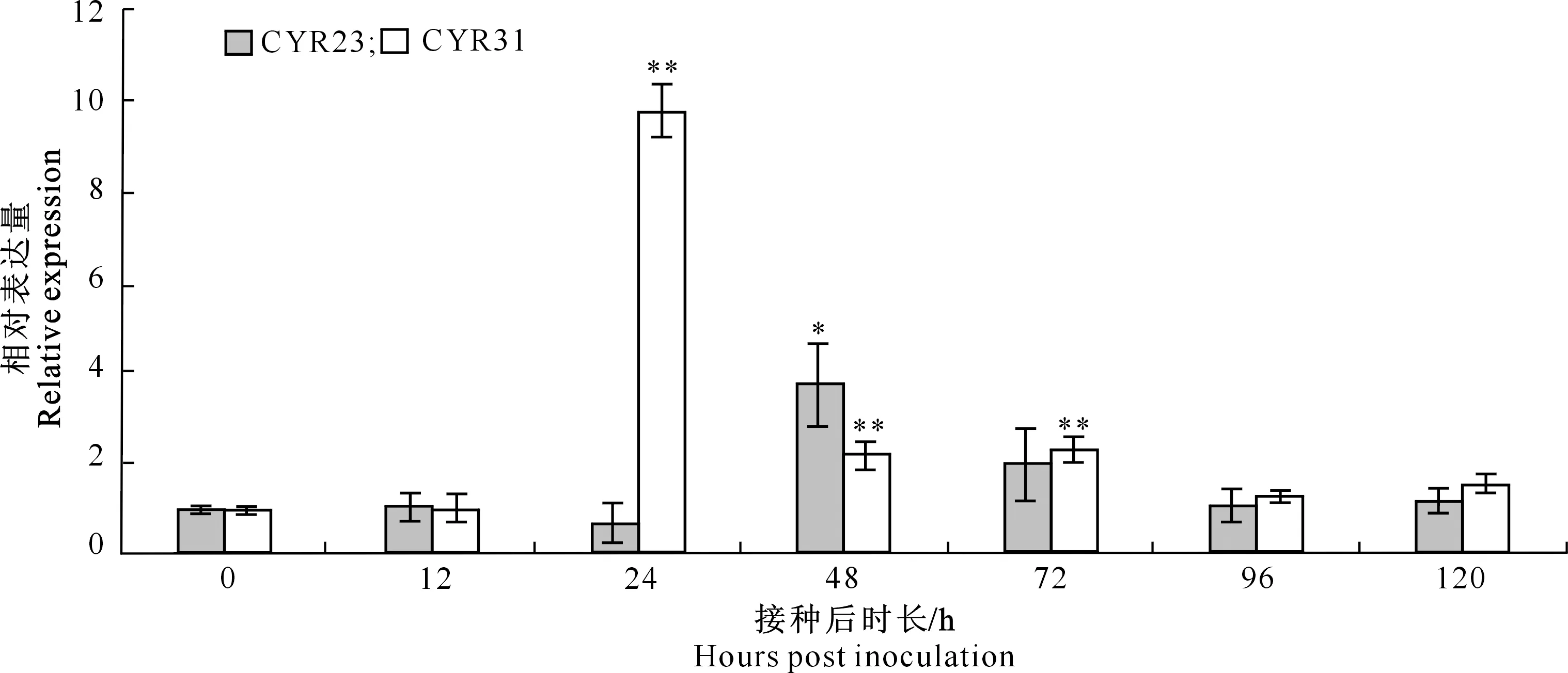
*和**分别表示与处理0 h相比,TaRRP4在各个时间点的相对表达量差异显著(P<0.05)和极显著(P<0.01)。下同* and ** show significant (P<0.05) and extremely significant (P<0.01) differences in TaRRP4 expression among time points compared with 0 h treatment,respectively.The same below图4 水源11接种小麦条锈菌后TaRRP4的表达特征Fig.4 Expression patterns of TaRRP4 in wheat Suwon 11 inoculated with Puccinia striiformis f. sp. tritici
2.3.2 非生物胁迫处理下TaRRP4的表达特征 对小麦进行高盐、干旱、低温和机械损伤处理,分析TaRRP4响应非生物胁迫时的表达特征。由图5可知,高盐胁迫下,TaRRP4的表达量在处理12 h极显著上调,约为0 h表达量的7倍;在处理48 h显著上调,约为0 h表达量的3倍。TaRRP4的表达量在干旱胁迫6 h上调表达最为显著,为干旱处理0 h表达量的29倍。与低温处理0 h相比,TaRRP4表达量在处理2 h开始极显著或显著上调,且维持时间较长,直至48 h表达量才降低。在机械损伤处理后,各时段TaRRP4的表达量无明显变化。

图5 非生物胁迫处理下TaRRP4的表达特征分析Fig.5 Expression analysis of TaRRP4 induced by abiotic stresses treatments
2.3.3 外源植物激素处理下TaRRP4的表达特征 使用ABA、MeJA、ETH和SA 4种外源植物激素处理小麦,分析TaRRP4响应激素信号的表达特征。由图6可知,与ABA处理0 h相比,ABA处理小麦2和6 h,TaRRP4表达量下调,但差异不显著;处理小麦12和24 h,TaRRP4的表达量极显著下调。MeJA处理各时段对小麦中TaRRP4表达量的影响均不明显。与ETH处理0 h相比,ETH处理小麦2 h后,TaRRP4的表达量呈极显著上调趋势,且在12 h达到最高,是对照表达量的10倍,处理24 h上调不显著。与SA处理0 h相比,SA处理小麦2~12 h,TaRRP4表达量呈极显著上调趋势,但上调倍数较低;处理24 h上调不显著。

图6 外源植物激素处理下TaRRP4的表达特征Fig.6 Expression analysis of TaRRP4 induced by exogenous plant hormone treatments
2.3.4TaRRP4的组织特异性表达 对TaRRP4在小麦不同组织中的表达量进行定量分析,结果(图7)表明,TaRRP4在小麦根、茎、叶中均有所表达,且在叶片中的表达量显著高于根和茎中。
3 讨 论
外切体是一类参与生物体内RNA加工或降解的3′→5′核糖核酸外切酶,在古细菌、酵母、动物、植物中均有发现[4,6,19-20]。而RRP4作为真核生物外切体亚基之一,可以协同其他2个RNA结合蛋白RRP40和CSL4稳定外切体结构,同时结合并帮助目的RNA进入外切体酶活性中心[6,21]。植物RRP4最早发现于含有AtRRP41p的复合体中,它与酵母RRP4p同源,包含S1和KH结构域,对植物生长发育十分重要[22]。在AtRRP4p缺失突变体中,拟南芥表现出不同发育阶段生长停滞现象,突变体产生的大多数种子含有双细胞胚和非细胞胚乳,在胚胎早期就已经停止发育,严重损害了合子的发育过程[23]。

**表示与叶片相比,不同组织中TaRRP4相对表达量 差异极显著(P<0.01)** indicates extremely significant differences (P<0.01) in relative expression of TaRRP4 between leaves and other tissues图7 TaRRP4的组织特异性表达分析Fig.7 Expression levels of TaRRP4 in leaves,roots and stems of wheat Suwon 11
本研究在小麦与小麦条锈菌互作体系中克隆到一个外切体亚基RRP4家族的基因TaRRP4,其编码的蛋白包含S1和KH 2个RNA结合结构域,与拟南芥AtRRP4p蛋白的氨基酸相似度达62.96%,推测TaRRP4对小麦的生长发育也十分重要。采用qRT-PCR对TaRRP4在小麦根、茎、叶中的表达量进行分析,发现TaRRP4在小麦组织中均有表达,但在叶片中表达量最高,暗示其主要在叶片中发挥作用。
RRP4具有RNA结合与外酶切活性[21-22],极有可能是响应植物免疫的重要组成成分。本研究在转录水平上,通过分析TaRRP4在小麦与小麦条锈菌互作中的表达谱,初步证实TaRRP4可能参与小麦对小麦条锈菌的防御反应。外源激素SA、ETH和ABA处理下,TaRRP4应答强烈,且早于对小麦条锈菌的应答,说明其可能通过SA、ETH和ABA信号途径的“交流”,介导小麦对小麦条锈菌的防御反应。其中,ETH诱导TaRRP4显著上调表达,推测TaRRP4是通过响应ETH信号途径,在小麦感条锈病过程中发挥正调节作用,这与ETH是番茄对镰刀菌感病性的正调节因子[24]相一致。
小麦条锈菌对TaRRP4的诱导主要发生在接种后24和48 h,前期研究表明,接种小麦条锈菌24 h,吸器大量形成,抗病基因表达,过敏性坏死明显;接种小麦条锈菌48 h,条锈菌生长发育在亲和与非亲体系间的差异开始明显[25]。因此,从小麦接种小麦条锈菌后TaRRP4的表达模式可以看出,TaRRP4在小麦对小麦条锈菌的防御反应中发挥作用。真核RNA外切体亚基RRP4主要结合RNA,通过RRP4外切体-底物互作机制使有效的RNA降解[21]。在小麦与小麦条锈菌互作过程中,TaRRP4蛋白结合哪个RNA序列,如何进行基因表达调控,尚有待深入研究。到目前为止,关于其他物种TaRRP4受高盐、干旱、低温和机械损伤的诱导情况鲜有报道,但是依据本研究可以推断,TaRRP4在植物抗逆过程中发挥重要作用,且作用范围广泛。
4 结 论
本研究克隆了小麦条锈菌诱导的小麦外切体亚基TaRRP4基因,该基因长951 bp,编码316个氨基酸。在小麦与小麦条锈菌互作中,TaRRP4基因在亲和体系中的表达量显著高于非亲和体系;外源激素SA、ETH和ABA参与并协同调控TaRRP4的表达;干旱、高盐和低温胁迫均诱导TaRRP4上调表达,推测其可能参与小麦的抗逆应答。
