忍冬褐斑病病原菌鉴定及生物学特征分析
2021-12-17孙承龙乔永刚路媛媛
李 丽,孙承龙,乔永刚,路媛媛
(1.山西农业大学生命科学学院,山西太谷030801;2.山西农业大学园艺学院,山西太谷030801)
忍冬(Lonicera japonica Thunb)属忍冬科忍冬属[1]。忍冬花是清火解毒的良品,对各种化脓性疾病均有一定的作用效果;忍冬藤对多种感染性疾病也有一定的疗效[2-4]。
随着忍冬种植面积的扩大,生态环境逐步恶化,忍冬感病率也逐渐上升[5]。褐斑病是忍冬叶部常见病害,发病初期,病斑呈黄褐色、点状;随着发病时期延长,病斑逐渐扩大,为圆形或多角形;严重时导致叶片枯黄、脱落,影响植株正常生长及开花,造成大面积减产[6-7]。褐斑病的发病时期为植株中后期,多发生在8—9月,高温高湿环境下发病较重,其病原菌的越冬场所多为病叶[8-10]。
目前,对于忍冬褐斑病的相关研究相对较少,大多数停留于褐斑病的物理和化学防治,如摘除病叶和适当修剪,用多菌灵、百菌清或用波尔多液喷雾防治,但未对其致原菌进行深入的研究。
本研究通过对引起忍冬褐斑病的病原菌的生物学特征进行系统研究,旨在为有效防治该病害提供理论依据。
1 材料和方法
1.1 试验材料
忍冬褐斑病病叶采集于山西农业大学生命科学学院中药试验田。
马铃薯葡萄糖培养基(PDA):马铃薯200 g,琼脂20 g,葡萄糖20 g,蒸馏水1 L;查氏培养基:硝酸钠2 g,磷酸氢二钾1 g,氯化钾0.5 g,七水硫酸镁0.5 g,硫酸亚铁0.01 g,蔗糖30 g,琼脂粉20 g,蒸馏水1 L[11]。
1.2 试验方法
1.2.1 病原菌的分离与鉴定 采用组织分离法对引起该病害的病原菌进行分离[12]。将病叶的病健交界处剪为1.0 cm×0.5 cm的小块,依次放入0.1%升汞消毒10 s、75%酒精消毒30 s,无菌水冲洗3次后,在无菌滤纸上吸干水分,放置于PDA培养基中,25℃培养2~3 d;待小叶片上长出病原菌,用镊子夹取少量菌丝,放置于新的PDA平板上培养5~7 d;产孢后,用消毒好的手术刀轻轻刮取少量菌丝,加入10 mL无菌水进行充分混合,过滤后用无菌水稀释,配制为1.0×107个/mL孢子悬浮液。涂布棒蘸取适量悬浮液,涂在PDA培养基平板上,挑取单孢进行纯化;纯化得到的病原菌参考SUTTON[13]和BOEREMA等[14]的方法进行形态学鉴定,4℃保存。
1.2.2 柯赫氏法则验证 将配置好的孢子悬浮液(1.0×107个/mL)对消过毒的健康叶片采用喷雾法接种,每10个叶片喷洒2 mL,对照组同时喷施蒸馏水[15],放置在铺有湿润滤纸的托盘中,25℃保湿2~3 d(期间喷洒营养液(6-BA),保持叶片的营养),7 d后观察叶片症状;当出现症状后,需要对病原菌重新分离培养(方法同1.2.1),将2次分离得到的菌株进行比对。
1.2.3 不同因素对菌丝生长和孢子形成的影响
1.2.3.1 碳源的影响 以PDA培养基为基础培养基,分别用相同量的蔗糖、果糖、D-甘露醇、木糖、可溶性淀粉替换其中的葡萄糖,以制成含有不同碳源的培养基。
菌丝生长测定方法:将病原菌在PDA培养基平板上培养5~7 d,在菌落边缘打取菌饼(直径9 mm)放置于待测培养基中央,25℃室温培养,每天同一时间段,对菌落的生长情况进行观察,采用十字交叉法[16],测定菌落直径并详细记录,每个处理重复3次。
产孢量测定方法:将病原菌在PDA培养基平板上培养5~7 d,使菌落生长成熟,得到供试接种病原菌;在超净工作台中,用9 mm金属打孔器在菌落边缘打取菌饼,用接种针将菌饼置于待测培养基平板中央,25℃培养5~7 d;用相同体积(10 mL)的无菌水进行冲洗,擦净纸过滤,血球计数板测定产孢量,每处理重复5次。
1.2.3.2 氮源的影响 以查氏培养基为基础培养基,分别用相同量的甘氨酸、蛋白胨、硝酸钾、硫酸铵、脲、苯丙氨酸替换其中的硝酸钠,以配成含有不同氮源的培养基。菌丝生长和产孢量测定方法同
1.2.3.1 。
1.2.3.3 pH的影响 用0.5 mol/L盐酸和1 mol/L氢氧化钠溶液调节PDA培养基的pH值,以1为间隔设置梯度,范围4~11。菌丝生长和产孢量测定方法同1.2.3.1。
1.2.3.4 光照条件的影响 将病原菌在PDA培养基平板上培养5~7 d,在菌落边缘打取菌饼(直径9 mm)放置于PDA培养基中央,将其置于全光照、光暗交替、黑暗3种条件下,25℃室温培养。菌丝生长和产孢量测定方法同1.2.3.1。
1.2.4 不同因素对孢子萌发的影响
1.2.4.1 碳源的影响 如1.2.3.1中的不同碳源先配制成浓度为1%的液体,再配制成1.0×108个/mL孢子悬浮液;取一滴孢子悬浮液于载玻片上,随后将有孢子悬浮液的一面朝下,放置在培养皿内的U形玻棒上,皿底用吸水滤纸,25℃保湿培养,经过8 h后镜检孢子萌发情况,每个重复观察100个孢子,并计算萌发率,每个处理设置3个重复。
1.2.4.2 氮源的影响 用1.2.3.2中的不同氮源配制成浓度均为1%的液体,培养和测定方法同1.2.4.1。
1.2.4.3 pH的影响 同1.2.3.3中用盐酸(0.5 mol/L)和氢氧化钠(1 mol/L)溶液调节无菌水pH值梯度为3.0~11.0,间隔为1。用上述梯度溶液配制成浓度为1.0×108个/mL的孢子悬浮液。培养和测定方法同1.2.4.1。
1.2.4.4 光照的影响 用无菌水配制浓度为1.0×108个/mL孢子悬浮液,将载玻片放置于全光照、光暗交替、黑暗3种条件下,25℃室温培养8 h后镜检孢子萌发率。培养和测定方法同1.2.4.1。
1.3 数据处理
采用软件SPSS 24.0对试验数据进行相关统计分析[17];并采用Ducan方法进行单因素方差分析,检验数据的差异显著性(P<0.05)。
2 结果与分析
2.1 病害症状描述
田间观察,叶片是褐斑病病害主要发生的部位;发病初期,叶片上的病斑不规则,颜色较浅,为淡黄色;发病中后期,叶片上的病斑范围逐渐扩大,为圆形或多角形,颜色变深,成深黄色至黄褐色,病健交界处明显(图1)。在湿度非常高的条件下,叶片会产生灰黑色霉状物,导致叶片破碎,穿孔,最后脱落。

2.2 柯赫氏法则结果
采用喷雾法对健康忍冬叶片进行人工接种,试验结果显示,接种3 d后叶片开始出现症状,发病初期为褪绿色小点,随后病斑变大呈圆形,褪绿色加重至黄色;随着接种时间的延长,7 d后多个病斑融合在一起,病斑面积逐渐增大,成倒三角形至不规则形,颜色由黄色变为黄褐色,病健交界处明显,而对照组无明显症状(图2)。人工接种产生的病害症状与在田间采集病害叶片的症状非常相似,从接种发病的植物上采用组织分离法重新分离病原菌,经鉴定,结果与田间植株上分离得到的相同。接种试验结果说明,供试分离得到的病原菌是引起忍冬褐斑病的病原菌。

2.3 病原菌鉴定结果
经柯赫氏法则确定的病原菌,在PDA上培养生长,约7 d长满皿(Φ=90 mm),菌落初期气生菌丝较多,稀疏,呈白色;随着培养时间的延长,气生菌丝变厚,呈绒状,菌丝颜色加深呈黄褐色(图3-A)。显微观察显示,病原菌孢子椭圆形至圆柱形,无色,单胞,无油滴,(3.6~6.0)μm×(2.0~3.1)μm(图3-B),分生孢子器埋生或半埋生在培养基中,呈褐色至黑褐色,球形或近球形,154~240 μm(图3-C)。参考SUTTON[13]和BOEREMA等[14]进行形态学鉴定,确定该病原菌为多喙茎点霉(Phoma multirostrata)。

2.4 不同因素对病原菌生长速率和产孢量的影响
2.4.1 碳源的影响 结果表明(表1),多喙茎点霉可以消耗多种碳源进行生长,但在不同碳源上生长速率和产孢量存在明显差异。在以甘露醇为碳源的培养基上,该病原菌的菌丝生长速率显著高于含有其他碳源的培养基(P<0.05),甘露醇为最适碳源;在以葡萄糖为碳源的培养基上生长速率最慢,且与其他碳源间差异显著(P<0.05)。在利用可溶性淀粉、果糖、木糖和蔗糖生长的菌丝无明显差异。在以葡萄糖为碳源的培养基上该病原菌的产孢量显著高于含有其他碳源的培养基(P<0.05),其产孢量大小为葡萄糖>木糖>蔗糖>果糖>甘露醇>可溶性淀粉。
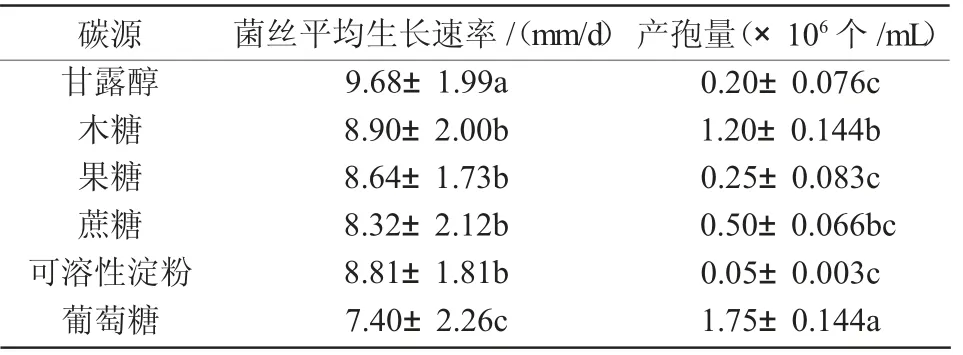
表1 不同碳源对多喙茎点霉菌丝生长和产孢量的影响
2.4.2 氮源的影响 多喙茎点霉可以在含有多种氮源的培养基上生长,但生长速率和产孢量有一定的差异。在以硝酸钠为氮源的培养基上,菌丝生长速率显著高于含有其他氮源的培养基(P<0.05),其次依次为蛋白胨、硝酸钾、甘氨酸、苯丙氨酸和脲,最不利于病原菌生长的氮源是硫酸铵(表2)。在以硫酸铵为氮源的培养基上该病原菌的产孢量显著高于含有其他氮源的培养基(P<0.05),其次依次为硝酸钾>硝酸钠>蛋白胨>甘氨酸>苯丙氨酸,多喙茎点霉在以脲为氮源的培养基上不产孢(表2)。

表2 不同氮源对多喙茎点霉菌丝生长及产孢量的影响
2.4.3 pH的影响 在本试验设置的不同pH值对多喙茎点霉的生长速率和产孢量均有影响。在pH值4~11的范围时,病原菌均可生长,但其生长速率存在明显差异,当pH值为5时,生长速率达到最大值,为8.43 mm/d,为该病原菌生长最适pH值;当pH值为7时,产孢量达到最大值,为1.33×106个/mL,且与其他pH值间差异显著(P<0.05),为该病原菌产孢的最适pH值(表3)。

表3 不同pH对多喙茎点霉菌丝生长和产孢量的影响
2.4.4 光照条件的影响 在不同的光照条件下多喙茎点霉都能生长。多喙茎点霉的产孢量在3种光照条件下无显著差异;但在全光照条件下,病原菌菌丝的生长速率显著高于其他2种光照条件(P<0.05)(表4)。

表4 不同光照条件对多喙茎点霉菌丝生长和产孢量的影响
2.5 不同因素对病原菌孢子萌发的影响
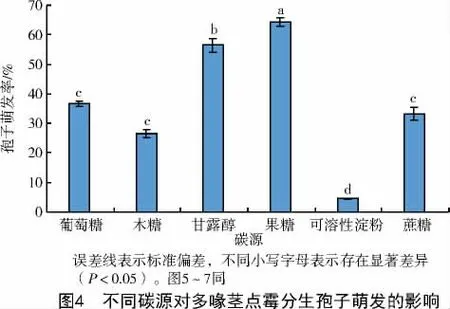
2.5.1 碳源的影响 图4结果显示,多喙茎点霉的分生孢子在不同碳源的溶液中萌发率存在较大差异。分生孢子在果糖中的萌发率显著高于其他碳源(P<0.05),为64.4%;甘露醇次之,为56.4%;病原菌在葡萄糖、蔗糖、木糖中的萌发率分别为36.7%、33.3%、26.5%;在可溶性淀粉中萌发率显著低于其他碳源(P<0.05),为4.5%。
2.5.2 氮源的影响 不同氮源对多喙茎点霉的萌发率有一定差异,但整体萌发率均不高。在硫酸铵中孢子萌发率显著高于其他氮源(P<0.05),为37.6%;其次依次为硝酸钾和硝酸钠,萌发率分别为26.1%和20.3%;在苯丙氨酸和甘氨酸中萌发率均低于10%;在蛋白胨和脲中分生孢子不萌发。表明苯丙氨酸、甘氨酸、蛋白胨和脲对多喙茎点霉的孢子萌发存在抑制作用(图5)。
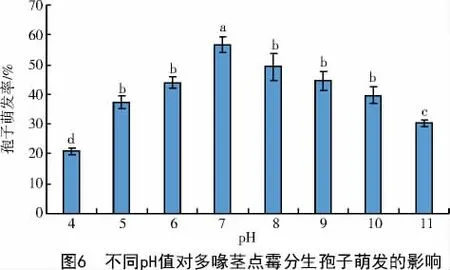
2.5.3 pH的影响 分生孢子在pH值4~11呈现规律性变化。在pH值4~7时,孢子萌发率逐渐升高,pH值为7时达到最大值,为56.7%,显著高于其他pH值(P<0.05);当pH>7时,孢子萌发率开始降低,pH值为11时降至30.3%;整个pH值梯度中,pH值为4时孢子萌发率最低,仅为21.0%。综上表明,孢子萌发最适pH值为6~8,过酸和过碱条件都不利于多喙茎点霉的孢子萌发(图6)。

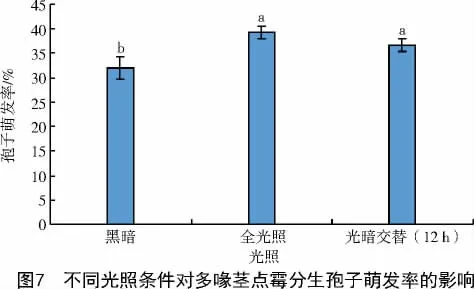
2.5.4 光照的影响 黑暗条件下多喙茎点霉的分生孢子萌发率显著低于全光照和光暗交替的条件(P<0.05),孢子萌发率为32.0%;在全光照和光暗交替的条件下,多喙茎点霉的分生孢子萌发率无显著差异,全光照下,多喙茎点霉的孢子萌发率较高,为39.3%(图7)。
3 结论与讨论
本试验通过组织分离法对忍冬褐斑病叶片进行病原菌分离,并利用显微技术对病原菌进行形态学鉴定,最终结合柯赫氏法则对病原菌进行验证,结果将忍冬褐斑病病原菌鉴定为多喙茎点霉(Phoma multirostrata),茎点霉属是半知菌亚门球壳孢目中的一个属[18];该属真菌分布广泛,寄主范围广[19],对环境的适应性较强,可以使茄子、马铃薯、番茄等农作物发生茎腐、枝枯、叶片和果实坏死,是一种分布较广的病原菌[20-22],严重影响农业生产和人民生活[22-24]。有文献报道,上海和宁波检疫局曾在进口的油菜、苹果苗和大豆中检疫出该菌[25-27];另外,该病菌还会引起多花筋骨草黑胫病[28-29]。
国内外对多喙茎点霉生物学研究较少,但针对茎点霉属其他病原菌研究较多,虽所属种不同,但在生物学方面存在相同之处,如引起苜蓿茎点霉叶斑病的苜蓿茎点霉(Phoma medicaginis)[30]和烟草茎点病的病原菌为广生茎点霉(Phoma omnivirens)[31]。研究表明,适合这2种病原菌菌丝生长和孢子萌发的最适pH值为6,最适碳源均为蔗糖、葡萄糖和果糖,这与本研究的适合多喙茎点霉产孢的研究结果相似。本研究最适多喙茎点霉生长的氮源为硝酸钠,而广生茎点霉生长的最适氮源为硝酸钾,硝酸钠和硝酸钾均属于硝酸盐。而对于光照的研究,2种病原菌与本研究的多喙茎点霉存在一定的差异,连续黑暗适合广生茎点霉的生长,但苜蓿茎点霉的研究结果与本研究相同,全光照利于菌丝生长和产孢,这可能是由茎点霉属之间不同种的差异或寄主的不同引起的。
另外,结合多喙茎点霉的侵染过程研究,应在秋天把病枝剪除,将落叶清理。在种植前,可以优先选择抗病品种,在种植过程中多注意修剪枝条,创造良好的通风条件,减少病害发生概率。种植时,选择非寄主进行间作套种,避免该菌因寄主广泛而导致交叉感染,进一步扩大危害甲基托布津、多菌灵和世高等能防治黑胫病、寡雄腐霉能有效抑制多喙茎点霉菌丝的生长[32-33],可用于病害防治。
近些年,随着忍冬市场需求急剧增大,很多地区开始大规模栽种忍冬,由于缺少科学的褐斑病病害防控措施,加之目前对忍冬褐斑病病原菌的研究甚少,造成植株减产,降低了种植户的收益。本试验的研究结果对忍冬褐斑病的鉴别和预防控制具有一定借鉴意义。
