胡芦巴丸调控氧化应激通路改善大鼠糖尿病肾病的实验研究
2021-12-16夏青松周俪珊吴凡巩静邹欣徐丽君董慧陆付耳
夏青松 周俪珊 吴凡 巩静 邹欣 徐丽君 董慧 陆付耳





摘要 目的:探討胡芦巴丸及其单味药抗氧化应激治疗大鼠糖尿病肾病(DKD)的分子机制。方法:采用高糖高脂饮食和尾静脉小剂量链脲佐菌素(STZ)的方法建立大鼠糖尿病肾病模型,将大鼠随机分为模型组、胡芦巴组、补骨脂组、胡芦巴丸组、卡托普利组,另设正常对照组,给予相应药物灌胃治疗16周后,检测血糖、血脂、血尿素氮(BUN)、血肌酐(SCr)、尿24 h总蛋白(UTP)、尿24 h尿白蛋白(UALB),光镜下观察肾脏形态学改变(HE染色、PAS染色、Masson染色)、电镜下观察肾脏超微结构改变,DHE染色评估肾脏组织超氧阴离子水平,浓度比色法检测肾组织烟酰胺腺嘌呤二核苷酸磷酸(NADPH)活性,Western Blotting检测肾脏组织磷酸化蛋白激酶C-α(PKC-α、NADPH氧化酶p47phox亚基、纤黏蛋白(Fibronectin)的表达水平,实时荧光定量PCR(RT-PCR)检测肾脏组织p47phox、PKC-α的mRNA表达水平。结果:与正常组比较,模型组大鼠血糖升高、血脂紊乱,24 h尿总蛋白及白蛋白水平均明显升高(P<0.001),肾小球体积增大、肾小球纤维化、细胞外基质增生、足细胞足突融合;与模型组比较,胡芦巴、补骨脂、胡芦巴丸组大鼠血糖水平下降,血脂紊乱改善,24 h尿总蛋白及白蛋白水平均明显下降(P<0.01),上述肾脏病理学改变明显减轻。与正常组比较,模型组大鼠肾组织DHE染色荧光强度明显升高,肾组织NADPH氧化酶活性、磷酸化PKC-α、p47phox、Fibronectin蛋白均明显升高(P<0.001);与模型组比较,胡芦巴、补骨脂、胡芦巴丸组大鼠肾组织DHE染色荧光强度明显降低,肾组织NADPH氧化酶活性、磷酸化PKC-α、p47phox、Fibronectin蛋白均明显降低(P<0.01),p47phox、PKC-α的mRNA表达水平降低(P<0.01)。与单味药比较,胡芦巴丸复方组在抗氧化应激,改善肾小球纤维化,降低血脂血糖优于胡芦巴组和补骨脂组。结论:胡芦巴丸通过抑制PKC-α/NADPH通路抗氧化应激以治疗糖尿病肾病。
关键词 胡芦巴丸;糖尿病肾病;氧化应激;磷酸化蛋白激酶-α;烟酰胺腺嘌呤二核苷酸磷酸氧化酶
Abstract Objective:To investigate the molecular mechanism of hu-lu-ba-wan and its single components in the anti-oxidative stress treatment of the diabetic kidney disease(DKD) in rats.Methods:A high-sugar and high-fat diet with intravenous injection of small dose of streptozotocin(STZ) was used to establish the diabetic kidney disease(DKD) model in rat.The rats were randomly divided into model group,TFG group,PC group,and Hu-lu-ba-wan group,captopril group,and a normal control group was set to compare.After 16 weeks of intragastric treatment with corresponding drugs,blood glucose,blood lipids,blood urea nitrogen(BUN),blood creatinine(SCr),and 24-hour urine total protein(UTP),24-hour urine albumin(UALB) were examined.HE staining,PAS staining,Masson staining were used to observe renal morphological changes and electron microscope was applied to observe kidney ultrastructural changes.The assess of the level of superoxide anion in kidney tissue was conducted by DHE staining and the activity of nicotinamide adenine dinucleotide phosphate(NADPH) in kidney tissue was detected using the concentration colorimetric method.Western Blotting was used to detect the expression level of phosphorylated PKC-α,NADPH oxidase p47phox subunit,Fibronectin protein in kidney tissue,and the mRNA expression levels of p47phox and PKC-α in kidney tissues were detected by real-time fluorescent quantitative PCR(RT-PCR).Results:Compared with the normal group,the rats in the model group had elevated blood sugar and dyslipidemia,and the 24 h urine total protein and albumin levels were significantly increased(P<0.001),and showed increased glomerular volume,glomerular fibrosis,and extracellular matrix proliferation and podocyte foot process fusion.Compared with the model group,the blood glucose levels decreased,dyslipidemia were improved,and 24-hour urine total protein and albumin levels significantly decreased in rats of the TFG group,PC group,and hu-lu-ba-wan group were significantly lower than the model group(P<0.01).Besides,the above-mentioned renal pathological changes were obviously reduced.Compared with normal group,the fluorescence intensity of DHE staining in the kidney tissue of the model group was significantly increased,and the NADPH oxidase activity,phosphorylated PKC-α,p47phox,and Fibronectin protein in the kidney tissue were distinctly enhanced in the model group(P<0.001).In comparison of model group,the fluorescence intensity of DHE staining in the kidney tissue of rats was significantly reduced and the NADPH oxidase activity,phosphorylated PKC-α,p47phox,and Fibronectin protein in the kidney tissue were significantly reduced(P<0.01),and mRNA expression levels of p47phox and PKC-α were reduced in the TFG group,PC group,and hu-lu-ba-wan group(P<0.01).Compared with the single components,the hu-lu-ba-wan group was better than the TFG group and the PC group in anti-oxidative stress,improving glomerular fibrosis,and lowering blood lipids and blood glucose.Conclusion:Hu-lu-ba-wan improves diabetic kidney disease by inhibiting the oxidative stress of PKC-α/NADPH pathway.
Keywords Hu-lu-ba-wan; Diabetic kidney disease; Oxidative stress; PKC-α; NADPH oxidase
中图分类号:R587.1文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.19.005
糖尿病(Diabetes Mellitus,DM)作为21世纪全球严重的公共健康问题,在中国糖尿病患者超过1.1亿,占全球糖尿病患者24%,患病率高达11.2%[1]。在DM起病的20~25年内,25%~40%的患者将发展为糖尿病肾脏病(Diabetic Kidney Disease,DKD)。DKD作为DM最严重的并发症之一,患病率呈逐年上升的趋势[2]。据流行病学调查资料显示,我国社区及三甲医院住院的人群中,DM已经超过肾小球肾炎,成为慢性肾脏病发病的主因,而且DM患者尿微量白蛋白升高等早期DKD表现一旦出现,进展为终末期肾病速度约为其他肾病的18倍,死亡风险增加4倍[2-3]。DKD早期症状隐匿,发病晚且难以逆转,目前缺乏有效的治疗方法。有资料证实高血糖及其所导致的氧化应激是DKD的发生发展中的关键因素[4-7]。因此,寻求具有抗氧化和降血糖双重作用的药物是治疗糖尿病肾病的关键。
中医认为糖尿病肾病属于“消渴病-肾虚证”,中草药及其有效单体在治疗2型糖尿病中发挥不容小觑的优势,广泛用于临床以降低血糖,改善临床症状,提高生命质量[8-9]。胡芦巴丸是由胡芦巴和补骨脂构成的治疗肾虚的方剂,而胡芦巴及补骨脂中有效成分具有降糖调脂,抗炎抗肿瘤,抗氧化应激等多重功效[10-13];在保护肾功能方面,胡芦巴中有效成分可降低谷氨酸脱氢酶和D-羟基丁酸脱氢酶的活性以阻止早期DKD肾脏结构异常[14],补骨脂中有效成分抑制酪氨酸蛋白磷酸酶1B的活性以调节胰岛素信号转导,减轻DKD的早期进展[15]。然而美中不足的是,上述研究局限于胡芦巴和补骨脂的单味药及其有效单体,而针对中药复方胡芦巴丸治疗DKD未见报道。因此本研究拟从抗氧化应激环节切入,探讨胡芦巴丸治疗糖尿病、保护肾功能的潜在机制。
1 材料与方法
1.1 材料
1.1.1 动物 选取SPF级雄性Wistar大鼠,体质量180~200 g,购自湖北省疾病预防控制中心(动物许可证编号:00018082),动物饲养于华中科技大学同济医学院实验动物中心屏障系统。饲养条件:温度为22 ℃左右,湿度为40%~60%,自然昼夜节律,12 h/12 h光照明暗交替,自由摄食饮水。食物为高糖高脂饲料,配方如下:基础饲料67.5%,猪油15%,糖15%,胆固醇2%,胆盐0.5%。
1.1.2 药物 胡芦巴和补骨脂饮片购自湖北省中药材公司(中国武汉)并由湖北中医药大学生药教研室(中国武汉)鉴定。根据古方记载,二者按照质量1∶1制备,大鼠用药剂量按照(中华人民共和国药典,2020版)体表面积与人用药剂量来计算,最终,1 g胡芦巴丸(分别含有0.5 g胡芦巴和0.5 g补骨脂)、1 g胡芦巴、1 g补骨脂分别获得1.32 mL、0.63 mL、0.66 mL中药药液。胡芦巴丸药液制备流程如下:将干燥的种子打成粉末,浸泡过夜后煎煮1.5 h,将煎煮液冷却至室温后,用95%乙醇按1∶1体积室温过夜醇提,用滤器收集沉淀物,将醇提液用旋转蒸发仪采用蒸馏法去除乙醇,并溶回沉淀物进一步浓缩。胡芦巴和补骨脂单味药药液制备方法同上。
1.1.3 试剂与仪器 总胆固醇(TC)(南京建成科技有限公司,货号:A111-1-1),三酰甘油(TG)(南京建成科技有限公司,货号:A110-1-1),低密度脂蛋白胆固醇(LDL-C)(南京建成科技有限公司,货号:A113-1-1),高密度脂蛋白胆固醇(HDL-C)(南京建成科技有限公司,货号:A112-1-1)生化试剂盒检测,血尿素氮和血肌酐试剂盒(南京建成科技有限公司,货号:C013-2-1、C011-2-1),NADPH活性定量检测试剂盒(上海杰美基因医药科技有限公司,货号:GMS50353.4),DHE粉末(碧云天生物技术研究所,货号:S0063),DMSO(Sigma公司,美国,货号:D8418),p47phox(Abcam公司,英国,货号:ab181090),p-PKC-α(Abcam公司,英国,货号:ab109539),PKC-α(Abcam公司,英国,货号:ab11723),Fibronectin(Abcam公司,英国,货号:ab2413),β-actin(Abcam公司,英国,货号:ab8226),山羊抗兔Dylight-800(KPL公司,貨号:ab201806),Trizol(TaKaRa公司,货号:740955.50),PrimeScript RT试剂盒(TaKaRa公司,货号:RR014B),SYBR Premix Ex Taq试剂盒(TaKaRa公司,货号:639676),95%乙醇(上海阿拉丁生化科技股份有限公司,批号:E111991)。旋转蒸发仪(BUCHI公司,瑞士,型号:R1020),生化分析仪(Roche公司,瑞士,型号:iMagic-M7),光学显微镜(Nikon公司,日本,型号:E100),血糖仪(Roche公司,瑞士,型号:罗氏精采型),Odyssey双色红外荧光成像系统(Odyssey公司,美国,型号:LI-COR Odyssey),核酸/蛋白分析仪(Thermo公司,美国,型号:NanoDrop ONEC),Applied Biosystems StepOne Real-Time PCR System(Applied Biosystems公司,美国,型号:4376599)。
1.2 方法
1.2.1 分组与模型制备 大鼠适应性喂养1周后,随机选择8只大鼠作为正常对照组(Normal组),给予普通饲料。剩下的大鼠给予高糖高脂饲料喂养4周,禁食12 h,尾静脉注射链脲佐菌素(STZ)(30 mg/kg),1周后采用口服葡萄糖耐量试验(OGTT)挑选出成模的大鼠,将成模大鼠随机分为模型组(Diabetic组)、胡芦巴组(TFG组)、补骨脂组(PC组)、胡芦巴丸组(HLBW组)及卡托普利组(Captopril组)(阳性药物对照),每组8只。
1.2.2 给药方法 药物组灌胃16周,灌胃剂量如下:胡芦巴组9 g/(kg·d),补骨脂组9 g/(kg·d),胡芦巴丸组18 g/(kg·d),卡托普利组10 g/(kg·d)。实验样品制备:所有实验大鼠在灌胃16周后,行OGTT实验,留取24 h尿液标本后处死。1%戊巴比妥钠50 mg/kg腹腔注射麻醉后,腹主动脉取血10~12 mL,3 000 r/min,离心半径10 cm,离心15 min,分离血清,于-80 ℃冰箱保存。取双侧肾组织,用磷酸盐缓冲液(PBS)冲洗后,右肾装入EP管中,-80 ℃保存,用于后续Western Blotting和实时荧光定量PCR(RT-PCR)检测;部分左肾用4%多聚甲醛固定,用于石蜡包埋;部分左肾用电镜液固定,用于透射电子显微镜观察肾小球的超微结构;部分左肾用于制作冰冻切片。
1.2.3 检测指标与方法
1.2.3.1 OGTT实验 大鼠于OGTT实验前禁食12 h,剪尾取第二滴血测空腹血糖,后给予50%葡萄糖2 g/kg灌胃,于灌胃后1 h和2 h再次剪尾取血测血糖值。成模条件:2个时间点血糖值高于相应时间点血糖正常范围(正常大鼠血糖值95%置信区间为正常范围)上限,或一个时间点血糖值高于相应时间点血糖正常范围上限20%,则认为造模成功。
1.2.3.2 生化指标检测 血糖使用血糖仪检测,采用葡萄糖氧化酶法测定。总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C),用生化试剂盒检测,方法参照说明书。血尿素氮和血肌酐采用比色法化学试剂盒进行,方法参照说明书。尿总蛋白和尿白蛋白用生化分析仪,采用免疫浊度法测定。
1.2.3.3 肾脏组织学形态检测 肾脏组织学形态检测包括:苏木精-伊红(HE)染色、过碘酸雪夫(PAS)染色、马松(Masson)染色,采用光学显微镜拍摄。HE染色用于观察肾小球形态,PAS染色用于观察肾小球基底膜厚度及系膜增生情况,Masson染色用于观察肾小球纤维化情况。
1.2.3.4 超氧离子水平及烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶活性检测 使用二氢乙啶(DHE)染色,DHE是一种活性氧荧光探针,可进入细胞内被活性氧所氧化,形成氧化乙啶,氧化乙啶掺入染色体DNA中,产生红色荧光,采用DHE染色检测个组大鼠肾组织超氧阴离子水平[16-17]。将5 mg DHE粉末溶解于317 μL DMSO以配置成50 mmol/L母液,将2 μL母液溶解于998 μL PBS中,稀释成500 μmol/L的工作液。每组取3张冰冻切片,平衡至室温,用免疫组化笔圈出组织区域,每个圈加入100 μL DHE工作液,置于37 ℃培养箱中避光孵育20 min,用磷酸盐缓冲液(PBS)清洗干净后,每个圈加入100 μL DAPI工作液,于37 ℃培养箱中避光染色5 min,再次用PBS清洗干净,在显微镜下观察。提取肾皮质总蛋白,按照NADPH活性定量检测试剂盒说明书进行实验。
1.2.4 Western Blotting检测 取30 μg总蛋白,用10% SDS-PAGE分离胶电泳,NC膜转膜,用5%脱脂奶粉或5%牛血清蛋白(BSA)室温封闭1 h,4 ℃过夜孵育一抗,p47phox、p-PKC-α、PKC-α、fibronectin、β-actin,TBST洗膜310 min后,室温避光孵育荧光二抗1 h,山羊抗兔Dylight-800,TBST避光洗膜310 min后,用Odyssey双色红外荧光成像系统扫膜,采用Quantity One软件分析条带。
1.2.5 RT-PCR检测采用Trizol和氯仿提取样本RNA,使用核酸/蛋白分析仪测定RNA样品纯度和浓度,用PrimeScript RT试剂盒按照说明书逆转录cDNA。采用SYBR Premix Ex Taq試剂盒,配置成20 μL体系,按照cDNA、引物混合液、荧光染料进行加样,根据说明书设置RT-PCR程序,预变性95 ℃:30 s,PCR 95 ℃:5 s,60 ℃:30 s,采用Applied Biosystems StepOne Real-Time PCR System。引物顺序见表1。
1.3 统计学方法
采用SPSS 19.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,采用单因素方差分析对各组数据进行比较,如果方差齐性采用LSD-t检验,如果方差不齐性采用Dunnett′s T3检验,以P<0.05为差异有统计学意义。
2 结果
2.1 胡芦巴丸及其单味药改善糖尿病大鼠的糖耐量(OGTT)
与正常组比较,模型组小鼠在空腹、1 h和2 h各时间点血糖明显升高,且曲线下面积明显大于正常组(P<0.01);与模型组比较,各药物处理组表现出良好的降低各时间点血糖水平,且曲线下面积明显小于模型组(P<0.01)。见图1A、1B。
2.2 胡芦巴丸及其单味药改善糖尿病大鼠血脂
模型组大鼠较正常组大鼠而言,表现出明显的血脂紊乱,血清TG、TC、LDL-C明显升高(P<0.01);与模型组比较,胡芦巴丸及胡芦巴能不同程度的降低TG、TC、LDL-C(P<0.01),而补骨脂组只能降低TG、TC(P<0.01),卡托普利组能降低TC(P<0.01)、LDL-C(P<0.01)。各组大鼠血清中HDL-C水平差异无统计学意义(P>0.05)。见图1C、1D、1E。
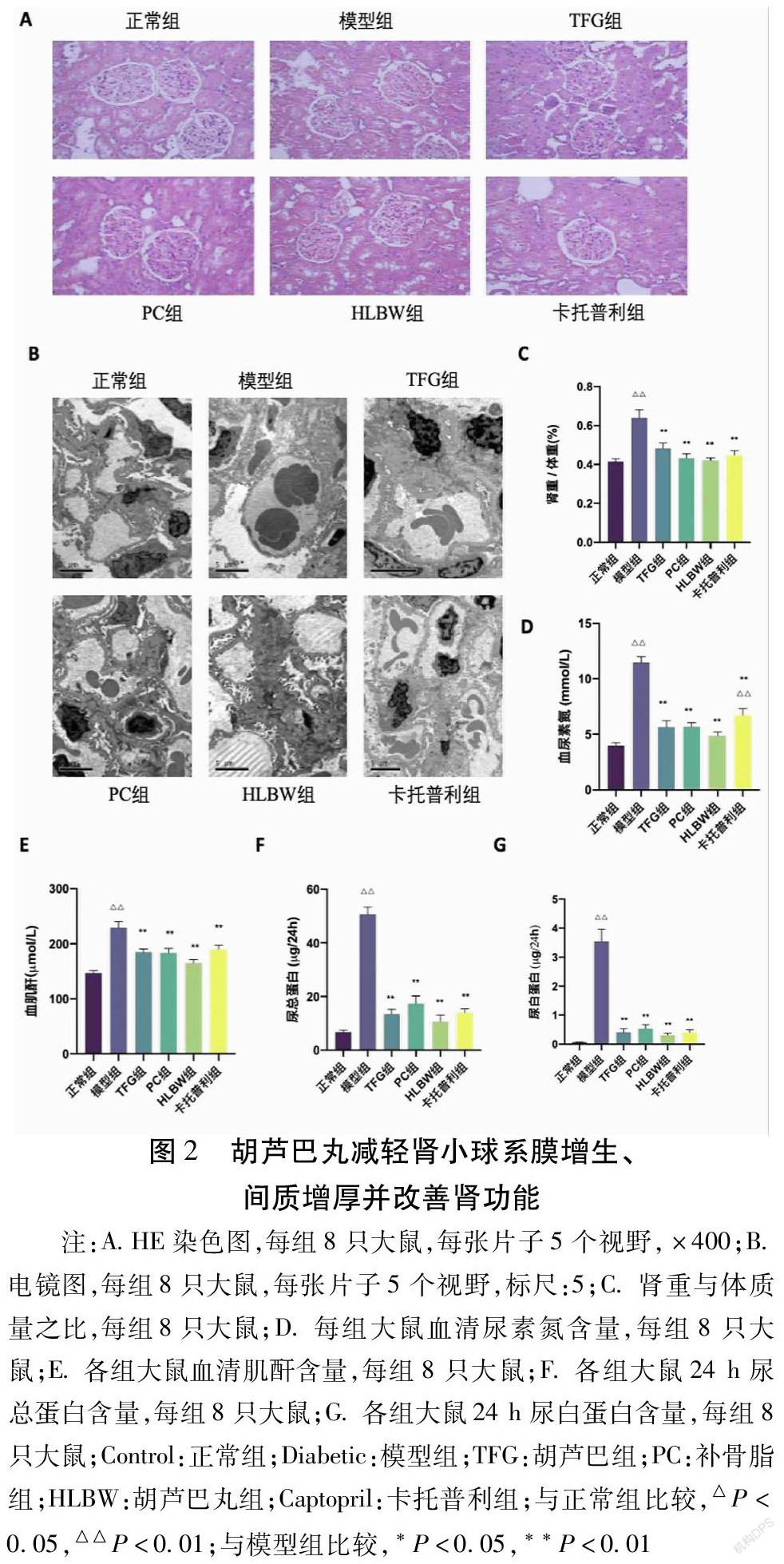
2.3 胡芦巴丸及其单味药减轻糖尿病大鼠蛋白尿,改善肾功能
在光学显微镜和电镜下观察,正常组HE染色显示肾小球、肾小管及间质未见明显病理改变;电镜下正常组未见肾小球、肾小管及间质结构异常。模型组HE染色显示出肾小管上皮细胞坏死脱落,少数区见有糖原沉着,肾小管上皮细胞透亮,肾小球体积增大;电镜下显示模型组肾小球足突节段性融合,灶状纤维增生。胡芦巴组、补骨脂组HE染色显示肾小管及间质未见明显病理改变。胡芦巴丸组HE染色显示肾小管及其间质未见明显改变,少数肾小球呈分叶状。卡托普利组HE染色镜下显示肾小球呈分叶状,肾小管糖原沉积,肾小管上皮细胞透亮。见图2A、2B。模型组大鼠肾重/体质量比例较正常组明显升高(P<0.01),血清尿素氮(BUN)、肌酐(SCr)、24 h尿总蛋白(UTP)和尿白蛋白(UALB)升高明显(P<0.01);在各药物处理组中,血清BUN、SCr、UTP、UALB明显较模型组降低(P<0.01),但各药物处理组间在大鼠肾重/体质量比例、血清BUN、SCr、UTP、UALB水平差异无统计学意义。见图2C、2D、2E、2F、2G。
2.4 胡芦巴丸及其单味药减轻糖尿病大鼠肾小球纤维化和氧化应激
正常组PAS染色显示肾小球毛细血管丛基底膜未见明显增厚,系膜区、基质未见增生;Masson染色显示肾小球、肾小管结构正常,毛细血管清晰,呈网状。模型组PAS染色见肾小球毛细血管丛基底膜增厚明显,系膜区、基质增生;Masson染色肾小球结构正常,有轻度纤维化。胡芦巴组PAS染色肾小球毛细血管从基底膜未见明显增厚,系膜区、基质部分增生,系膜细胞增多;Masson染色肾小球、肾小管结构基本正常,毛细血管清晰,呈网状,轻度纤维化。补骨脂组PAS染色显示肾小球毛细血管丛基底膜未见明显增厚,系膜区、基质增生;Masson染色显示肾小球肥大、纤维化明显。胡芦巴丸组PAS染色显示肾小球毛细血管丛基底膜未见明显增厚,系膜、基质区未见增生;Masson染色显示肾小球有轻度纤维化。卡托普利组PAS染色显示肾小球毛细血管丛基底膜未见明显增厚,系膜区、基质未见增生;Masson染色显示肾小球、肾小管结构正常,毛细血管清晰,呈网状。见图3A、3B。
氧化应激是DKD发展的重要因素,模型组大鼠肾组织中NADPH氧化酶活性较正常组明显升高(P<0.01),与模型组比较,胡芦巴丸组、胡芦巴组、补骨脂组、卡托普利组大鼠肾组织NADPH氧化酶活性均显著降低(P<0.01),胡芦巴丸组NADPH氧化酶活性是模型组的一半。在荧光显微镜下观察到模型组大鼠有明显的红色荧光显色。见图3C。与模型组比较,胡芦巴丸组大鼠肾脏组织红色荧光强度明显减弱;胡芦巴组、补骨脂组、卡托普利组大鼠肾脏组织红色荧光强度较模型组减弱,但其中胡芦巴丸组红色荧光强度减弱最明显。见图4。
2.5 胡芦巴丸及其单味药对p47phox、磷酸化PKC-α、Fibronectin蛋白和基因表达的影响 与正常组比较,模型组大鼠肾脏组织中p47phox蛋白及mRNA水平显著升高(P<0.01);与模型组比较,胡芦巴丸组、补骨脂组、卡托普利组大鼠肾脏组织中p47phox蛋白及mRNA水平明显降低(P<0.01);相对胡芦巴丸组而言,胡芦巴组、补骨脂组单味药降低p47phox蛋白及mRNA水平不及胡芦巴丸。见图5A、5B和5E。胡芦巴丸及其单味药可以明显降低p47phox蛋白及mRNA水平。与正常组比较,模型组大鼠肾脏组织中磷酸化PKC-α蛋白表达显著升高(P<0.01),与模型组比较,胡芦巴丸组、胡芦巴组、补骨脂组及卡托普利组大鼠肾脏组织中磷酸化PKC-α蛋白表达均明显降低;胡芦巴组和补骨脂组磷酸化PKC-α蛋白降低程度不及胡芦巴丸组。见图5A、5C。但各组之间PKC-α mRNA水平差异无统计学意义。见图5F。胡芦巴丸及其单味药可以明显降低PKC-α蛋白水平,但对mRNA水平差异无统计学意义。与正常组比较,模型组大鼠肾脏组织中Fibronectin蛋白表达水平显著升高(P<0.01);与模型组比较,胡芦巴丸组、胡芦巴组、补骨脂组及卡托普利组均能明显降低Fibronectin蛋白(P<0.05),然而胡芦巴丸降低Fibronectin蛋白水平较单味药明显。胡芦巴丸能明显降低Fibronectin蛋白水平,减轻DKD肾小球纤维化。见图5D。
3 讨论
胡芦巴丸是由胡芦巴和补骨脂组成的补肾中药复方,前期已有动物和临床试验均证实了胡芦巴具有潜在的降糖、调节脂质代谢和肾脏保护作用[10-11,14]。但是未见到有关胡芦巴丸及其单味药物治疗糖尿病肾病的研究。
本研究显示,采用高汤高脂饮食和小剂量STZ尾静脉注射的方法,可成功建立大鼠T2DM模型,该模型具有糖脂代谢紊乱的特点,表现为血糖升高、血脂升高;同时,该模型还表现出糖尿病肾病的特点,包括:血肌酐、血尿素氮、24 h尿总蛋白及白蛋白水平显著升高。本研究发现,胡芦巴丸不仅具有降低血糖、降低血脂的作用,还具有降低血肌酐、血尿素氮等保护肾脏的作用。而且胡芦巴、补骨脂单味药物观察组也显示出降糖调脂,保护肾功能的作用。
本研究进一步观察了胡芦巴丸对于肾脏形态学的影响。结果显示:模型组大鼠较正常组大鼠而言,肾小球体积增大、肾小球纤维化、系膜区及细胞外基质增生、足细胞足突融合。经胡芦巴丸及其单味药物治疗后,肾小球体积增大减轻,肾小球纤维化缓解,系膜区及细胞外基质增生减轻,足细胞足突融合不明显。以上结果进一步证实了胡芦巴丸具有肾脏保护作用,而且胡芦巴丸复方对肾脏形态学的改善作用较单味中药治疗的疗效更显著,尤其表现在改善肾小球纤维化的作用。我们观察到,胡芦巴丸在下调细胞外基质主体蛋白——纤黏蛋白(Fibronectin)表达的作用上更具有优势,说明胡芦巴丸对肾脏的保护作用可能通过缓解肾小球纤维化来实现。
在糖尿病的发生发展过程中,长期的高糖和高脂环境引发氧化应激,而氧化应激过程中所产生的自由基极易损伤肾脏组织的内皮细胞,同时又加重糖脂代谢紊乱,二者形成恶性循环,是糖尿病并发症的发病机制,尤其对DKD的贡献巨大[18-20]。氧化应激时机体产生大量的活性氧(Reactive Oxygen Species,ROS),不仅容易攻击脂质、核酸和蛋白质等生物大分子,引起氧化损伤,还作为第二信使的信号分子,严重干扰细胞的正常信号转导[21-22]。DHE是一种活性氧的荧光探针,因此DHE染色被广泛应用于反映组织氧化应激水平的评价指标。在超氧阴离子存在的条件下,DHE可被氧化,形成氧化乙啶,氧化乙啶可与细胞核的染色体DNA结合,产生红色荧光[23-25]。本研究显示,糖尿病大鼠肾脏组织中可观察到大量的超氧阴离子累积,而经过胡芦巴丸及其单味中药治疗后,超氧阴离子的水平可明显下降。同时,胡芦巴丸较单味中药对氧化应激的改善程度更明显,说明胡芦巴丸对肾脏的保护作用可能与其所具有的抗氧化应激活性有关。
为探讨芦胡巴丸发挥改善肾组织氧化应激作用的可能机制,本研究进一步就与ROS产生的相关因子,从基因及蛋白水平进行检测。高糖环境下的肾脏,其ROS主要来源于NADPH氧化酶,对糖尿病肾病的发生与发展起着决定性的作用[26]。由于蛋白激酶C-α(PKC-α)及活化过程中的关键亚单位p47phox是NADPH氧化酶的上游分子,因此本研究对NADPH活性做了定量检测,同时还观察NADPH氧化酶上游调节机制中关键因子的基因表达,包括:PKC-α、活化过程中的关键亚单位p47phox,蛋白及mRNA表達量的变化。结果显示:胡芦巴丸可显著抑制糖尿病大鼠肾组织中NADPH氧化酶的活性,降低p47phox基因的表达、磷酸化PKC-α蛋白的表达。同时,本研究亦发现,胡芦巴丸的上述下调作用,与单味中药的比较,效果更佳。但是,无论胡芦巴丸还是单味药,均表现出对PKC-α mRNA表达的调节作用。因此,本研究首次证实了胡芦巴丸及其单味药可能通过抑制PKC-α-NADPH氧化酶信号通路,从而实现减轻肾组织的ROS产生。
綜上所述,本研究证实了胡芦巴丸及其单味药(胡芦巴、补骨脂)对于2型糖尿病大鼠DKD的改善作用:抑制PKC-α-NADPH氧化酶信号通路,减轻氧化应激。此外,在肾脏保护作用、改善氧化应激方面,胡芦巴丸较单味药更具有优势,为中医理论体系中的“中药配伍”理论提供了一定基础。
参考文献
[1]Li Y,Teng D,Shi X,et al.Prevalence of diabetes recorded in mainland China using 2018 diagnostic criteria from the American Diabetes Association:national cross sectional study[J].BMJ,2020,369:m997.
[2]Palmer SC,Mavridis D,Navarese E,et al.Comparative efficacy and safety of blood pressure-lowering agents in adults with diabetes and kidney disease:a network meta-analysis[J].Lancet,2015,385(9982):2047-2056.
[3]Zhang L,Long J,Jiang W,et al.Trends in Chronic Kidney Disease in China[J].N Engl J Med,2016,375(9):905-906.
[4]Sávio-Silva C,Soinski-Sousa PE,Simplício-Filho A,et al.Therapeutic Potential of Mesenchymal Stem Cells in a Pre-Clinical Model of Diabetic Kidney Disease and Obesity[J].Int J Mol Sci,2021,22(4):1546.
[5]Kitada M,Ogura Y,Monno I,et al.Methionine abrogates the renoprotective effect of a low-protein diet against diabetic kidney disease in obese rats with type 2 diabetes[J].Aging(Albany NY),2020,12(5):4489-4505.
[6]Hartman RE,Rao P,Churchwell MD,et al.Novel therapeutic agents for the treatment of diabetic kidney disease[J].Expert Opin Investig Drugs,2020,29(11):1277-1293.
[7]Wu XQ,Zhang DD,Wang YN,et al.AGE/RAGE in diabetic kidney disease and ageing kidney[J].Free Radic Biol Med,2021,171:260-271.
[8]Ma L,Wu F,Shao Q,et al.Baicalin Alleviates Oxidative Stress and Inflammation in Diabetic Nephropathy via Nrf2 and MAPK Signaling Pathway[J].Drug Des Devel Ther,2021,15:3207-3221.
[9]Li Y,Guo S,Yang F,et al.Huayu Tongluo Recipe Attenuates Renal Oxidative Stress and Inflammation through the Activation of AMPK/Nrf2 Signaling Pathway in Streptozotocin-(STZ-) Induced Diabetic Rats[J].Evid Based Complement Alternat Med,2021,2021:5873007.
[10]Lu FR,Shen L,Qin Y,et al.Clinical observation on trigonella foenum-graecum L.total saponins in combination with sulfonylureas in the treatment of type 2 diabetes mellitus[J].Chin J Integr Med,2008,14(1):56-60.
[11]Broca C,Breil V,Cruciani-Guglielmacci C,et al.Insulinotropic agent ID-1101(4-hydroxyisoleucine) activates insulin signaling in rat[J].Am J Physiol Endocrinol Metab,2004,287(3):E463-E471.
[12]Tripathi UN,Chandra D.The plant extracts of Momordica charantia and Trigonella foenum-graecum have anti-oxidant and anti-hyperglycemic properties for cardiac tissue during diabetes mellitus[J].Oxid Med Cell Longev,2009,2(5):290-296.
[13]Jan S,Parween T,Siddiqi TO,et al.Anti-oxidant modulation in response to gamma radiation induced oxidative stress in developing seedlings of Psoralea corylifolia L[J].J Environ Radioact,2012,113:142-149.
[14]Thakran S,Siddiqui MR,Baquer NZ.Trigonella foenum graecum seed powder protects against histopathological abnormalities in tissues of diabetic rats[J]. Mol Cell Biochem,2004,266(1-2):151-159.
[15]Kim YC,Oh H,Kim BS,et al.In vitro protein tyrosine phosphatase 1B inhibitory phenols from the seeds of Psoralea corylifolia[J].Planta Med,2005,71(1):87-89.
[16]Kitamura O,Uemura K,Kitamura H,et al.Serofendic acid protects from iodinated contrast medium and high glucose probably against superoxide production in LLC-PK1 cells[J].Clin Exp Nephrol,2009,13(1):15-24.
[17]Cabrera JA,Ziemba EA,Colbert R,et al.Uncoupling protein-2 expression and effects on mitochondrial membrane potential and oxidant stress in heart tissue[J].Transl Res,2012,159(5):383-390.
[18]Manna P,Sinha M,Sil PC.Prophylactic role of arjunolic acid in response to streptozotocin mediated diabetic renal injury:activation of polyol pathway and oxidative stress responsive signaling cascades[J].Chem Biol Interact,2009,181(3):297-308.
[19]Manna P,Sinha M,Sil PC.Taurine plays a beneficial role against cadmium-induced oxidative renal dysfunction[J].Amino Acids,2009,36(3):417-428.
[20]Winiarska K,Szymanski K,Gorniak P,et al.Hypoglycaemic,antioxidative and nephroprotective effects of taurine in alloxan diabetic rabbits[J].Biochimie,2009,91(2):261-270.
[21]Jha JC,Banal C,Chow BS,et al.Diabetes and Kidney Disease:Role of Oxidative Stress[J].Antioxid Redox Signal,2016,25(12):657-684.
[22]Ren H,Shao Y,Wu C,et al.Metformin alleviates oxidative stress and enhances autophagy in diabetic kidney disease via AMPK/SIRT1-FoxO1 pathway[J].Mol Cell Endocrinol,2020,500:110628.
[23]Li S,Zhou C,Zhu Y,et al.Ferrostatin-1 alleviates angiotensin Ⅱ(Ang Ⅱ)-induced inflammation and ferroptosis in astrocytes[J].Int Immunopharmacol,2021,90:107179.
[24]Ni S,Qian Z,Yuan Y,et al.Schisandrin A restrains osteoclastogenesis by inhibiting reactive oxygen species and activating Nrf2 signalling[J].Cell Prolif,2020,53(10):e12882.
[25]Chen C,Wang D,Yu Y,et al.Legumain promotes tubular ferroptosis by facilitating chaperone-mediated autophagy of GPX4 in AKI[J].Cell Death Dis,2021,12(1):65.
[26]Gorin Y,Wauquier F.Upstream regulators and downstream effectors of NADPH oxidases as novel therapeutic targets for diabetic kidney disease[J].Mol Cells,2015,38(4):285-296.
(2021-08-10收稿 責任编辑:王明)
