聚硅氧烷皮肤组织黏接材料的设计合成与性能表征
2021-12-16陈炳刚刘三荣于喜飞蒋子江
陈炳刚,刘三荣,于喜飞,蒋子江
(1.中国科学院长春应用化学研究所高分子复合材料工程实验室,长春130022;2.中国科学技术大学,合肥230026;3.中国科学院长春应用化学研究所国家电化学和光谱研究分析中心,长春130022)
皮肤作为人体最大的器官,是人体抵御外来入侵的第一道屏障,具有调节体温、防止水分流失、感受外部刺激等作用,因此保持皮肤的完整性尤为重要.但在日常生活中,皮肤不可避免地会受到损伤,其中开放性伤口在较严重的情况下需要采取辅助性的闭合手段来促进伤口恢复[1,2].目前,外科手术缝合仍然是处理开放性皮肤伤口的主要方法,其虽然能够很好地闭合伤口,促进其愈合,但却存在会造成二次损伤、结节留疤及操作费时费力等缺点.因此,开发更有效的促进皮肤伤口愈合的方法是医用材料领域亟待解决的问题.
组织黏接剂是一类可以黏接皮肤、肌肉和骨组织等的材料[3~5],它利用与皮肤组织间形成的共价相互作用(如酰胺键、亚胺键及脲基等)[6~8]、非共价相互作用(如离子相互作用、氢键[9,10]、主客体相互作用[11,12]等)以及界面微观连接[13,14]等实现皮肤组织的黏接,具有传统缝合手段无法比拟的优势,如操作简单、不会造成二次损伤、环境适应性更好等,是一种潜在的替代缝合的方式[15,16].优异的组织黏接材料须满足如下性能:(1)力学性能足够好,与被黏接组织相容,能够提供力学支持;(2)黏接强度足够高,能够很好地将两部分组织黏合;(3)快速的原位固化过程,材料在接触组织后能够在短时间内交联成形,从而减少操作时间;(4)良好的生物相容性,无毒,无过敏刺激反应;(5)使用过程中具有良好的稳定性,不被溶胀和脱落.近年来,一些性能较好的组织黏接材料和技术已相继被报道.如利用硫酸软骨素[17]开发的软骨组织黏接材料具有良好的力学性能、生物相容性和软骨组织修复性能;甲基丙烯酰化明胶的组织黏接材料[18]对牙周组织具有一定的黏附性,通过与抗菌多肽的复合赋予材料抗菌性能,能够预防牙齿植体周围发炎等症状.这些基于天然材料的组织黏接剂(壳聚糖、海藻酸盐、透明质酸等)[19~21]具有良好的生物相容性和体内降解性能,但是力学性能不好,黏接性不足,从而限制了它们作为组织黏接材料的进一步应用.合成类组织黏接材料主要有聚氰基丙烯酸酯[22]、聚己内酯[23]、聚乙二醇[24]以及聚氨酯[25]等,其具有成本低、容易合成、黏接性能优异、原位固化速率快等优点.例如,利用静电纺丝技术[26]将含有氰基丙烯酸酯的纤维原位沉积到皮肤伤口,通过原位固化可实现组织黏接从而促进伤口恢复.但随着研究的逐渐深入,合成类组织黏接材料的缺陷逐渐显露出来,如生物相容性不好、容易发生炎症反应、体内稳定性不好及长时间使用容易降解产生有毒物质等;更为重要的是,合成类黏接材料固化后往往形成较硬的聚合物,模量很高,与皮肤等模量较低的软组织不兼容,使用效果不佳[4].目前来看,现有的组织黏接材料都有一些性能缺陷,因此开发能够满足以上性能要求的组织黏接材料仍然面临巨大的挑战.
聚硅氧烷是一种主链由Si—O键构成,侧链修饰有机功能基团的半有机高分子材料.由于Si—O键的特殊结构,聚硅氧烷高分子主链柔性较好,交联形成的弹性体具有很好的弹性,力学性能与皮肤等软组织兼容[27];聚硅氧烷的侧链可以通过一系列反应连接不同的功能基团,如羟基、氨基、羧基及季铵盐等,从而赋予材料不同的应用功能[28,29];另外,聚硅氧烷还具有很好的生理惰性,生物相容性和稳定性均较好.因此,聚硅氧烷材料广泛应用于再生医学和医疗器械领域,如用于制造人工肺、人工心脏瓣膜、人工皮肤及可植入导管等[30~32].
针对现有的合成类组织黏接材料的不足,考虑到聚硅氧烷材料在各方面性能的优势,本文构建了一种基于聚硅氧烷的皮肤组织黏接材料,并对其相关性能进行了表征.首先,合成了侧链含有苯甲醛基团并且乙烯基封端的聚二甲基硅氧烷预聚体(PDMSn-PBAMSm),其中醛基可以与皮肤组织上分布的胺基发生醛胺缩合反应[7],实现皮肤的共价黏接;然后,在室温条件下,使PDMSn-PBAMSm与交联剂含氢硅油(PHMS)在Pt催化下发生硅氢加成反应,此反应具有反应条件温和、速率快的特点[28],因此可以快速固化形成交联的聚硅氧烷弹性体;最后,通过调整PDMSn-PBAMSm的聚合度(DP)和PHMS的用量,使聚硅氧烷弹性体的力学性能与皮肤能够兼容,克服合成类黏接材料模量太高与组织不相容的缺陷,从而构建兼具力学性能、黏接性能、原位快速固化性能和生物相容性及稳定性的聚硅氧烷组织黏接材料,应用于皮肤组织的黏接.
1 实验部分
1.1 试剂与仪器
3-溴丙烯(纯度98%)、对羟基苯甲醛(纯度98%)、卡斯特催化剂Pt(0)-1,3-二乙烯-1,1,3,3-四甲基二硅氧烷(Pt质量分数为2%)、四甲基二乙烯基二硅氧烷(纯度98%)和八甲基环四硅氧烷(D4,纯度98%)均购自伊诺凯公司(北京);四甲基环四硅氧烷(D4H,纯度98%)购自Aladdin公司(上海);四甲基氢氧化铵(TMAH,质量分数25%的甲醇溶液)购自Alfa Aesar公司(上海);乙烯基MQ硅树脂(黏度为6500 mPa·s,乙烯基含量为3.97%)购自上海爱世博有机硅材料有限公司;含氢硅油(PHMS,含氢量1.67%,质量分数)购自百灵威公司(北京);1-乙炔基环己醇(纯度98%)购自Adams-Beta公司(上海);其它试剂均为分析纯.黏接测试用的新鲜猪皮采购于当地市场.
AVANCEⅢ500 MHz型核磁共振波谱仪(1H NMR和29Si NMR,德国Bruker公司);XL 30 ESEM FEG型场发射扫描电子显微镜(SEM,美国FEI公司);AGS-X型万能材料试验机(日本Shimadzu公司),传感器的最大力值为1 kN;Haake MarsⅢ型转矩流变仪(奥地利Anton Paar公司);LSM700型共聚焦激光扫描显微镜(德国Carl Zeiss公司);PL-GPC 220型高温凝胶渗透色谱仪(GPC),流动相为三氯苯,测试温度为150℃,光散射检测器,dn/dc值为0.09(美国Agilent公司);Vertex 70型傅里叶变换红外光谱仪(FTIR,德国Bruker公司);GENios型荧光酶标仪(瑞士TECAN公司).
1.2 实验过程
1.2.1 苯甲醛功能化的环四硅氧烷(BAMS)单体的合成将41 mmol(5 g)对羟基苯甲醛溶解于50 mL丙酮中,加入123 mmol(17 g)无水碳酸钾,将61 mmol(7.43 g)3-溴丙烯逐滴加入反应瓶中,室温搅拌30 min,回流反应6 h;反应结束后过滤除去碳酸钾,真空去除溶剂后进行柱层析[V(乙酸乙酯)∶V(石油醚)=1∶3],得到5.98 g黄色液体4-烯丙氧基苯甲醛,产率90%;将7.62 g(47 mmol)4-烯丙氧基苯甲醛溶于20 mL干燥的甲苯中,加入50 μL Pt催化剂,搅拌均匀后加入11 mmol(2.69 g)D4H,于100℃下无水无氧反应48 h,反应结束后抽干溶剂,先后用二氯甲烷和乙酸乙酯柱层析,得到黄色黏稠液体产物4.89 g,产率为50.2%[Scheme 1(A)].1H NMR(500 MHz,CDCl3),δ:9.85(s,—ArCHO),7.79(m,ArCHO),6.96(m,—OAr—),3.96(t,—CH2CH2O—),1.86(m,—CH2CH2O—),0.68(t,—SiCH2CH2—),0.15(s,CH3Si—);29Si NMR(500 MHz,CDCl3),δ:−26.72(s,CH3SiCH2—)(图S1,见本文支持信息).
1.2.2 聚二甲基硅氧烷的合成将24 μL TMAH加入干燥的反应瓶中,室温下保持真空30 min,待甲醇全部抽干后,加入16.1 mmol(4.78 g)D4,搅拌均匀后加入0.53 mmol(0.1 g)四甲基二乙烯基二硅氧烷,于90℃下无水无氧反应10 h,反应完成后降温,得到无色黏稠液体产物聚二甲基硅氧烷[PDMS480,Scheme 1(B)].1H NMR(500 MHz,CDCl3),δ:5.70~6.20(m,CH2=CH—),0.07(s,CH3SiCH3);29Si NMR(500 MHz,CDCl3),δ:−28.42(s,CH3SiCH3)(图S2,见本文支持信息).GPC测得其数均分子量(Mn)为27383.
另外,通过调整D4与四甲基二乙烯基二硅氧烷的投料比制得其它聚合度的聚二甲基硅氧烷PDMS320,PDMS400和PBAMS560,其合成步骤与反应条件与PDMS480相同.
1.2.3 PDMSn-PBAMSm的合成将单体BAMS(4.5 mmol,4 g)溶解在干燥的1,4-二氧六环(5 mL)中,加入上述得到的含有TMAH的PDMS480大分子止链剂(0.45 mmol,4.08 g),搅拌均匀后升温至90℃反应10 h,反应结束后升温至150℃保持30 min以分解催化剂TMAH,然后真空去除溶剂和小分子副产物,得到黄色黏稠的聚硅氧烷预聚体PDMS480-PBAMS1208 g,产率为98%[Scheme 1(C)].1H NMR(500 MHz,CDCl3),δ:9.85(s,—ArCHO),7.79(m,ArCHO),6.96(m,—OAr—),5.70-6.20(m,CH2=CH—),3.96(m,—CH2CH2O—),1.86(m,—CH2CH2O—),0.68(m,—SiCH2CH2—),0.15(s,CH3SiCH2—),0.07(s,CH3SiCH3);29Si NMR(500 MHz,CDCl3),δ:−26.76(s,CH3SiCH2—),−28.87(s,CH3SiCH3)(图S3,见本文支持信息).GPC测得其Mn为70100.
Scheme 1 Synthesis scheme for prepolymer PDMSn⁃PBAMSm
通过控制大分子引发剂PDMS和单体BAMS的摩尔比得到不同聚合度的预聚体PDMSn-PBAMSm.当n(PDMS320)∶n(BAMS)=1∶20,n(PDMS400)∶n(BAMS)=1∶25,n(PDMS560)∶n(BAMS)=1∶35时,制得的产物分别为PDMS320-PBAMS80,PDMS400-PBAMS100和PDMS560-PBAMS140.
1.3 力学性能测试
将2 g预聚体PDMS480-PBAMS120、0.6 g补强剂乙烯基MQ硅树脂、0.04~0.07 g交联剂含氢硅油、1 mg抑制剂1-乙炔基环己醇及10 μL Pt催化剂混合均匀后真空去除气泡,加入聚四氟乙烯模具中,室温下放置12 h,得交联聚合物弹性体;将该弹性体裁切成长5 cm、宽度和厚度均为2 mm的哑铃形样条,在万能试验机上进行拉伸测试.其中,单向拉伸测试的拉伸速度为100 mm/min,循环拉伸测试的拉伸速度为100 mm/min,循环次数均为5次;压缩测试的压缩速度为2 mm/min,样品为长10 mm、直径10 mm的圆柱体.
1.4 黏接性能测试
构建了3种猪皮黏接模型:剪切黏接模型(黏接尺寸为1 cm×2 cm)、拉伸黏接模型(黏接尺寸为2 cm×2 cm)和180°剥离黏接模型(黏接尺寸为3 cm×2 cm).在双筒注射器的A筒中加入混合均匀且无气泡的预聚体PDMS480-PBAMS120(2 g)、补强剂(0.6 g)和交联剂(0.12 g),在B筒中加入预聚体(2 g)、补强剂(0.6 g)和Pt催化剂(20 μL),推动双筒注射器,将双组分同时挤出并充分混合,均匀涂覆在新鲜的猪皮表面,再迅速将另一块猪皮覆盖其上实现黏接.于室温下放置5 h后,在万能材料试验机上进行测试,拉伸或压缩速度为10 mm/min.
1.5 固化性能测试和形貌表征
将2 g预聚体PDMS480-PBAMS120、0.06 g交联剂PHMS及10 μL Pt催化剂混合物挤出置于流变仪平台上,降下平行板,测试混合物的剪切模量随时间的变化(γ=1%,ω=1 Hz).以2 g预聚体PDMS480-PBAMS120和0.06 g交联剂PHMS的混合物作为对照组.
将新黏接的猪皮在−140℃环境中淬断,然后在低温下利用SEM观察样品断面的形貌.
1.6 细胞毒性测试和活⁃死染色观察
细胞毒性采用CellTiter-Blue Assay方法测试.将预聚体PDMS480-PBAMS120制成2 mm×1 cm×1 cm的样品片,并于磷酸盐缓冲溶液(PBS,pH=7.4)中浸泡24 h,取出后紫外灭菌30 min,然后浸泡于RPMI-1640培养基中,于4℃下分别取12,24,36,48,60和72 h的培养基浸出液待用;在RPMI-1640培养基中培养人胚胎肾细胞(HEK293细胞),加入10%(体积分数)的胎牛血清(FBS)和1%(体积分数)的青链霉素双抗,将HEK-293细胞以1×105Cell/mL的密度种植于96孔板中(每孔100 μL),在37℃、5%CO2环境中培养24 h,用PBS洗涤后加入样品培养基浸出液培养24 h,然后吸出培养基并用PBS洗涤,将CellTiter-Blue染料加入培养板(每孔10 μL),37℃孵育4 h后用酶标仪测试荧光强度(λex=560 nm,λem=590 nm).细胞活性(Cell viability,%)采用下式进行计算:

将预聚体PDMS480-PBAMS120固化成薄膜并裁割成圆片,在PBS中浸泡24 h,用紫外灯灭菌30 min后,再于RPMI-1640培养基中浸泡24 h;将聚合物薄膜圆片平铺于12孔细胞培养板底部,将HEK293细胞以1×105Cell/mL的密度种植于培养板中(每孔1 mL),在37℃、5%CO2环境下培养24 h;将培养基吸出,用PBS洗涤细胞后加入Calcein-AM/PI染料(每孔500 μL),37℃避光孵育30 min,然后在共聚焦激光扫描显微镜下进行观察,其中活细胞呈绿色,死细胞呈红色.
1.7 稳定性测试
将预聚体PDMS480-PBAMS120固化形成的聚合物制备成厚度为2 mm、直径为5 mm的圆饼状试样,称量初始质量[mi(g)];将试样浸泡于PBS中,称量不同浸泡时间后溶胀的质量[ms(g)];溶胀率(Swelling Ratio,%)利用如下公式计算:

将试样分别在pH=2,4,6,8,10,12的环境中浸泡15 d,通过试样浸泡前后的质量变化来表征材料在不同pH值下的稳定性.
2 结果与讨论
2.1 合成与表征
首先,通过硅氢加成反应合成了苯甲醛修饰的环四硅氧烷单体BAMS,其1H NMR谱图[图1(A)]中δ1.86和0.68处的谱峰归属于BAMS分子中由乙烯基和Si—H之间通过硅氢加成反应生成的两个亚甲基;其FTIR谱图[图1(B)]中,反应后位于2174 cm−1处的Si—H伸缩振动峰消失,而位于1700 cm−1(C=O)和1160 cm−1(C—O)处的伸缩振动峰明显增强.这些数据充分证明了BAMS的化学结构,表明单体BAMS的成功合成.然后,通过阴离子开环聚合制备了乙烯基封端的PDMS,图2(A)给出其1H NMR谱.最后,以PDMS为大分子止链剂,在碱催化条件下,使单体BAMS开环聚合得到乙烯基封端、侧链由部分苯甲醛修饰的预聚体PDMSn-PBAMSm.其1H NMR谱图[图2(B)]中δ5.7~6.2处为乙烯基的特征峰,δ0.7处为侧甲基的特征峰,证明预聚体PDMSn-PBAMSm结构正确.

Fig.1 1H NMR(A)and FTIR(B)spectra of benzaldehyde functionalized cyclotetrasiloxane(BAMS)
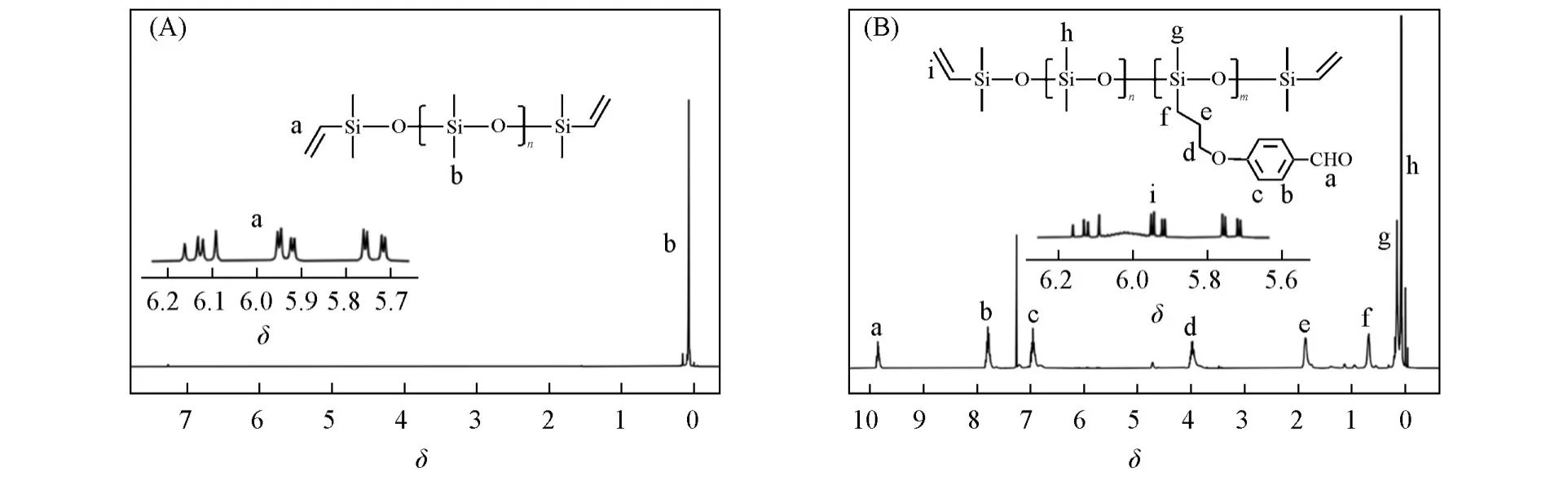
Fig.2 1H NMR of vinyl terminated PDMS(A)and prepolymer PDMSn⁃PBAMSm(B)
2.2 力学性能
皮肤组织黏接材料应该兼具良好的力学性能,主要包括:(1)较高的力学强度,以保证黏接过程中不会发生本征破坏;(2)合适的弹性模量,以满足与皮肤软组织的力学兼容性.具体表现为:材料在低应变(10%~40%)时有一段线性弹性形变区,弹性模量应该在0.50~1.95 MPa,拉伸断裂应变应该为140%~180%[33,34].通过调控预聚体PDMSn-PBAMSm的聚合度及PHMS的用量,可以得到不同力学性能的聚硅氧烷弹性体,从而满足与皮肤组织兼容的性能要求.
制备了聚合度为400,500,600和700的硅氧烷预聚体预聚体PDMSn-PBAMSm(表1),其中黏接功能基团PBAMSm摩尔分数为20%,对预聚体的分子量、分子量分布以及初始黏度进行了测定,并对各个聚合度的预聚体在不同交联剂含量下的拉伸性能进行了表征.图3(A)示出预聚体PDMS480-PBAMS120与不同含量交联剂(PHMS)固化形成的弹性体的拉伸性能.随着交联剂质量分数的提高(2.0%~3.5%),材料的断裂应变逐渐减小,最大为208%,拉伸强度在交联剂质量分数为3.0%时达到最大,并且此时的断裂应变为176%,符合皮肤组织黏接材料的性能要求(在140%~180%之间)[34].图3(B)数据表明,当交联剂质量分数从2.0%提高至3.5%时,材料的弹性模量从0.48 MPa增大至0.87 MPa,材料在这个范围内均符合对皮肤组织黏接材料模量的要求;材料的韧性也随交联剂用量的增大而提高,在交联剂质量分数为3.0%时达到最大,为1.51 MJ/m3[图3(C)],表明材料具有很好的弹性.拉伸测试结果表明,以PDMS480-PBAMS120为预聚体固化形成的弹性体表现出很好的力学性能,与皮肤组织相容,优于现有的合成类黏接材料,符合作为组织黏接材料的基本性能需求.另外3种聚合度(400,500,700)的预聚体在不同用量交联剂下固化形成的弹性体同样表现出与皮肤组织相容的力学性能(图S4~S6,见本文支持信息).

Table 1 Number⁃average molecular weight(Mn),PDI and viscosity of prepolymer with different DP with the functional group modified proportion(molar fraction)of 20%
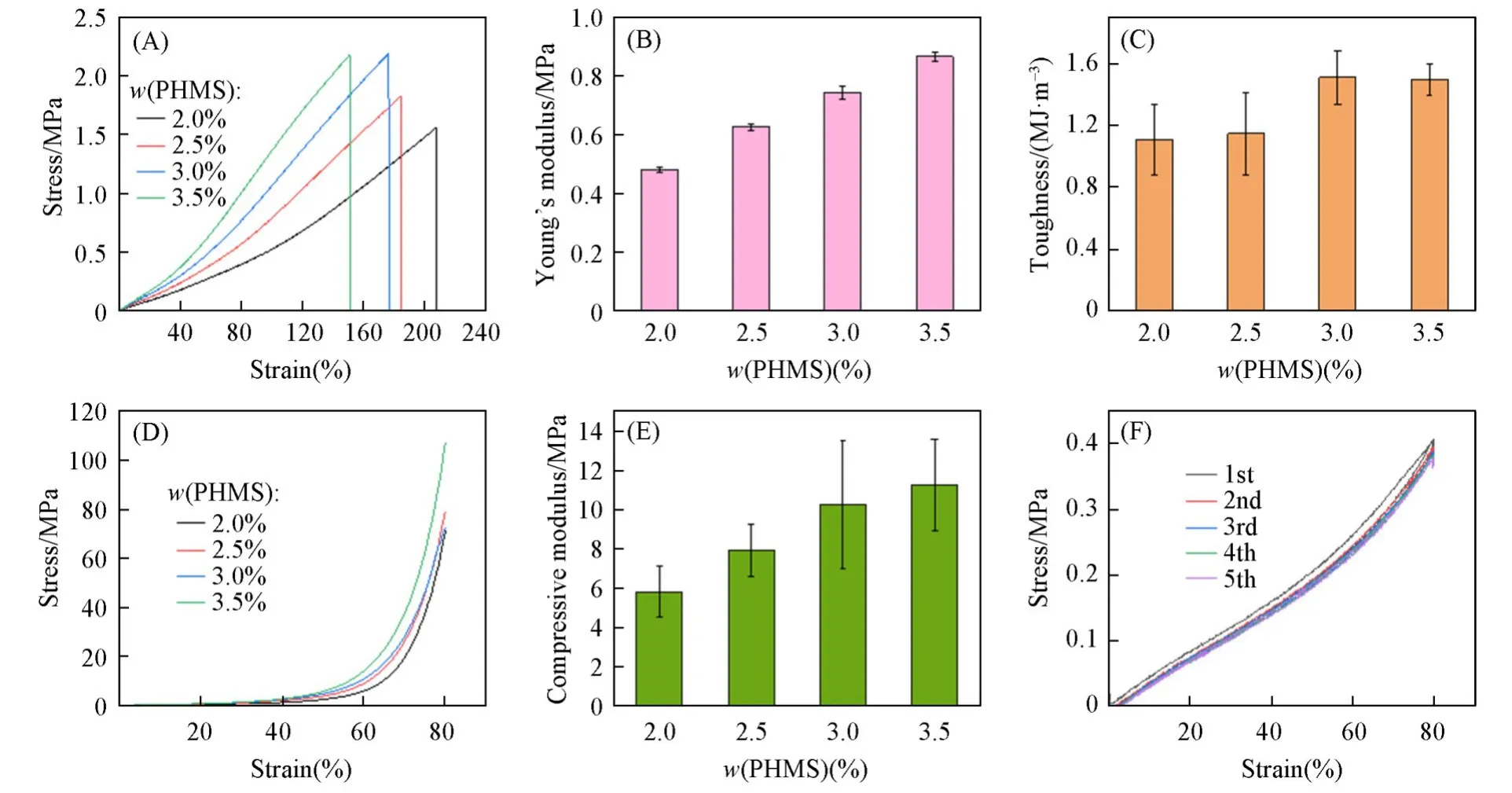
Fig.3 Tensile curve(A),Young’s modulus(B),toughness(C),compression curve(D)and compressive modu⁃lus(E)of prepolymer PDMS480⁃PBAMS120 curing elastomer with different concentration of PHMS and the cyclic tensile curve of prepolymer PDMS480⁃PBAMS120 curing elastomer(F)
在不同交联剂用量下,对预聚体PDMS480-PBAMS120固化形成弹性体的压缩性能进行了表征.由图3(D)和(E)可见,材料的压缩强度和压缩模量随交联剂用量的增加而增大,当交联剂质量分数为3.5%时,材料在80%压缩应变下最大压缩强度和压缩模量分别为107 MPa和11.2 MPa,表现出很好的压缩性能.我们还通过循环拉伸测试表征了材料的滞后和动态力学性能[图3(F)],发现材料在循环拉伸过程中几乎没有滞后,而且连续5次循环拉伸后依然可以回复到原点,几乎没有发生永久变形,表现出很好的滞后和动态力学性能.
2.3 黏接性能
因为皮肤表面分布着较多的功能性胺基[3],可以与醛基在温和的条件下发生醛胺缩合反应实现共价连接,所以我们利用这一特点构建了基于共价相互作用的组织黏接材料,测试结果表明,将侧链由苯甲醛修饰的聚硅氧烷预聚体PDMSn-PBAMSm原位交联在皮肤表面实现组织黏附.预聚体的黏度随聚合度的升高而增大,并且苯甲醛基团的修饰比例升高也会明显增大预聚体的黏度(表S1,见本文支持信息).由于黏度太大会影响后续的可操作性,我们将预聚体的总聚合度控制在600,调整苯甲醛修饰摩尔比分别为10%,20%和30%,并以猪皮为黏接对象,表征材料的组织黏接性能,构建了3种黏接模型,即剪切黏接模型、拉伸黏接模型和180°剥离模型[图4(A)~(C)].
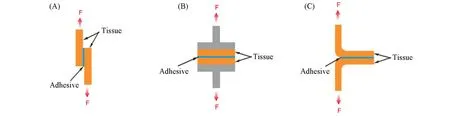
Fig.4 Schematic illustrations of shear adhesive(A),tensile adhesive(B)and 180°peel⁃off(C)models
由图5(A)可见,材料的剪切黏接强度随黏接基团修饰比例的增大而增大,当黏接基团修饰比例为30%(摩尔分数)时达到77.6 kPa,远高于没有修饰黏接基团的PDMS对照组的黏接强度,也高于对照组氰基丙烯酸酯的黏接强度,表明黏接基团的引入极大地提高了材料的黏接强度,同时也进一步证明了醛基与皮肤组织表面胺基的相互作用.由图5(B)可见,随着黏接基团修饰比例的提高,黏接材料的拉伸黏接强度也逐渐增高,最高可达87.9 kPa,高于对照组PDMS和氰基丙烯酸酯的黏接强度.

Fig.5 Shear adhesive strength(A),tensile adhesive strength(B)and 180°peel strength(C)of PDMS320-PBAMS80,PDMS400⁃PBAMS100,PDMS480⁃PBAMS120 and PDMS560⁃PBAMS140
图5 (C)为黏接材料180°剥离的测试结果.可以看出,黏接基团的引入明显提高了材料的剥离强度,并且随基团修饰比例的增大而增大,最大为0.68 N/cm,远高于对照组PDMS,但略低于氰基丙烯酸酯的剥离强度(0.83 N/cm).
材料的剪切黏接强度、拉伸黏接强度和180°剥离强度随时间的变化关系,即该黏接材料的黏接持久性试验结果如图6所示.随着时间的延长(0~24 h),该黏接材料的黏接强度略有下降,剪切黏接强度由82.1 kPa下降至57.8 kPa,拉伸黏接强度由95.3 kPa下降至53.6 kPa,剥离强度由0.59 N/cm下降至0.41 N/cm.结果表明,材料黏接强度随时间延长虽然有所降低,但仍然可以保持较好的黏接性能.

Fig.6 Variation of adhesive strength with time
2.4 原位固化性能和黏接形貌
对于组织黏接剂来说,当其与被黏合组织接触后,应该在短时间发生原位固化交联以实现黏接,因此要求材料必须具有快速的原位固化性能,并在室温等温和的条件下进行.本文通过流变测试研究了所制备材料的原位固化性能.
由图7(A)可见,在没有Pt催化剂时,预聚体PDMS480-PBAMS120和交联剂PHMS混合后呈现典型的流体状态(G″>G′),材料的剪切模量很低.在Pt催化剂作用下,预聚体和交联剂混合液的剪切模量明显得到提高,而且在5 s内储存模量G′明显地超过了损耗模量G″,在大约100 s后趋于稳定(G′为10 kPa,G″为0.77 kPa).研究结果表明,该材料在短时间内由流体变为弹性体状态,并且完成固化交联[图7(B)].这组对比试验证明了Pt催化剂在温和的室温条件下可以催化预聚体PDMS480-PBAMS120的乙烯端基和交联剂PHMS分子中的Si—H基团发生硅氢加成反应,而且反应速率高,这使得该组织黏接材料在较温和条件下原位快速固化成为可能,从而满足组织黏接对材料原位固化的性能要求.

Fig.7 Variation of shear modulus of prepolymer PDMS480⁃BAMS120 without(A)and with(B)Pt catalyst with time
本文还对该黏接材料的原位黏接形貌进行了表征,图8示出了预聚体PDMS480-PBAMS120和交联剂PHMS在猪皮表面原位交联后黏接界面的断面形貌.可以看到材料与猪皮的界面连接处形成了明显的键接,这是由PDMS480-PBAMS120的醛基和组织表面的胺基反应形成共价连接所致,这也在形貌上直接证明了材料对皮肤组织的黏合作用.

Fig.8 Adhesive morphology of prepolymer PDMS480⁃PBAMS120 in situ curing on hogskin
2.5 细胞毒性和材料稳定性
组织黏接材料的必要条件之一是应具有较好的生物相容性,我们用人胚胎肾细胞HEK293细胞系测试了该组织黏接材料的细胞毒性.由图9(A)可见,同对照组相比,HEK293细胞在不同样品浸泡时间的培养基浸出液中培养24 h后,均表现出很好的生理活性,而且HEK293细胞在样品浸泡时间为72 h的培养基浸出液中培养24 h后,细胞存活率仍然高达84%,表明材料具有较低的细胞毒性.
将HEK293细胞在该组织黏接材料制备的薄膜样品上培养24 h,利用细胞活-死染色技术进一步研究了材料的细胞毒性[图9(B)~(D)].通过与对照组比较发现,HEK293细胞在PDMS600和预聚体PDMS480-PBAMS120所形成的薄膜上表现出较好的生理活性,与对照组无明显差异.以上研究结果证明了该组织黏接材料的细胞毒性较低,生物相容性较好.
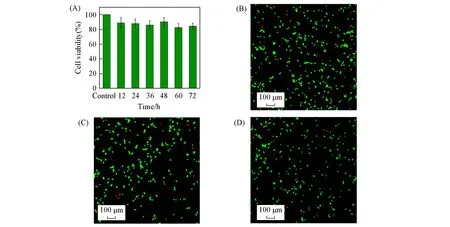
Fig.9 Cell viability of HEK293 cells cultured in sample culturing medium extracting solution for 24 h(A)and the live⁃dead stain images of HEK293 cell incubated on control group(B),PDMS600(C)and PDMS480⁃PBAMS120(D)for 24 h
黏接材料具有较好的稳定性也是组织黏接剂的基本要求,主要表现在溶胀率很低,状态变化不大,保持较好的稳定性.由图10(A)可见,预聚体PDMS480-PBAMS120固化形成的弹性体在PBS,pH=2,pH=12的环境中浸泡15 d后的形态与浸泡前相比没有发生明显的变化,宏观上表现出较好的稳定性.由图10(B)可见,PDMS480-PBAMS120固化形成的弹性体在PBS中的溶胀率随时间的延长略有升高,浸泡15 d后溶胀率为13.5%,说明材料吸收了少量的水,但总体上溶胀率比较小,符合黏接材料的基本要求[4].PDMS480-PBAMS120在不同pH值的溶液中浸泡15 d后的质量变化如图10(C)所示,其在pH=4的环境中质量升高最明显,相对质量为1.1,在pH=10的环境中变化最小,相对质量为1.02.上述实验结果说明,预聚体PDMS480-PBAMS120固化形成的弹性体无论在碱性条件下还是酸性条件下都表现出相对稳定的特点,总体符合组织黏接材料对稳定性的基本要求.

Fig.10 Stability of prepolymer PDMS480⁃PBAMS120 curing elastomer in different solutions after 15 d
3 结 论
在分析组织黏接材料的性能要求基础上,结合聚硅氧烷材料的性能特点,设计合成了一种聚硅氧烷皮肤组织黏接材料,其由预聚体PDMSn-PBAMSm、交联剂PHMS和Pt催化剂多组分构成,在催化剂催化下,预聚体和交联剂能够在皮肤组织表面原位固化形成交联弹性体,实现对组织的黏接.系列试验结果表明,该组织黏接材料具有与皮肤组织相容的力学性能,黏接强度高,并且能够在室温下实现快速固化交联,材料的生物相容性和稳定性也比较优异.本文所构建的聚硅氧烷组织黏接材料各项性能指标满足组织黏接剂的基本要求,具有较好的应用前景,并且对组织黏接材料的设计合成具有指导意义.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20210590.
