颅内动脉高密度征在急性前循环大动脉闭塞取栓治疗中的临床意义
2021-12-16梅照军孙而艺陆培松李巧玉陆新宇
陈 伟 梅照军 曹 侃 孙而艺 陆培松 李巧玉 陆新宇
江苏大学附属人民医院,江苏 镇江 212000
急性大动脉闭塞性脑卒中具有发病急、病情重、致残率及病死率高等特点,给家庭和社会造成巨大的心理和经济负担。目前,早期血管内机械取栓治疗急性前循环大动脉闭塞性脑卒中已得到众多国内外指南的推荐,可迅速开通闭塞动脉,恢复缺血脑组织血供,减少脑细胞的损伤,能显著改善患者的生存率和生活质量[1-3]。受治疗时间窗的限制,仍有众多病人无法接受早期血管内治疗,但近两年有学者发现血管内恢复再灌注和改善功能结果之间的关系并不是严格的时间依赖性,往往与患者的梗死核心区域大小、缺血半暗带和侧支循环程度等相关[4],因此,不仅仅“时间就是大脑”,脑组织成像的评估同样重要,然而,当前并不是所有医院均可完成急诊的头颅MRI 检查并进行评估。CT平扫及CTA作为首选的术前影像学评估方法得到学者的一致认可,可明显缩短检查时间,早期判断脑实质密度改变,判断血管闭塞位置,评估侧支循环,但对于核心梗死区域的准确判断存在劣势[5-6]。颅内动脉高密度征(hyperdense cerebral artery sign,HCAS)作为缺血性脑卒中CT平扫上常见的影像学征象,在以往的静脉溶栓和保守治疗中预示着更大的梗死面积及更高的致残率和病死率[7-9],但在接受血管内机械取栓治疗的患者中,对预后的影响并未达成共识。因此,本研究回顾性分析江苏大学附属人民医院收治的急性前循环大动脉闭塞性脑卒中患者的临床资料,探讨接受血管内机械取栓治疗患者的预后与HCAS是否存在相关性。
1 资料与方法
1.1 研究对象回顾性分析2017-01—2020-06 江苏大学附属人民医院神经外科收治的93例血管内机械取栓治疗的急性前循环大动脉闭塞患者的临床资料。本研究经医院伦理委员会审批通过(SQK-20200108-W),患者或家属均签署术前手术知情同意书。
纳入标准:(1)急性前循环大动脉闭塞脑卒中患者,闭塞位置包括颈内动脉末端、大脑中动脉(MCA)M1 段;(2)术前均行头颅CT 及CTA 检查;(3)均采用Solitaire 支架取栓、抽吸取 栓;(4)发 病 前 改 良Rankin 量 表 评 分(modified Rankin Score,mRS)≤2 分。排除标准:(1)发病至入院时间>6 h;(2)有脑出血史或凝血功能异常者;(3)心、肝、肾严重脏器功能障碍。
1.2 研究方法
1.2.1 资料收集及分组:根据术前CT 平扫结果(5 mm 轴位片),颅内动脉高密度征由一名神经介入医生和一名影像科医生判读(均为主治医师及以上职称),动脉高密度征判读标准:①动脉密度增高位于颈内动脉末端及M1 段;②单侧动脉密度增高并低于骨密度;③排除双侧HCAS(血液高凝状态)、血管钙化、红细胞增多症及造影剂等原因所致动脉密度增高[9-10]。93例患者分为动脉高密度征组(n=41)和无动脉高密度征组(n=52)。记录并分析2 组患者的基线资料(包括年龄、性别,既往高血压、糖尿病、吸烟、房颤史,术前NIHSS 评分、取栓次数、静脉溶栓、发病至穿刺时间、穿刺至血管再通时间),比较2组术后血管再通率、症状性颅内出血率、90 d 良好预后率(mRS≤2 分)和90 d 病死率。所有患者的卒中病因分类根据TOAST 病因分型分为大动脉粥样硬化型(large artery atherosclerosis,LAA)、心 源 型(cardioembolism,CE)、不明原因型(stroke of undetermined cause,SUE),本组病例中无小动脉闭塞型及其他病因明确型。
所有患者的治疗方案根据《中国急性缺血性脑卒中早期血管内介入诊疗指南》2015 版及2018 版,符合溶栓指征的患者术前常规进行阿替普酶静脉溶栓;血管内治疗则首先采取Solitaire 支架取栓或抽吸取栓,对于多次取栓仍有血管狭窄或无法再通者,术中CT 平扫排除出血,即刻使用替罗非班泵入,必要时采用球囊扩张及补救性支架置入。
1.2.2 评价方法:①血管再通率:脑梗死改良溶栓分级(modified thrombolysis in cerebral infarction score,mTICI)评判术后血管开通情况,由2名神经介入医生评估将mTICI 2b级和3 级定义为再通;②症状性颅内出血率(symptomatic intracranial hemorrhage,sICH):术后24 h内头颅CT结果根据海德堡出血分类(Heidelberg bleeding classification,HBC)及神经功能进行性恶化(NIHSS评分较术前升高≥4分)定义为症状性颅内出血[11];③90 d良好预后率及90 d病死率:根据术后90 d mRS评分,0~2分为预后良好,3~6分为较差预后,6分死亡。
1.3 统计学分析采用SPSS 22.0 统计软件进行统计学分析,计数资料采用率(%)表示,组间比较采用χ2检验;符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用t检验,不符合正态分布的计量资料采用中位数和四分位数间距[M(Q1,Q3)]表示,组间比较采用Mann-Whitney U 检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 2组临床基线资料比较93例患者中桥接治疗23例,术中替罗非班微泵16例,2组基线资料比较差异无统计学意义(P>0.05)。见表1。

表1 2组患者术前基线资料Table 1 Preoperative baseline characteristics of the two groups
2.2 治疗及临床预后动脉高密度征组手术中穿刺-血管开通所用时间(82.6±31.2)min,少于无动脉高密度征组的(89.9±34.5)min,取栓次数(2.4±0.97)同样也少于无动脉高密度征组(2.7±0.9),但组间比较差异无统计学意义(P>0.05);发病至穿刺时间分别为(225.1±61.2)min 和(223.5±77.8)min,差异无统计学意义(P>0.05)。
动脉高密度征组血管再通率、症状性颅内出血率及90 d 良好预后率均低于无动脉高密度征组,术后90 d 病死率高于无动脉高密度征组,但差异均无统计学意义(P>0.05)。见图1~4、表2。

表2 2组患者治疗及临床预后比较Table 2 Comparison of treatment and outcomes in the two groups

图1 左侧大脑中动脉闭塞伴HCAS经机械取栓后mTICI 3级再通Figure 1 Left middle cerebral artery occlusion with HCAS was recanalized after mechanical thrombectomy

图2 右侧大脑中动脉闭塞不伴HCAS经机械取栓后mTICI 3级再通Figure 2 Right middle cerebral artery occlusion without HCAS was recanalized after mechanical thrombectomy
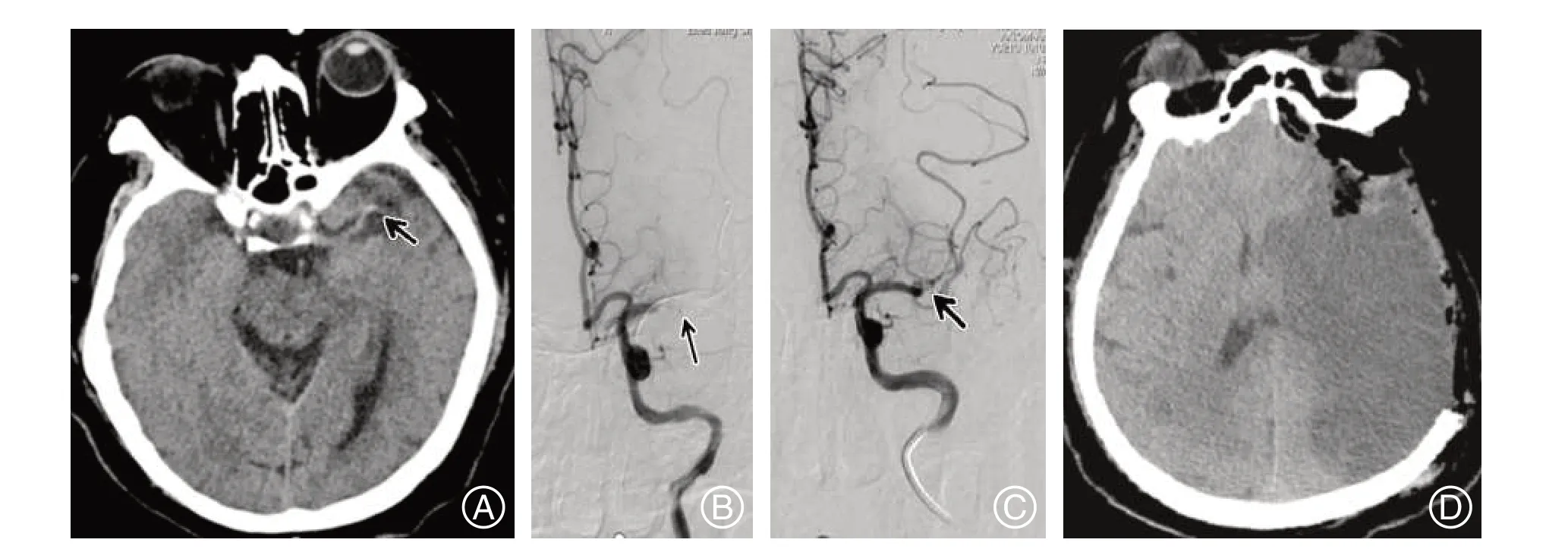
图3 左侧大脑中动脉闭塞伴HCAS经机械取栓后未再通,术后大面积脑梗死行去骨瓣减压术Figure 3 Left middle cerebral artery occlusion with HCAS was not recanalized after mechanical thrombectomy and accept decompressive craniectomy

图4 左侧大脑中动脉闭塞不伴HCAS经机械取栓后血管再通,术后出现大面积脑出血Figure 4 Left middle cerebral artery occlusion without HCAS was recanalized after mechanical thrombectomy,but massive intracerebral hemorrhage occurred after operation
2.3 术后90 d预后不良的影响因素93例患者中预后良好50例,预后不佳43例;单因素分析显示预后不佳组的患者年龄更大,术前NIHSS 评分更高,血管再通时间更长,再通率偏低,症状性颅内出血率更高,差异有统计学意义(P<0.05),其中性别、既往病史、是否桥接治疗、发病至穿刺时间、取栓次数、卒中的病因、HCAS 对预后的影响差异无统计学意义(P>0.05)。见表3。

表3 术后90 d预后不良的单因素分析Table 3 Comparison between patients with good outcome and poor outcome
3 讨论
HCAS 作为缺血性脑卒中CT 平扫上早期出现的影像学征象,其判断的量化标准早已发表,2000 年KOO 等[12]采用椭圆小面积法测量MCA近端CT值,将CT值>43 HU和患者/健侧>1.2作为高密度征的判断标准,但由于成像软件及测量的繁琐、耗时,临床使用效率并不高。2009 年ABUL-KASIM 等[13]通过将2 名有经验观测者对HCAS主观的判断结果和CT客观的测量值进行比较,提出主观的判断结果具有很高的准确性,2015 年AOUAD 等[9]将医生分为4组,并将其主观判断的结果与客观的量化标准进行详细比较,认为高年资医生的主观判断具有很高的准确性;SHINOHARA等[14]认为医生通过DCNN法经过深度学习可使HCAS的诊断准确率达85%以上。因此,本研究通过2 名从事神经介入及影像专业的主治及以上职称的医生将位于颈内动脉末端及大脑中动脉区域单侧动脉密度增高并低于骨密度作为判断标准,但需排除血液高凝状态、血管钙化、红细胞增多症及造影剂等原因所致动脉密度增高。
既往研究表明HCAS 在早期判断大动脉闭塞性脑梗死中具有很高的特异度,但敏感性不高。本组病例中采用5 mm CT 平扫,HCAS出现率为44%,与文献[15-16]报道基本相符合。HCAS的出现与CT扫描的层厚、血栓的成分、发病的时间等相关,CT 扫描的层厚约薄,出现的概率越大;红细胞占主要成分的红色血栓相较于白色血栓更容易出现HCAS[17-18],这是由于高红细胞压积可增加X线的衰减值,从而增加CT 值。KIM 等[19]认为HCAS 可能与卒中分型有关,HCAS阴性的急性脑梗死更多是由于大动脉狭窄原位血栓栓塞所致。2017年的一项Meta 分析显示HCAS 与缺血性脑卒中病因无关[20]。本组病例发现动脉高密度征组中的LAA型脑卒中比例明显高于无动脉高密度征组,CE型脑卒中所占比例少于HCAS阴性组,推测原因是由于LAA型血栓成分红细胞含量更高,而CE型富含更多的纤维蛋白[21-22],因此在CT平扫中LAA型更容易出现动脉高密度征,这与KIM 等[19]学者的结论有所不同,但本组数据的统计学分析未见明显差异,故需要进一步大样本的病例及多中心的数据分析。
HCAS 的出现在预测脑梗死预后方面有更大的意义,往往提示更严重的神经功能缺损[8,10]。FROEHLER 等[23-24]在使用Merci 取栓装置过程中发现HCAS 阳性组有较高的血管再通率;FROEHLER 等[23,25]采用Solitaire 支架取栓认为HCAS阳性组有更高的血管再通率,但在症状性颅内出血率及90 d 预后并无相应的分析。KIM 等[19]发现HCAS 和机械取栓患者的血管再通率、症状性颅内出血率及预后良好率均无明显相关性。本组数据的分析结果与KIM 等[19]一致,原因可能是由于血管内治疗技术及材料的进步,如中间导管直接抽吸取栓、各种新型的颅内球囊及颅内支架的应用,手术时间窗明显缩短、血管开通率明显升高、出血等并发症明显下降等。
经单因素分析,本组病例的90 d 预后不良与患者高龄、术前高NIHSS 评分、症状性颅内出血、血管开通时间长、血管再通不佳相关,与目前的主流观点一致[26-28];同时预后好的患者具有发病至穿刺时间短、取栓次数少的特点,但差异无统计学意义(P=0.124,P=0.230),取栓次数少的原因推测与血栓成分相关,更多红细胞含量的血栓支架更容易抓取[29-30]。遗憾的是,本组病例中并未全部进行血栓成分的测定,故无法得到精确的统计学结果。颅内动脉高密度征的出现与接受血管内机械取栓的前循环大动脉闭塞性脑梗死的预后无明显相关性。
