血清hs-CRP ox-LDL水平在脑梗死中的表达及意义
2021-12-16吴海燕
吴海燕 张 平
1)商丘市中心医院,河南 商丘 476000 2)新乡医学院第一附属医院,河南 新乡 453000
脑梗死与多种因素所致的脑局部血管功能障碍引发的脑组织缺血、缺氧性坏死有关[1],患者通常无明显前驱症状,部分患者可见头昏、短暂性肢体麻木、乏力等短暂性脑缺血症状[2]。但这些前驱症状通常可快速消解,并因此被患者及家属忽略,因此早期确诊率极低。当患者急性发作时,其临床症状与脑组织缺血区域及受累组织有关,通常有以下几类表现:(1)颈内动脉闭塞综合征,患者病灶侧眼出现黑蒙或Horner 征、对侧偏瘫、失语、意识障碍等;(2)大脑中动脉闭塞综合征,最为常见,主干闭塞者可见对侧中枢偏瘫、感觉障碍及同向性偏盲症状;皮质闭塞者可见对侧偏瘫及感觉缺损现象;深穿支闭塞者可见对侧中枢性上下肢均等性偏瘫、皮质下失语等症状;(3)大脑前动脉闭塞综合征,主干闭塞者可见对侧下肢功能、感觉障碍,淡漠、欣慰等精神症状;皮质支闭塞者可见对侧下肢远端偏瘫,部分患者可见感觉障碍或精神症状;深穿支闭塞者可见上肢近端轻度瘫及患侧中枢性面舌瘫[3];(4)大脑后动脉闭塞综合征,主干闭塞者可见对侧同向性偏瘫、偏盲,丘脑综合征;皮质支闭塞者可见对侧同向性偏盲及命名性失语症状;深穿支闭塞者可见红核丘脑综合征、丘脑综合征及Benedikt 综合征等[4];(5)分水岭脑梗死,患者症状包括偏盲、Gerstmann 综合征及纯运动性轻偏瘫等[5]。
TOAST分型是脑梗死主流分型方案之一,将脑梗死分为大动脉粥样硬化卒中、心源性脑栓塞、小动脉闭塞性卒中、腔隙性卒中等[6]。不同TOAST分型患者病理基础不同,其对应的临床表现也不同,相应的治疗方案也不同[7]。因此,TOAST 分型鉴别对本病防治具有重要作用。高敏C 反应蛋白(hypersensitive C-reactive protein,hs-CRP)是肝脏来源的急性相血清指标之一,与感染、心血管疾病密切相关,是公认的心血管事件强预测因子[8]。低密度脂蛋白是人体内的胆固醇运载蛋白,氧化后转化为氧化低密度脂蛋白(human ox-LDL,ox-LDL),此时低密度脂蛋白将无法携带胆固醇,并因此导致胆固醇富集于动脉壁,最终引发动脉硬化。本研究探讨不同TOAST分型脑梗死患者血清hs-CRP、ox-LDL的表达水平及意义。
1 资料与方法
1.1 一般资料选取2018-01—2019-12 商丘市中心医院治疗的急性脑梗死患者220 例(观察组),其中大动脉粥样硬化型(LAA)108例,小动脉闭塞型(SAO)82 例,心源性栓塞型(CE)30 例。纳入标准:(1)符合《2014 年急性缺血性脑卒中诊治指南》中急性脑梗死的诊断标准;(2)发病后24 h 内入院;(3)患者及家属知情同意。排除标准:(1)合并恶性肿瘤等严重疾病者;(2)近1 个月有抗血小板聚集药物服用史者。选取健康体检者100例为对照组,2组一般资料比较见表1。

表1 2组一般资料比较Table 1 Comparison of general information of two groups
1.2 检测方法清晨采集2 组患者外周血4 mL,选用湘锐离心机有限公司生产的GL-10MC高速冷冻离心机离心,转速5 500 r/min,半径8 cm,时长12 min,随后取上清,选用ELISA法检测2组血清hs-CRP、ox-LDL水平,试剂盒由上海吉泰生物科技有限公司提供[9]。对观察组患者进行NIHSS评定。
1.3 统计学处理采用SPSS 22.0 软件,计量资料采用均数±标准差表示,采取t 检验或方差分析;计数资料采用率(%)表示,行χ2检验;相关性采用Pearson相关分析。检验水准取α=0.05。
2 结果
2.1 2 组血清hs-CRP、ox-LDL 水平观察组血清hs-CRP、ox-LDL明显高于对照组(P<0.05)。见表2、图1。
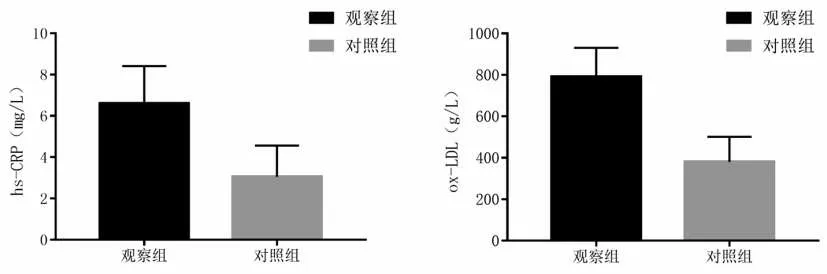
图1 2组血清hs-CRP、ox-LDL水平比较Figure 1 Comparison of serum hs-CRP and ox-LDL levels in the two groups
表2 2组血清hs-CRP、ox-LDL水平比较 (±s)Table 2 Comparison of serum hs-CRP and ox-LDL between the two groups (±s)
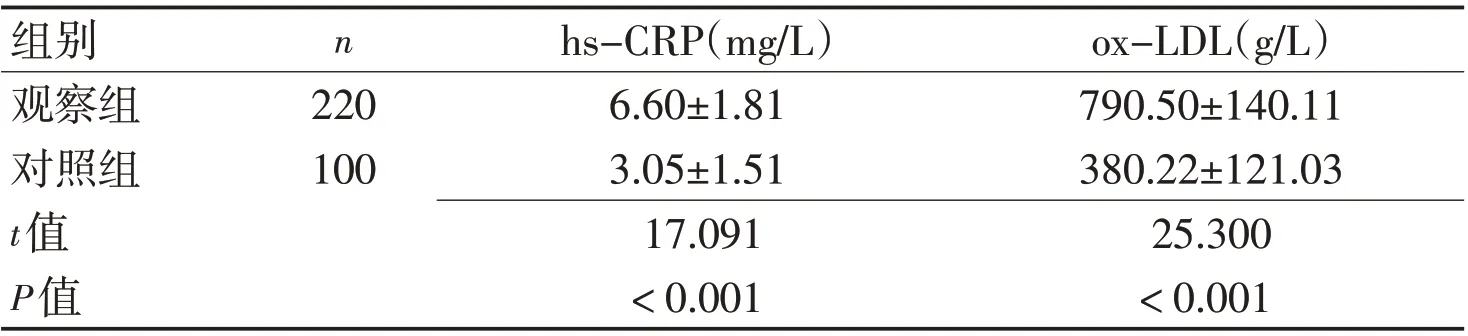
表2 2组血清hs-CRP、ox-LDL水平比较 (±s)Table 2 Comparison of serum hs-CRP and ox-LDL between the two groups (±s)
组别观察组对照组t值P值n 220 100 hs-CRP(mg/L)6.60±1.81 3.05±1.51 17.091<0.001 ox-LDL(g/L)790.50±140.11 380.22±121.03 25.300<0.001
2.2 观察组不同TOAST 分型患者血清hs-CRP、ox-LDL水平比较观察组CE型患者血清hs-CRP水平明显高于LAA和SAO型患者(P<0.05);LAA 型患者血清ox-LDL 水平明显高于SAO 和CE 型患者(P<0.05)。见表3、图2。

图2 不同TOAST分型患者血清hs-CRP、ox-LDL水平比较Figure 2 Comparison of serum hs-CRP and ox-LDL levels in patients with different TOAST classifications
表3 观察组不同TOAST分型患者血清hs-CRP、ox-LDL水平比较 (±s)Table 3 Comparison of the levels of serum hs-CRP and ox-LDL in patients with different TOAST types in the observation group (±s)
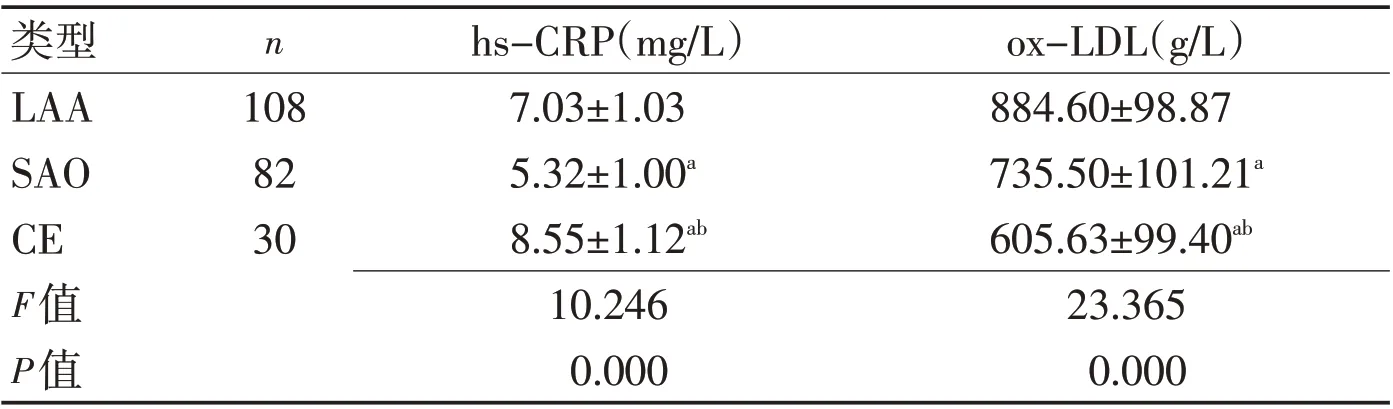
表3 观察组不同TOAST分型患者血清hs-CRP、ox-LDL水平比较 (±s)Table 3 Comparison of the levels of serum hs-CRP and ox-LDL in patients with different TOAST types in the observation group (±s)
注:与LAA比较,aP<0.05;与SAO比较,bP<0.05
类型LAA SAO CE F值P值ox-LDL(g/L)884.60±98.87 735.50±101.21a 605.63±99.40ab 23.365 0.000 n 108 82 30 hs-CRP(mg/L)7.03±1.03 5.32±1.00a 8.55±1.12ab 10.246 0.000
2.3 观察组不同TOAST 分型患者NIHSS 评分比较观察组LAA 型患者NIHSS 评分明显高于SAO 和CE 型患者(P<0.05),见表4、图3。
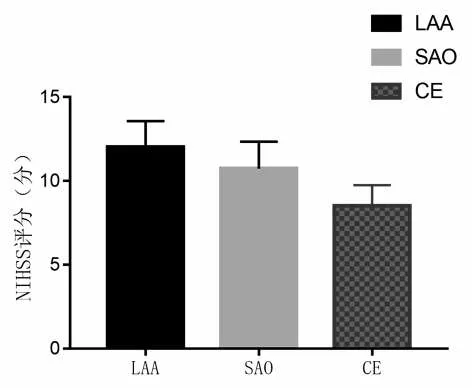
图3 不同TOAST分型患者NIHSS评分比较Figure 3 Comparison of NIHSS scores of patients with different TOAST classifications
表4 观察组不同TOAST分型患者NIHSS评分比较 (±s)Table 4 Comparison of NIHSS scores of patients with different TOAST types in the observation group (±s)

表4 观察组不同TOAST分型患者NIHSS评分比较 (±s)Table 4 Comparison of NIHSS scores of patients with different TOAST types in the observation group (±s)
注:与LAA比较,aP<0.05;与SAO比较,bP<0.05
类型LAA SAO CE n 108 82 30 NIHSS评分(分)12.03±1.54 10.74±1.61a 8.51±1.23ab F值23.154 P值0.000
2.4 相关性分析将观察组血清hs-CRP、ox-LDL 水平与NIHSS 评分进行相关分析,结果显示,hs-CRP、ox-LDL 与NIHSS 评分呈正相关(r=0.398 和0.404,P<0.05),hs-CRP与ox-LDL 呈正相关(r=0.480,P<0.05),见图4。

图4 血清hs-CRP、ox-LDL水平与NIHSS评分的相关性分析Figure 4 Correlation analysis of serum hs-CRP,ox-LDL levels and NIHSS score
3 讨论
研究显示,血管内皮损伤是动脉粥样硬化的病理基础,而炎症及氧化应激则是动脉粥样硬化的关键因素[11]。hs-CRP作为高敏炎性检测指标,是动脉粥样硬化等多种病理、生理变化的炎性程度评估指标。hs-CRP 可通过补体途径诱导动脉内膜损伤,进而参与血栓进程[12]。hs-CRP还可加剧动脉内膜局部炎症反应,进而诱导硬化斑块增厚,或促其破裂。本研究中观察组血清hs-CRP水平明显高于对照组,且观察组CE型患者hs-CRP明显高于LAA和SAO 型患者,表明hs-CRP 异常表达与脑梗死密切相关,同时还与患者TOAST 分型有关。CE 型脑梗死患者除脑局部缺血症状外,还存在至少一种心源性疾病,因此患者血液系统炎症状态较LAA 和SAO 型脑梗死患者更高。LAA主要出现在较大动脉内,患者斑块厚度往往高于SAO 型患者,且其血清炎症因子水平也较高。还有研究发现,不稳定性及稳定性斑块脑梗死患者hs-CRP 水平存在显著差异,不稳定性斑块患者hs-CRP 往往更高[13]。因此,本研究推测CE 型脑梗死患者斑块稳定性可能较其他分型患者更差,患者危险预后发生率更高,临床需加以重视。
氧化应激是动脉粥样硬化的关键因素,而低密度脂蛋白氧化成为ox-LDL则是氧化应激反应参与动脉粥硬化的中心环节[14]。低密度脂蛋白向ox-LDL 转化后,其生物学功能将发生变化,并形成多种化学趋化及细胞毒性作用,如ox-LDL可激活血小板功能,增强其黏附、聚集功能,进而参与动脉粥样硬化进程[15]。ox-LDL 还可通过结合巨噬细胞生成泡沫细胞,破坏血管内皮微结构,损伤血管平滑肌细胞,诱导血栓生成,并促使血管斑块破裂[16]。ox-LDL 是斑块内的一种特异表达物,健康动脉内并无该物质。研究发现动脉粥样硬化程度及斑块厚度与患者血清ox-LDL水平呈正相关,提示检测ox-LDL 对脑梗死的诊断及严重程度评估具有重要意义。本研究中观察组血清ox-LDL 水平明显高于对照组,且LAA 型患者ox-LDL水平明显高于SAO和CE型患者,可发现ox-LDL 异常表达是脑梗死发生、发展的重要影响因素,同时ox-LDL 异常表达与患者TOAST分型有关。SAO和CE型患者斑块厚度低于LAA 型患者,而ox-LDL 与斑块厚度存在直接联系。
NIHSS评分是脑梗死诊疗常用指标,可有效提示脑梗死患者神经功能缺损程度[17-18]。本研究中观察组LAA 型患者NIHSS 评分明显高于SAO和CE型患者,表明LAA型脑梗死患者神经功能缺损程度较其他分型患者更严重,可能与LAA 型患者动脉梗死程度更高有关,患者脑组织缺血梗死面积更大,相关脑组织功能损伤更严重[19]。相关性研究显示,hs-CRP、ox-LDL 与NIHSS 评 分 呈 正 相 关,hs-CRP 与ox-LDL 呈正相关,表明hs-CRP、ox-LDL 均可提示脑梗死患者神经功能缺损程度,且hs-CRP、ox-LDL 还可能存在协同效应,但具体机制尚不清楚,将会是以后研究的方向。
TOAST 分型对脑梗死诊断具有重要意义,但单纯性TOAST 分型仅能为诊断工作提供初步指导。研究发现hs-CRP、ox-LDL 与TOAST 分型存在密切联系,同时还与患者神经功能缺损程度有关,临床可在TOAST 分型评估的基础上,借助hs-CRP、ox-LDL 对患者进行二级诊断及预防。TOAST 分型不同,脑梗死患者血清hs-CRP、ox-LDL水平也存在一定差异,其与患者神经功能缺损程度存在一定联系。
