木犀草素对博来霉素诱导的肺上皮细胞增殖、凋亡及Hippo/Yes相关蛋白通路的影响
2021-12-16姜秀春王德军
姜秀春, 王德军, 于 贺
(辽宁省盘锦辽油宝石花医院 呼吸内科, 辽宁 盘锦, 124010)
肺上皮细胞是维持肺结构完整性以及正常肺功能的重要细胞[1-2]。木犀草素(Lut)可抑制下咽癌细胞、乳腺癌细胞、膀胱癌细胞增殖、侵袭和迁移并诱导其凋亡[3-5]。Hippo/Yes相关蛋白(YAP)通路已被证明与结肠癌、胃癌、肝癌等肿瘤的发生发展相关[6]; 该通路与主动脉瘤、组织纤维化、病毒性肝炎等人类疾病密切相关,通过低表达大肿瘤抑制基因2抑制Hippo信号通路,能改善急性呼吸窘迫综合征的肺水肿现象,调控肺内炎症反应[7]; YAP作为枢纽可通过调控Hippo通路抑制肝癌细胞增殖[8]。其中, 哺乳动物STE20样蛋白激酶1(MST1)和大肿瘤抑制基因(LAST1)为Hippo信号通路的上游效应蛋白,二者被磷酸化后可作用于YAP,且在正常情况下, YAP在细胞质中可参与正常组织的调节及代谢,维持细胞的正常状态。目前, Lut对博来霉素(BLM)诱导的肺上皮细胞Hippo/YAP通路及增殖凋亡的影响,尚未有报道。本研究将不同浓度的Lut应用于BLM体外诱导的BEAS-2B细胞后,检测其增殖及凋亡情况,并分析Hippo/YAP通路上MST1、LAST1和YAP的磷酸化水平,初步探讨其分子机制,为临床治疗肺损伤提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞株: 人肺正常上皮细胞(BEAS-2B细胞,目录号: SCSP-5067), 由中国科学院典型培养物保存委员会细胞库提供。
1.1.2 主要试剂及仪器: 胎牛血清(FBS)和DMEM/F12培养基均购自美国Giboc公司; 四甲基亚砜(DMSO)、四甲基偶氮唑蓝(MTT)和β-actin鼠抗均购自美国Sigma公司; Lut 20 mg/支(纯度98%)购自上海源叶生物科技有限公司; 蛋白提取试剂盒、ECL显色试剂盒和BCA蛋白定量试剂盒购自北京中杉金桥生物科技有限公司; 细胞凋亡检测试剂盒购自嘉美生物技术有限公司; 96孔培养板和CKK-8试剂盒均购自上海生工生物工程有限公司; MST1、LAST1、YAP、p-MST1、p-LAST1、p-YAP兔单克隆抗体以及辣根过氧化物酶标记的羊抗兔IgG二抗均购自美国Abcam公司; 酶标仪Fax-20100购自美国INStat公司; 蛋白凝胶成像仪购自美国Bio-Red公司; CKX41倒置显微镜购自日本Olympus公司。
1.2 方法
1.2.1 细胞培养: 将BEAS-2B细胞接种至含10% FBS的DMEM/F12培养基中,并置于37 ℃、含5% CO2的恒温细胞培养箱中培养,当细胞密度大于80%时,用含0.25% EDTA-Na2的胰蛋白酶消化并传代。
1.2.2 筛选BLM的诱导浓度: 将对数期的BEAS-2B细胞使用含0.25% EDTA-Na2的胰蛋白酶消化,用不含FBS的DMEM/F12培养基制成细胞悬液,并调整细胞浓度为5×104个/mL, 每孔各取200 μL接种至96孔板后持续培养24 h,使细胞铺满孔底。使用适量磷酸缓冲液(PBS)溶解BLM,设置对照组(不含BLM)以及4、8、12、24 μg/mL BLM诱导12、24、48 h后的实验组,各实验组中分别加入含4、8、12、24 μg/mL BLM且用不含FBS的DMEM/F12培养基培养; 对照组细胞仅在培养基中添加溶剂。每组设置6个复孔,每孔各加入MTT溶液20 μL, 继续孵育4 h后,吸取各孔细胞上清液,加入150 μL的DMSO, 充分震荡混匀,反应15 min并用全自动酶标仪检测各孔在570 nm处的吸光度(OD值),然后计算细胞存活率。细胞存活率(%)=(实验组OD570 nm-空白组OD570 nm)/(对照组OD570 nm-空白组OD570 nm)×100%。
1.2.3 细胞分组及处理方法: 以0.05% DMSO为溶剂,将Lut粉末溶解,配制Lut溶液,选取 BLM 8 μg/mL作用24 h为诱导的浓度和时间。将BEAS-2B细胞分为BLM组(加入终浓度为8 μg/mL的BLM)、Lut低、中、高浓度组(根据参考文献[9]及前期预实验分别在培养基中加入终浓度为60、80、100 μmol/L的Lut和8 μg/mL的BLM混合溶液)、对照组(仅在培养基中添加等量溶剂)。各组均使用不含FBS的DMEM/F12培养基继续培养24 h后,检测各项指标。
1.2.4 倒置显微镜观察各组细胞形态: 收集上述1.2.3中分组并培养24 h后的各组细胞,去除旧培养基, PBS清洗3次后,置于倒置显微镜下观察各组细胞形态。
1.2.5 CCK-8法检测各组细胞增殖能力: 收集细胞接种至96孔板(1.0×105个/孔)中,使用不同浓度Lut(60、80、100 μmol/L)和8 μg/mL BLM分别处理24 h后加入10 μL CKK-8试剂于每个孔中,然后孵育2 h, 采用全自动酶标仪检测450 nm波长下各孔细胞的OD值, OD值越大表示细胞增殖能力越强。
1.2.6 流式细胞仪检测细胞凋亡率: 收集上述1.2.3中分组并培养24 h后的各组细胞,按细胞凋亡检测试剂盒(FragELTMDNA Fragmentation Detection Kit)说明书严格操作,上流式细胞仪检测细胞凋亡,每组设置6个重复。
1.2.7 蛋白免疫印迹法(Western blot)方法检测BEAS-2B细胞MST1、LAST1和YAP蛋白磷酸化水平: 收集上述1.2.3中分组并培养24 h后的各组细胞,使用蛋白提取试剂盒提取各组细胞总蛋白。使用BCA蛋白定量试剂盒对蛋白进行定量,然后进行SDS-PAGE、转膜、抗体封闭、1∶1 000浓度稀释后的MST1、LAST1、YAP、p-MST1、p-LAST1、p-YAP和1∶20 00浓度稀释后的β-actin一抗4 ℃过夜孵育、含辣根过氧化物酶缀合的IgG二抗中室温孵育2 h, 用ECL显色试剂盒显色,凝胶成像仪拍照,分析灰度值,以β-actin为内参,分析蛋白相对表达水平。
1.3 统计学分析

2 结 果
2.1 BLM诱导对BEAS-2B细胞存活率的影响
随着BLM诱导浓度的升高以及诱导时间的延长, BEAS-2B细胞存活率逐渐降低(P<0.05)。BLM诱导24 h BEAS-2B细胞的半数抑制浓度(IC50)约为8 μg/mL, 所以后续将选取8 μg/mL BLM作用24 h为BLM诱导BEAS-2B细胞的浓度和时间。见表1。

表1 各浓度BLM诱导不同时间后BEAS-2B细胞存活率比较
2.2 Lut对BLM诱导的BEAS-2B细胞增殖能力的影响
观察细胞形态后发现: 对照组细胞形态正常,大小均匀,排列紧密且呈三角形鹅卵石样,可见胞内细胞质均匀透亮; BLM组细胞较小,细胞呈梭形、纺锤形,边缘不规则,细胞间隙增加; Lut低、中、高浓度组细胞形态逐渐趋于正常。见图1。与对照组OD值(1.00±0.00)相比, BLM组BEAS-2B细胞增殖能力OD值(0.34±0.05)显著降低(P<0.05); 与BLM组相比, Lut低、中、高浓度组BEAS-2B细胞增殖能力OD值(0.59±0.06)、(0.72±0.09)、(0.86±0.09)逐渐升高(均P<0.05)。
2.3 Lut对BLM诱导的BEAS-2B细胞凋亡的影响
与对照组(3.05±0.41)%相比, BLM组BEAS-2B细胞凋亡率(39.79±4.59)%显著升高(P<0.05); 与BLM组相比, Lut低、中、高浓度组BEAS-2B细胞凋亡率(21.51±2.36)%、(15.76±1.73)%、(8.30±0.94)%依次降低(均P<0.05)。见图2。
2.4 Lut对BLM诱导的BEAS-2B细胞Hippo/YAP通路影响
与对照组相比, BLM组BEAS-2B细胞MST1、LAST1和YAP蛋白磷酸化水平显著降低(P<0.05); 与BLM组相比, Lut低、中、高浓度组BEAS-2B细胞MST1、LAST1和YAP蛋白磷酸化水平依次升高(P<0.05)。见表2、图3。
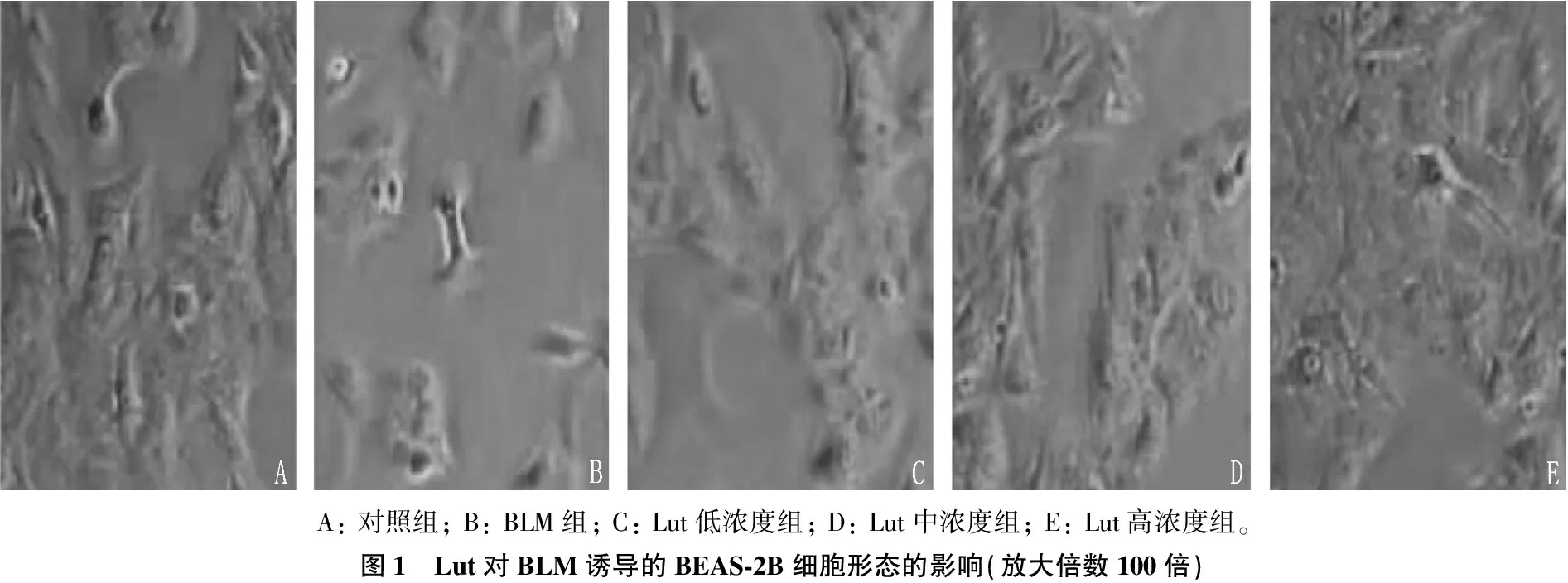
A: 对照组; B: BLM组; C: Lut低浓度组; D: Lut中浓度组; E: Lut高浓度组。图1 Lut对BLM诱导的BEAS-2B细胞形态的影响(放大倍数100倍)


表2 各组BEAS-2B细胞MST1、LAST1和YAP磷酸化水平比较

A: 对照组; B: BLM组; C: Lut低浓度组; D: Lut中浓度组; E: Lut高浓度组。图3 Lut对BLM诱导的BEAS-2B细胞MST1、LAST1和YAP磷酸化水平的影响
3 讨 论
大多数肺部疾病最终会导致肺换气功能障碍、呼吸衰竭,其病情进展快,病死率高,但目前对肺部疾病的治疗手段有限且疗效不佳,多数肺部疾病均可引起肺上皮细胞损伤[10-11], 因此,研究如何改善肺上皮细胞损伤对于肺部疾病的治疗至关重要。BLM能够引起肺毒性、肺上皮细胞损伤、肺炎和肺纤维化等多种肺部疾病[12], 所以,本研究在前人研究的基础上使用不同浓度BLM诱导BEAS-2B细胞后,发现随着BLM浓度的升高以及诱导时间的延长, BEAS-2B细胞的存活率显著降低,且其诱导24 h后细胞的IC50约为8 μg/mL, 所以后续选取8 μg/mL BLM诱导细胞24 h构建体外细胞模型。
中医药治疗肺部疾病的历史源远流长,其中, Lut是一种存在于金银花、菊花、荆芥、白毛夏枯草等传统中药中的重要黄酮类化合物,具有抗炎、降糖、抗氧化、抗肿瘤等多种作用,目前在临床上常用于止咳、祛痰、降尿酸等,同时可用于治疗心血管疾病[13]。研究[14-16]发现, Lut能够抑制三阴性乳腺癌、非小细胞肺癌、结肠癌细胞的增殖、迁移及凋亡。Lut具有调节肺上皮离子转运的作用,主要通过提高急性肺损伤中上皮钠通道蛋白表达来实现[17], 治疗由脓毒症诱导的急性肺损伤[18]。但是,关于Lut对BLM诱导的BEAS-2B细胞增殖、凋亡的影响及其作用机制的报道较少。本研究使用Lut作用于BLM诱导的BEAS-2B细胞后,发现其可使形态异常的BEAS-2B细胞趋向正常,并显著提高细胞增殖能力,降低细胞凋亡率,提示Lut具有促进肺上皮细胞增殖、抑制凋亡的作用,但其中的机制尚需进一步研究。
Hippo通路是控制组织器官大小、平衡调控器官体积、调节细胞间接触抑制的重要转导通路。而YAP信号通路已经被证明与肝癌的发生及发展相关[19]。其中YAP是Hippo途径的重要影响因子,其活性对于器官生长、细胞增殖、组织更新与再生至关重要,且能够调控组织病变进程[20]。MST1和LAST1为Hippo/YAP通路的主要效应因子,其磷酸化蛋白可对YAP起作用,进而调节细胞和组织的生长和代谢功能[21]。俞晓军[22]研究发现,尼可地尔可能抑制Hippo/YAP信号通路,进而抑制肺动脉硬化体外模型中肺动脉平滑肌细胞的增殖和迁移。本研究结果显示, Lut作用于BLM诱导的BEAS-2B细胞后, Hippo通路下游MST1、LAST1和YAP磷酸化水平显著提高,提示Lut可能通过促进MST1、LAST1和YAP磷酸化水平,激活Hippo/YAP信号通路,从而提高BEAS-2B细胞增殖能力,抑制其凋亡,与上述俞晓军[22]研究结果一致。研究[23]发现, Lut可显著下调Hippo通路下游LATS1和YAP磷酸化水平,减少YAP核定位,进而改善野百合碱诱导的大鼠肺动脉高血压,但与本研究结果并不一致,可能是由于Lut在不同的组织和细胞中,对Hippo/YAP信号通路所发挥的作用不尽相同,进一步说明Lut对Hippo/YAP信号通路具有调控作用。
综上所述, Lut可能通过激活Hippo/YAP信号通路,缓解BLM诱导的BEAS-2B细胞损伤,提高细胞增殖能力,抑制凋亡。本研究为Lut治疗肺部疾病的相关机制研究提供了一定的参考。然而, BLM诱导肺上皮细胞损伤的相关分子机制十分复杂,尚需后续深入研究。
