不同致病性的麦根腐平脐蠕孢菌代谢组学分析
2021-12-16汪军成姚立蓉司二静马小乐李葆春尚勋武王化俊孟亚雄
张 琳,杨 轲,汪军成,姚立蓉,司二静,马小乐,李葆春,尚勋武,王化俊,孟亚雄
(1.甘肃省干旱生境作物学重点实验室,甘肃省作物遗传改良与种质创新重点实验室,甘肃兰州 730070;2.甘肃农业大学农学院,甘肃兰州 730070;3.甘肃农业大学生命科学技术学院,甘肃兰州 730070)
麦根腐平脐蠕孢菌(Bipolaris sorokiniana,有性态为Cochliobolus sativus)属半活体营养型植物病原菌,可引起小麦、大麦、燕麦及水稻等多种禾本科作物叶斑病害[1-3]。樊学广等[4]研究发现,麦根腐平脐蠕孢菌引起的小麦根腐病可导致小麦生长缓慢,产量降低,减产幅度达10%~50%,严重影响小麦的产量和品质。于静[5]研究了由麦根腐平脐蠕孢引起的玉米麦根腐平脐蠕孢叶斑病,发现病原体通过侵染玉米叶面,使光合作用减弱,严重影响玉米吸收养分,导致玉米质量下降。庞云星等[6]研究发现,麦根腐平脐蠕孢菌侵染大麦可引起根腐病和黑胚病,一般而言,叶斑病流行的年份黑胚病也危害严重,这是导致大麦减产和品质严重降低的重要原因。
由于麦根腐平脐蠕孢菌对作物具有较大破坏性、毁灭性以及难防治性。因此,对麦根腐平脐蠕孢菌的调控网络和致病机制的研究具有十分重要的意义。陈琳等[7]为探索引起麦根腐平脐蠕孢菌致病性变异及其寄主专化性的原因,利用液相色谱串联质谱技术(LC-MS/MS)和非标记定量技术对分离来自大麦和小麦的毒性差异菌株进行蛋白质组分析,获得了差异表达蛋白。魏玲玲等[8]利用广泛靶向代谢组技术,分析对白粉病不同抗性青稞叶片中的代谢物,为揭示青稞抗白粉病的代谢机制提供了理论支撑。史怀等[9]通过代谢组学方法,对不同致病性青枯雷尔氏菌的胞外代谢物进行了分析,结果表明,这些代谢标志物可能与青枯雷尔氏菌的致病性有关。因此,通过代谢组学分析不同致病性麦根腐平脐蠕孢菌,明确其致病性差异原因对其病害的防治有着重要的意义,但不同致病性麦根腐平脐蠕孢菌的代谢组学分析尚未见报道。
本研究通过大麦叶斑病苗期侵染型分级标准测定了麦根平脐蠕孢菌弱致病性菌株ND-85 和强致病性菌株ND-87 的致病性,而后采用非靶向代谢组学技术和多元统计分析方法,分析2 株菌株的差异代谢物,结合KEGG 分析研究其代谢通路富集情况,通过从代谢组学分析2 株菌株存在致病力差异的原因,旨在为研究不同麦根腐平脐蠕孢菌的致病力差异奠定基础。
1 材料和方法
1.1 试验材料
供试大麦叶斑病感病品种为蒙啤麦1 号,由甘肃农业大学麦类课题组提供。
弱致病性麦根腐平脐蠕孢菌菌株ND-85 和强致病性麦根平脐蠕孢菌菌株ND-87 由甘肃农业大学麦类课题组鉴定并保存。
马铃薯葡萄糖培养基(PDA):马铃薯200 g、琼脂粉17 g、葡萄糖20 g,1 L 去离子水。121 ℃灭菌20 min 备用。LB 培养基:10 g 胰蛋白胨,10 g 氯化钠,5 g 酵母粉,调pH 值至7.0~7.5,倒入适量蒸馏水溶解混匀,定容到1 L。于121 ℃高压蒸汽灭菌20 min 后,保存备用。
1.2 试验方法
将土、沙、蛭石以1∶1∶1(体积比)混合均匀,高压灭菌。大麦种子用5%次氯酸钠溶液和70%酒精溶液,然后用蒸馏水冲洗3~5 次,继续温水浸种0.5 h。在培养皿中发芽5~7 d,移栽到直径7 cm 的小花盆中,每个花盆5 穴,每穴3 粒,在22 ℃的温室中培养。
挑取在4 ℃保存的菌株ND-85 和ND-87 接种于PDA 培养基上,放置在25 ℃培养箱黑暗培养10 d 后,用含0.25%Tween 20 的ddH2O 冲刷菌落,用纱布过滤菌液备用。待蒙啤麦1 号植株长至两叶一心期(移栽后15 d),将浓度为1.0×104个/mL 麦根平脐蠕孢菌孢子悬浮液喷洒到叶片上,接种1 d,早晚喷施2 次,在接种期间温室处于黑暗状态,温度22 ℃,湿度100%,以确保植株发病,对照则是在相同条件下生长不接菌的蒙啤麦1 号。从接菌后开始观察植株叶片发病情况,发病等级的评定参照FETCH 等[10]和惠慧等[11]的方法,以此测定2 种菌株的致病力。
1.3 样本制备和代谢物提取
挑取在4 ℃保存的菌株ND-85 和ND-87 接种于PDA 培养基上,放置在25 ℃培养箱中黑暗培养,待菌株培养10 d,分离2 种菌株的孢子,方法如下:在超净工作台中用挑菌器挑取菌株放于无菌LB培养基中,置于摇床25 ℃180 r/min 条件下培养,待出现病原菌孢子时将其在无菌环境下进行过滤,期间用ddH2O 进行反复冲洗,用无菌滤纸吸干水分,收集孢子。样本制备各设置6 个重复,密封保存于2 mL 离心管放至-80 ℃备用。
按照DUNN 等[12]与EVA 等[13]的方法,将样本于液氮中研磨;取50 mg 样本于2 mL 离心管中加入1 000 μL甲醇(-20 ℃),涡旋振荡1 min;12 000 r/min 4 ℃离心10 min,取上清液450 μL 至2 mL 离心管中,采用真空浓缩仪浓缩至尽干;加入150 μL的80%甲醇配置的2-氯苯丙氨酸溶液(0.004 g/L)(-20 ℃保存)复溶样品,经过0.22 μm 膜过滤,过滤液加入到检测瓶中。从每个待测样本各取20 μL混合成QC样本(QC,Quality control,用来校正混合样品分析结果的偏差以及由于分析仪器自身原因所造成的失误),用剩余待测样本进行LC-MS 检测[14]。
1.4 代谢物检测
LC-MS 采用UltiMate 3000Q(ThermoFisher Scientific,USA)和Exactive 高分辨质谱仪(ThermoFisher Scientific,USA)来进行代谢物的分离和检测,所用色谱柱为UPLC HSS T3 色谱柱(2.1 mm×100 mm,1.7 μm,Waters)[15]。质谱试验使用ThermoQExactive,电喷雾离子源(ESI)正负离子电离模式,同时采用动态排除法去除不必要的MS/MS 信息[16]。
1.5 代谢物的鉴定和分析
使用Proteowizard(v3.0.8789)将原始数据文件转换为mzXMLformat,然后使用R 包XCMS(v3.1.3)软件进行分析,最终得到一个保留时间、质荷比和峰强度的数据矩阵,根据公共数据库与软件自建数据库对代谢物进行定性,利用归一化后的数据矩阵进行多元统计分析:主成分分析(PCA 分析)、正交偏最小二乘判别分析(OPLS-DA 分析)和筛选差异代谢物(变量权重值VIP≥1 且t 检验P 值<0.05),然后对差异代谢物进行聚类热图分析和代谢通路KEGG 富集分析(t 检验P 值<0.05)[17]。
2 结果与分析
2.1 致病力分析

研究将菌株ND-85 和ND-87 接种于蒙啤麦1 号,观察植株叶片发病情况,接菌36 h 后发现,蒙啤麦1 号的叶片表型有差异,参考Fetch 标准,ND-85 病斑较多,病斑呈现褐色或浅褐色,多为椭圆或长椭圆形,病斑中等大小,周围具有明显的弥散状的褪绿晕圈,病斑间褪绿晕圈不连片,侵染等级属于6 级(图1-A);ND-87 病斑大且较多,褐色至深褐色,长椭圆或长条形,沿叶脉纵向扩展,周围具有明显的弥散状褪绿晕圈,病斑连片居多,属于Fetch 标准的第8 等级(图1-B)。表明菌株ND-85与菌株ND-87 致病力存在明显差异,测定ND-85为弱致病性菌株,ND-87 为强致病性菌株。
2.2 代谢物定性定量分析
2.2.1 代谢物定性分析 菌株ND-85 和ND-87 共检测出11570 种物质,正离子代谢物质包括8110 种,负离子代谢物质3 460 种,其中鉴定到的已知代谢物是2 223 种,但有9 347 种代谢物尚未定性。对2 个菌株的已知代谢物进行聚类分析,得到136 类代谢物,如图2-A 所示,羧酸及其衍生物有258 种;苯及其取代衍生物有185 种;脂肪酰类物质有162 种;有机氧化合物包括152 种;90 种类固醇及类固醇衍生物;78 种脂质类物质;44 种酚类物质;38 种吲哚类和衍生品;37 种吡啶和衍生品;咪唑嘧啶类物质和有机氮类化合物36 种;28 种二嗪类物质;27 种酮酸及其衍生物;25 种喹啉及衍生品和类黄酮类物质;21 种唑类物质;20 种羟基酸及其衍生物和异黄酮类物质;19 种蝶啶和衍生品;18 种肉桂酸及其衍生物和嘌呤核苷;15 种嘧啶核苷酸;14 种萘和香豆素及衍生品;13 种有机磷酸及其衍生物、碳水化合物和碳水化合物结合物和嘌呤核苷酸;12 种酚醚类物质;11 种对称二苯代乙烯和线性1,3-二芳基丙烷;9 种甘油磷脂、苯丙酸、苯基丙酸和异喹啉和衍生物;8 种苯噻嗪和内酯类物质;7 种5′-脱氧核苷、吗啡、二元胺、内酰胺和羰基化合物;6 种哌啶、苯并吡喃、苯丙氮类物质、嘧啶核苷和苯二氮平类药物;醇类和多元醇、菲和衍生物、四吡咯和衍生物各5 种;育亨宾类生物碱、三联苯、肽类、生物碱、苯并咪唑、有机硫代磷酸及其衍生物各4 种;氮杂环丙烷、吡咯、四环素、黄素核苷酸、丁烷木酚素、蒽、苯并二恶茂烷、糠醛、有机磺酸及其衍生物、有机膦酸及其衍生物各3 种;噻二嗪、核苷和核苷类似物、生物碱、鞘脂类等26 类物质各2 种;二氧吡咯、内源性大麻素、苯噻嗪类、木酚素内酯等46 类物质各1 种。菌株ND-85、菌株ND-87 的代谢物分类相同,故需进一步对2 种菌株的代谢物进行定量分析。
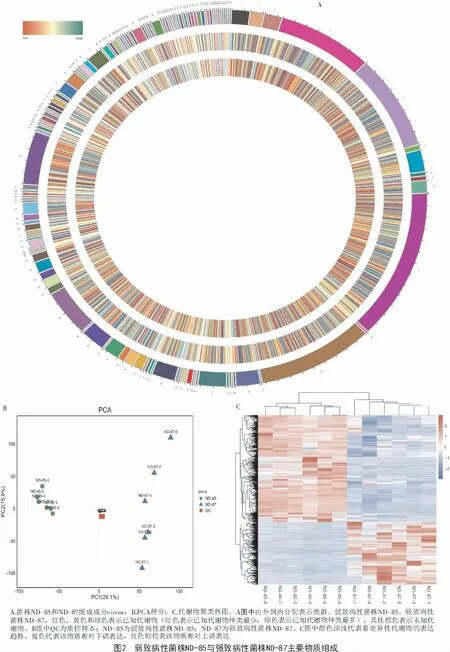
2.2.2 代谢物样本质控分析 PCA 主要用于观察样本组间分离趋势以及是否有异常点出现,同时从原始数据上反映组间和组内的变异度[18-19]。QC 工作是进行基于质谱技术的代谢组学研究时获得可靠且高质量的代谢组学数据的基础,本研究对试验样本菌株ND-85、ND-87 和质控样本QC 进行主成分分析(PCA)。由图2-B 可得,通过观察质控样本间的离散度,质控样本QC 相对于试验样本聚集,且质控样本QC 误差在小于2 倍的标准偏差以内,表明本试验LC-MS 检测的系统误差在可控范围内,可以得知仪器分析的稳定性和可靠性,进行下一步试验。
2.2.3 代谢物定量分析 利用Proteowizard 软件(v3.0.8789)将原始数据转换成mzXML 格式利用R(v3.1.3)的XCMS 程序包进行分析鉴定。首先根据精确分子量进行确认(分子量误差≤15 mg/kg(质量偏差值)),后续根据MS/MS 碎片模式比对Human Metabolome Database(HMDB)得出表1,其鉴定得到的正负模式代谢物为11 570 种,已知代谢物有2 223 种,利用二级谱图鉴定到的物质有521 种,利用一级谱图鉴定到的物质共1 702 种,未知代谢物有9 347 种。

表1 代谢物鉴定结果 种
2.2.4 代谢物聚类热图分析 将表1 中11 570 种代谢物数据进行以2 为底的对数转换和z-score 标准化(zero-mean normalization)处理,然后进行层次聚类分析,采用欧氏距离进行计算,如图2-C 所示,菌株ND-87 和ND-85 高表达量的代谢物之间存在明显差异代谢物。
2.3 多元统计分析
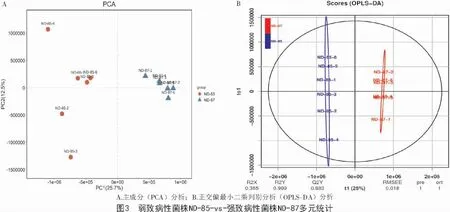
利用SIMCA-P 软件,将菌株ND-85 和ND-87的代谢产物数据进行对数转换后建模,而后对结果进行主成分PCA分析(图3-A),以反映菌株ND-85、ND-87 代谢物的相似性和差异性。由图3-A 可知,菌株ND-85 与菌株ND-87 在第1 主成分(PC1)上有明显分离,二者表现在组间出现分离趋势,在第1 主成分(PC1)、第2 主成分(PC2)表现出组内聚集趋势。其中,第1 主成分(PC1)的贡献率为25.7%,而第2 主成分(PC2)贡献率则为12.5%,二者累计贡献率达到38.2%,表明菌株ND-85 与菌株ND-87代谢调控不同。
2.3.1 正交偏最小二乘判别分析(OPLS-DA)正交偏最小二乘判别分析是代谢组数据分析中常用的分析方法,是PLS-DA 的扩展[20]。图3-B 为OPLSDA 得分图,结果与PCA 结果大体一致。评价OPLSDA 模型的预测参数有R2X、R2Y 和Q2,这3 个指标越接近1 表明模型越稳定可靠。结果显示,OPLSDA 模型稳定性良好且预测能力较强,后续的模型检验和差异代谢物筛选用OPLS-DA 结果可以进行分析。并且菌株ND-85 与菌株ND-87 之间完全不重合,表明2 种菌株的代谢模式存在差异。
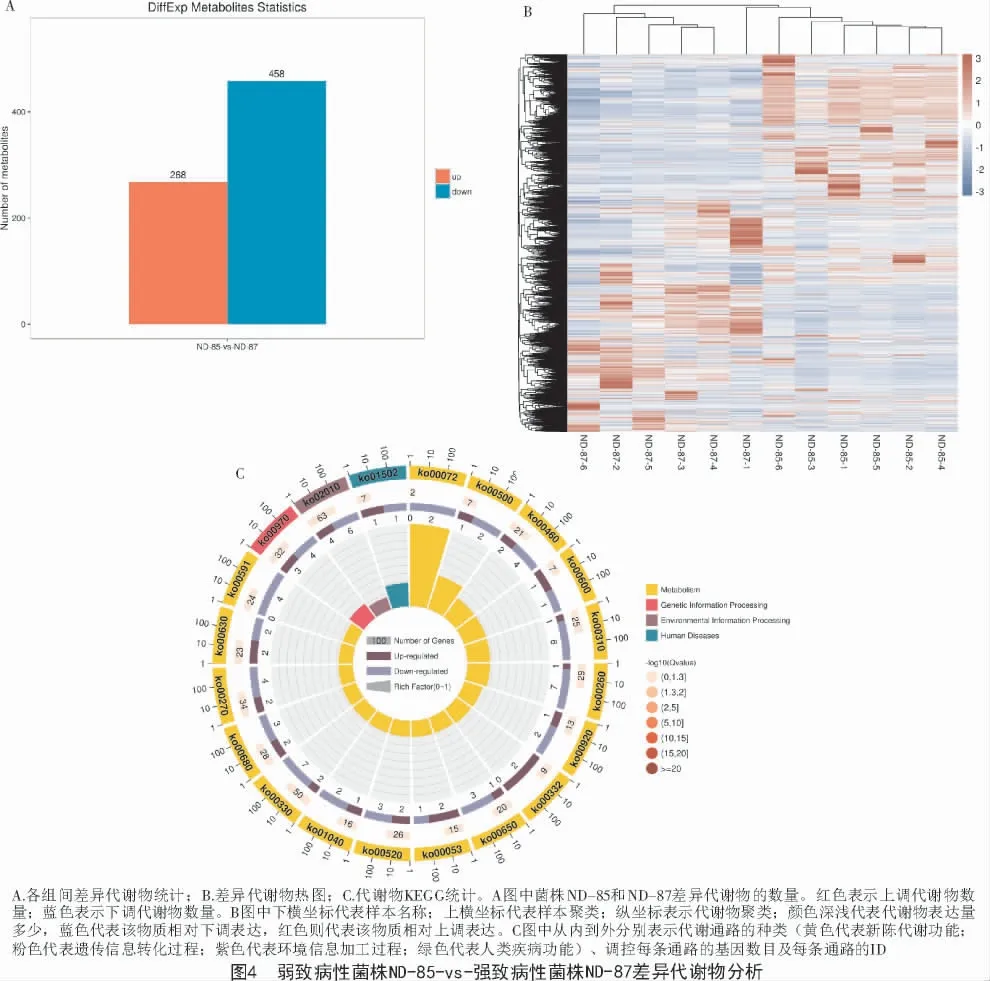
2.3.2 差异代谢物筛选 结合多元统计分析正交偏最小二乘判别分析的变量权重值(VIP 值)和t 检验来筛选不同比较组间的显著差异代谢物,探讨不同致病性菌株代谢途径的变化。显著差异的阈值为:VIP≥1 且t 检验的P<0.05。如图4-A 所示,从11 570 代谢物中筛选差异代谢物,筛选出726 种重叠的差异代谢物,菌株ND-85 与菌株ND-87 相比差异代谢物有458 种下调,主要包括有机酸、酯类物质等,而有268 种差异代谢物上调,主要包括氨基酸、有机酸、硒等。
2.3.3 差异代谢物聚类热图 将比较2 个菌株组间的差异代谢物进行数据归一化后进行聚类分析并作图,可直观展示差异代谢物在比较组中的积累差异,如图4-B 所示,菌株ND-85 与菌株ND-87 有明确的高或者低表达区域,差异代谢物表达量高的区域或表达量低的区域整体不同,且菌株ND-85 的上调差异代谢物较多,菌株ND-87 的下调差异代谢物较多。
2.4 代谢通路分析
2.4.1 代谢物KEGG 注释 在KEGG 代谢物数据库检索菌株ND-85 与菌株ND-87 所得代谢物进行KEGG 注释,分为6 大功能类别,其中,参与新陈代谢功能过程的有85 种代谢通路包括1 730 种代谢物;参与人类疾病功能过程有3 种代谢通路包括15 种代谢物;参与环境信息加工过程有2 种代谢通路包括67 种代谢物;参与遗传信息转化功能过程有2 种代谢通路包括36 种代谢物;参与细胞加工过程包括2 种代谢通路包括33 种代谢物;参与生物系统功能过程只有1 种代谢通路包含1 种代谢物,共2856 种代谢物。
如图4-C 所示,菌株ND-85 与菌株ND-87 对比分析得到的差异代谢物分为4 大类别,即新陈代谢功能、人类疾病功能、环境信息加工过程和遗传信息转化过程,其中,参与新陈代谢功能过程有63 种代谢通路,包括276 种代谢物;人类疾病功能过程的仅有耐万古霉素合成1 种代谢通路,包括2 种代谢物;参与环境信息加工过程的通路包括ABC 转运蛋白合成通路,包括10 种代谢物;参与遗传信息转化过程的有tRNA-氨酰基生物合成一种代谢通路,包括7 种代谢物,共295 种差异代谢物,其中明显上调的代谢物包括89 种,如羟基酸及其衍生物、二氢呋喃、羧酸及其衍生物等,明显下调的代谢物包括206 种,如羧酸及其衍生物、酚类化合物、羟基酸及其衍生物等。
2.4.2 差异代谢物KEGG 分析 取2 个菌株差异代谢物的66 类代谢通路中的前20 种代谢通路进行分析,如图4-C 所示,得到新陈代谢功能类的17 种代谢途径包括甘氨酸、丝氨酸和苏氨酸的生物合成,酮体的合成与降解,淀粉和蔗糖生物合成,鞘脂类代谢等,有羧酸及其衍生物、有机氮化合物等代谢物;遗传信息转化过程有tRNA-氨酰基生物合成途径,主要代谢物有羧酸及其衍生物;环境信息加工过程包括ABC 转运蛋白合成途径,主要代谢物有有机氮化合物;人类疾病功能过程包括耐万古霉素类物质的合成途径,主要代谢物是酮酸及其衍生物。
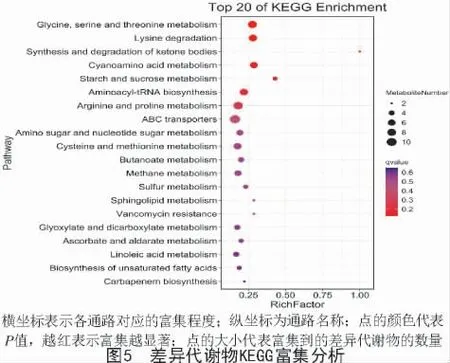
由表2 可知,其中有7 条代谢通路显著变化(P<0.05,VIP≥1)包括甘氨酸、丝氨酸和苏氨酸的代谢,赖氨酸降解,酮体的合成与降解,氰胺基酸代谢,淀粉和蔗糖的代谢,tRNA-氨酰生物合成,精氨酸和脯氨酸代谢。由图5 可知,甘氨酸、丝氨酸和苏氨酸的生物合成通路富集最为显著,ABC 转运蛋白及精氨酸和脯氨酸的代谢合成途径富集程度较高。

表2 ND -85 -vs -ND -87 的通路富集分析
3 结论与讨论
3.1 菌株致病力分析
本研究利用大麦叶斑病感病材料蒙啤麦1 号,在相同条件下分别接种菌株ND-85 和ND-87,根据大麦叶斑病苗期侵染型分级标准观察不同菌株侵染下的植株叶片发病情况,以此来测定菌株致病性的强弱,结果表明,2 种菌株致病力存在明显差异。姚全杰等[21]的研究结果表明,同一大麦种质对不同菌株的抗性水平有所不同,这与本研究的结果相似。但导致不同菌株致病性差异的原因研究较少,还有待进一步研究。
3.2 差异代谢物分析
代谢组学是对某一生物或细胞在特定生理时期内所有低分子量代谢产物同时进行定性定量分析的一门新学科,在代谢途径解析中发挥了重要作用[22]。WANG 等[23]采用广泛靶向代谢组学方法,分别对盐地碱蓬和欧洲海蓬子叶片中822、694 个代谢产物进行了鉴定,为今后这2 种植物的开发利用提供了基础数据。本试验共从菌株ND-85 和ND-87检测出11570 种物质,正离子代谢物质包括8110 种,负离子代谢物物质3 460 种,其中,鉴定到的已知代谢物是2 223 种,但有9 347 种代谢物尚未定性。对2 个菌株的已知代谢物进行聚类分析,得到136 类代谢物。但由于代谢物种类较多,比较发现,2 种菌株代谢物定性没有明显差异,需进一步对其代谢产物进行定量分析来明确其差异原因。霍冬敖等[24]利用正交偏最小二乘判别分析发现,从野生韭籽和栽培韭籽中共筛选出12 类显著变化的差异代谢物,共计492 种。本研究利用相同方法对菌株ND-85 和ND-87 的代谢物进行分析,共筛选出726 种重叠的差异代谢产物,有458 种差异代谢物下调,主要包括有机酸、酯类物质等;有268 种差异代谢物上调,主要包括氨基酸、有机酸、硒等。前人研究结果表明,一氧化氮对植物病原真菌炭疽菌(Colletotrichum coccodes)和白粉菌(Blumeria graminis)的分生孢子萌发和附着胞的形成具有调控作用,而精氨酸作为一氧化氮的前体在此过程中起着关键作用[25]。CHEN 等[26]通过比较禾谷镰刀菌野生株基因缺失突变体的代谢组发现,有机酸和氨基酸的代谢存在着显著差异。而在本研究中,菌株ND-85 和ND-87的差异代谢物包括有机酸和氨基酸,因此,推测菌株ND-85 和ND-87 的致病性差异与有机酸和氨基酸的代谢有关。
3.3 差异代谢通路分析
对KEGG 分析得到的66 条代谢通路进行比较发现,甘氨酸、丝氨酸和苏氨酸的代谢,赖氨酸降解,酮体的合成与降解,氰胺基酸代谢,淀粉和蔗糖的代谢,tRNA-氨酰生物合成,精氨酸和脯氨酸的代谢这7 种代谢通路有显著差异,其中,甘氨酸、丝氨酸和苏氨酸生物合成通路的富集最为显著,ABC转运蛋白合成途径的富集程度最高。因此,推测耐万古霉素类生物合成、ABC 转运蛋白合成、tRNA-氨酰生物合成以及甘氨酸、丝氨酸和苏氨酸的生物合成、精氨酸和脯氨酸的代谢、赖氨酸降解途径都是影响致病性的因素。
杨玉宏等[27]研究结果表明,氨酰-tRNA 合成酶(AaRS)是生物体内蛋白质合成途径中的一类关键酶,该酶不仅与传染病、癌症和自身免疫疾病有关,而且还与其他多种疾病的发生和发展有着密切的联系。因此,氨酰-tRNA 合成酶是生物体内蛋白质合成途径中的一类关键酶,在真菌上该酶也会导致植株产生病害[28]。环境信息加工过程包括ABC 转运蛋白合成途径,主要代谢物有有机氮化合物。秦鹏等[29]研究发现,ABC 转运蛋白通路随着发酵时间的增加而变为虫草素调控的枢纽,可能与高产虫草素蛹虫草菌对虫草素的自我解毒能力有关。此外,ABC 转运蛋白通路可将菌株释放的防御物质变为无毒化合物,从而有利于病原菌侵入寄主,因此,其与菌株的致病性相关[30]。人类疾病功能过程包括耐万古霉素类物质的合成途径,主要代谢物是酮酸及其衍生物。孙琅[31]研究发现,万古霉素耐药金黄色葡萄球菌存在固有耐药和获得性耐药,导致其对很多常用抗菌药物耐药。说明万古霉素耐药金黄色葡萄球菌对抗菌的物质表现一定的抗性,从而促进病原菌的致病性。
本研究首先通过大麦叶斑病苗期侵染型分级标准鉴定测定强致病性菌株ND-85、弱致病性菌株ND-87,进一步对菌株ND-85、菌株ND-87 代谢物定性分析,发现2 种菌株次生代谢物种类没有明显的差别,通过定量分析鉴定到已知次生代谢物质是2 223 种,仍有9 347 种代谢产物尚未确定其分子特征。主成分分析(PCA)显示,菌株ND-85 和菌株ND-87 间分散明显,正交偏最小二乘法判别分析得出,菌株ND-85 和菌株ND-87 共有726 种重叠的差异代谢产物,差异代谢物相比有458 种下调,268 种上调。通过对差异代谢产物进行KEGG 注释得出66 类代谢通路,进而通过KEGG 富集分析发现,7 条代谢通路显著变化,其中甘氨酸、丝氨酸和苏氨酸的生物合成通路的富集最为显著,ABC 转运蛋白合成途径富集程度最高。综上所述,推测导致大麦叶斑病的不同麦根腐平脐蠕孢菌的致病力差异的原因与耐万古霉素类生物合成、ABC 转运蛋白合成、tRNA-氨酰生物合成、甘氨酸、丝氨酸和苏氨酸的生物合成、精氨酸和脯氨酸的代谢、赖氨酸降解途径有关,该试验结果为研究不同麦根腐平脐蠕孢菌的致病力差异奠定了基础。
