小麦抗壳针孢叶枯病基因发掘及育种应用进展
2021-12-16卢家玲樊宇恒马梦思田雪军
卢家玲,樊宇恒,马梦思,田雪军
(1.郑州大学农学院,河南郑州 450001;2.荆楚理工学院生物工程学院,湖北荆门 448000)
小麦(Triticum aestivum L.)是世界上主要的粮食作物之一,也是我国第二大口粮作物,小麦生产对保障国家粮食安全、居民生活和国民经济发展起着重要作用[1]。小麦生长发育过程中会受到各种生物和非生物胁迫,其中由真菌引起的小麦叶枯病在世界范围内分布广泛,严重影响小麦的产量和品质[2-3]。小麦叶枯病通常是指由真菌侵染引起的小麦叶斑或叶枯性病害的一类总称,该病主要为害小麦叶片和叶鞘,有时也为害茎秆及穗部[4]。目前,在全球范围内已鉴定到20 多种小麦叶枯病病原菌,其中对小麦产量和品质危害最严重的叶枯病包括:小麦壳针孢叶枯病(Septoria tritici blotch,STB)、小麦褐斑病(Tan spot)、小麦颖枯壳针孢叶枯病(Septoria nodorum blotch)和小麦蠕孢叶枯病(Spot blotch)(图1)[3,5]。小麦叶枯病的防治主要包括化学防治、生物防治和抗病育种,其中抗病品种的选育和推广是最经济有效且环保的防治措施[3,6-7]。因此,筛选小麦叶枯病抗性种质资源,克隆抗叶枯病基因并发掘优异等位变异,开发功能分子标记,利用分子标记辅助选择技术聚合多个抗病基因,将最终实现小麦品种抗病性的广谱性和持久性。
本文主要综述了小麦壳针孢叶枯病的危害,抗叶枯病基因/QTL 定位、功能标记开发和抗叶枯病分子机理研究,并对今后小麦叶枯病抗性研究重点及育种思路进行了讨论,以期为更有效地开展叶枯病遗传研究和抗病分子育种提供理论参考。

1 小麦壳针孢叶枯病的危害
小麦壳针孢叶枯病(Septoria tritici blotch,STB)是由真菌(子囊菌)Mycosphaerella graminicola(无性态为Zymoseptoria tritici,异名Septoria tritici)引起的一种小麦叶部病害,严重发生时小麦叶片黄枯,不能正常灌浆结实,千粒质量下降[8]。小麦壳针孢叶枯病在全球范围内均有发生,尤其在欧洲、地中海、南美洲、美国、澳大利亚和中国等地区发病较多,引起大面积叶枯和穗腐[5,9-11]。在欧洲,小麦壳针孢叶枯病对小麦造成的经济损失与水稻稻瘟病对水稻造成的损失相当,每年控制该病害使用的杀菌剂费用高达4 亿美元[12]。此外,随着品种更替和近些年的气候环境变化,发病区域也随之有明显变动。在我国,小麦壳针孢叶枯病在不同生态小麦种植区均有发生,主要危害区域包括西北局部冷凉阴湿春麦区和东北晚熟春麦区[13]。
小麦壳针孢叶枯病贯穿小麦的整个生育期,为全生育期病害,不仅危害叶片、叶鞘,还危害茎和穗[4,14]。小麦壳针孢属于半活体营养型真菌,侵染过程分活体营养和死体营养2 个阶段。小麦壳针孢的孢子在侵入寄主前不形成附着孢,直接从气孔入侵,侵染后经历1~4 周的潜伏期,此期间病原菌不穿透细胞壁进入叶肉细胞间,也不形成吸器从细胞内汲取营养,而只是在叶肉组织细胞间不断生长直至细胞坏死[8]。病菌侵染后发病症状由下部叶片向上扩展,初期在叶片上形成不规则黄褐色斑块,后期扩展连片形成褐色大斑;有些叶片呈现黄色条纹状病斑,叶脉黄绿色,严重时黄色部分变为枯白色,表面生有黑色小颗粒,即分生孢子器;发病严重时,病菌自叶鞘向茎秆扩展直至穗部颖壳,使之变得干枯,籽粒干瘪[14]。
2 小麦壳针孢叶枯病质量抗性基因定位分析
目前,正式命名的小麦抗壳针孢叶枯病的质量抗性基因有22 个,包括Stb1-Stb19、StbSm3、StbWW和TmStb1,在小麦的7 个同源群上均有分布[15-16]。Stb3、Stb4、Stb5 和TmStb1 位于第7 同源群,在第1 和第3 同源群各分布有3 个基因,其中位于1B染色体短臂上的基因有3 个,分别为Stb2、Stb11 和StbWW[15-16]。根据小麦对壳针孢叶枯病的抗病表现时期,可将抗病基因分为全生育期抗性、苗期抗性和成株期抗性。其中,苗期抗性基因占1/2 以上,全生育期抗性基因有6 个,成株期抗性基因仅有4 个(表1)。这些抗病基因不仅来源于普通小麦,也有一些来自一粒小麦、硬粒小麦、人工合成六倍体小麦及小麦易位系材料。
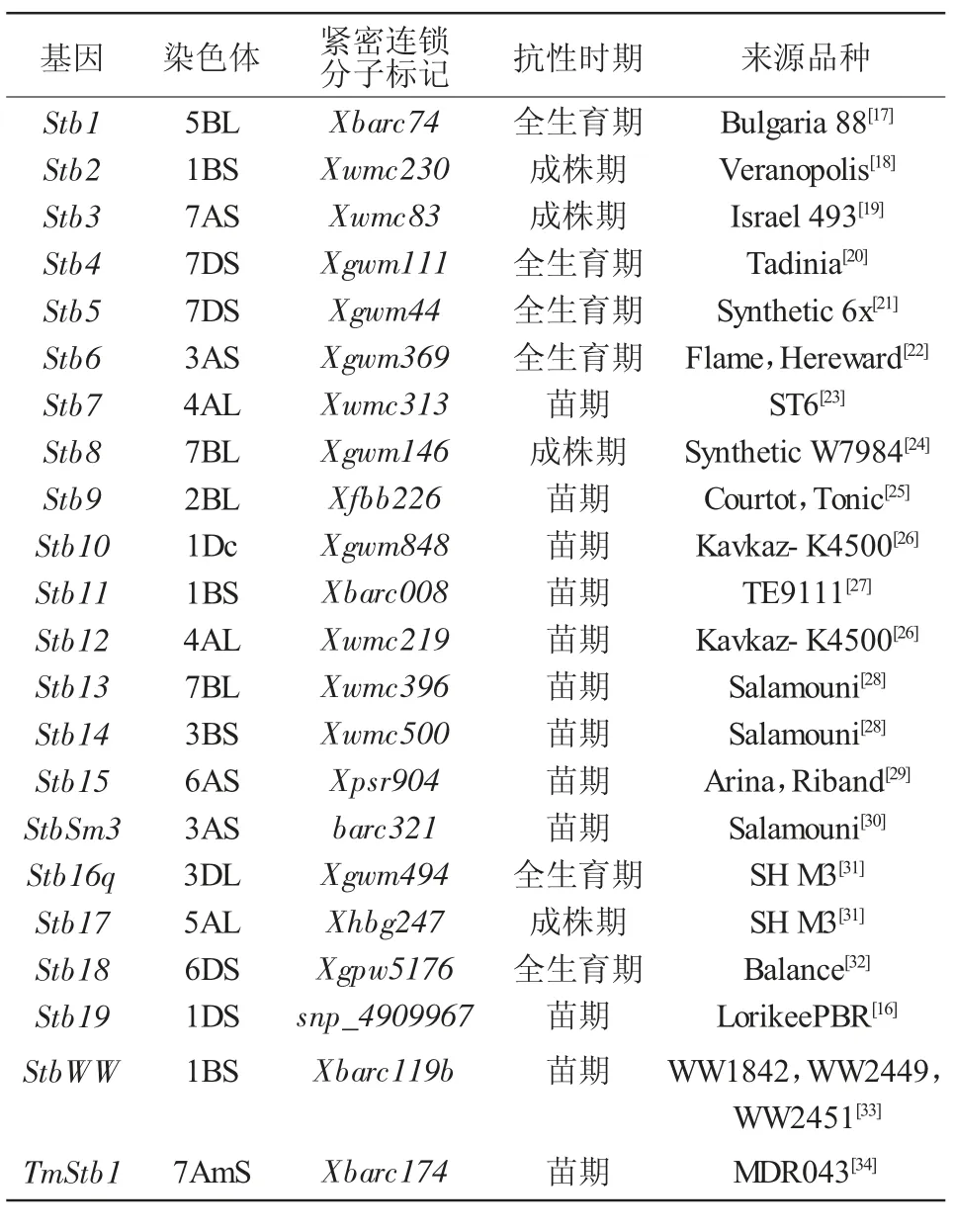
表1 正式命名的小麦抗壳针孢叶枯病基因
3 小麦壳针孢叶枯病抗性数量性状位点定位分析
3.1 基于双亲群体的小麦抗壳针孢叶枯病数量性状位点定位分析
在田间试验中,小麦对壳针孢叶枯病的抗性水平呈连续型分布,可能由几个或多个基因控制,表现加性效应或显性效应,在普通小麦和硬粒小麦中具有较高的遗传力[35-37]。在苗期和成株期鉴定到的小麦抗壳针孢叶枯病数量性状位点(Quantitative Trait Locus,QTL)遍布于小麦的各条染色体上。目前,已从19 个双亲遗传群体中鉴定到177 个小麦抗壳针孢叶枯病QTL 位点[15],GOUDEMAND 等[38]对7 个小麦双单倍体(Double Haploid,DH)群体的壳针孢叶枯病抗性进行一致性QTL(meta quantitative loci,meta-QTL)分析,最终将定位到的115 个QTL,整合为27 个meta-QTL。简言之,目前已报道的89 个抗小麦壳针孢叶枯病区间包含62 个QTL 和27 个meta-QTL,其中,27 个为苗期抗性位点,48 个为成株期抗性位点,其余14 个位点在全生育期均表现抗性[15]。这些抗病QTL 包含参与控制叶片坏死、分生孢子器生长和病情发展曲线下面积(Area under disease-progress curve,AUDPC)的位点,另外,还鉴定到2 个控制小麦壳针孢叶枯病潜伏期的微效QTL[39]。
除5D 染色体外,小麦其他染色体上都至少携带1 个抗壳针孢叶枯病QTL 或meta-QTL[15]。19 个QTL 或meta-QTL 与控制株高、抽穗期的基因或QTL 共定位,其中,定位到的6 个QTL 位点与Rht8、Rht-B1、Rht-D1、Ppd-A1 和Ppd-D1 距离较近[15,38-39]。另外,发现在3BL、6BS 和7DL 染色体上富集大量抗叶枯病QTL,包括22 个QTL 和6 个meta-QTL,这可能与该区间内共定位到的一些质量抗性基因有关[15]。此外,通过不同群体定位到的多个QTL 在质量抗性基因Stb6、Stb5/Stb4 和Stb11/Stb2/StbWW 附近,而定位在Stb1、Stb9、Stb7 和Stb12、Stb13、Stb14 和Stb18 附近的QTL 较少[15,39-42]。除了8 个QTL 通过在人工合成六倍体小麦、中国春染色体代换系和一个美国小麦品系中鉴定到,其他QTL 绝大部分来自欧洲小麦种质[39-42]。
3.2 基于自然群体的小麦壳针孢叶枯病抗性的全基因组关联分析
通过全基因组关联分析(Genome-Wide Association Studies,GWAS),已在栽培小麦品种和地方品种中鉴定到与小麦壳针孢叶枯病抗性相关的基因位点,包括已报道的STB 抗性位点和一些新位点。前人对327 份欧洲小麦品种开展连续2 a 的喷雾接种调查研究,关联分析共检测到68 个SSR 标记与小麦壳针孢叶枯病成株期抗性显著相关,其中,9 个抗病位点与表型鉴定时的所有抗病指标都显著相关,关联分析还鉴定到Stb1、Stb4、Stb6 和Stb8,说明这些基因已在欧洲品种广泛应用[43]。此外,一些与STB 抗性相关的性状也定位在已知的小麦抗壳针孢叶枯病基因附近。
通过对1 055 份优异杂交种及其87 个亲本在2 个环境下自然发病或进行混合小种喷雾接种,关联分析鉴定到8 个单核苷酸多态性(Single nucletide polymorphism,SNP)标记与小麦壳针孢叶枯病抗性显著相关,主要分布在1B、2B、5B 和6A 染色体上[44]。其中,5B 上的抗病位点可能为Stb1,并且在Arina Forno 和Steele-ND×ND 735 群体中也能被检测到[42,45]。此外,对528 份来自全球的春小麦地方品种在温室进行成株期抗壳针孢叶枯病鉴定,关联分析定位到7 个抗病相关SNP,这些SNP 分布在3B、6B 和7B 染色体上,可能为新的抗壳针孢叶枯病基因[46]。近期,YATES 等[47]开发了自动图像分析算法,量化小麦壳针孢叶枯病的抗病表型,在田间对335 个冬小麦品种进行了高通量自动化表型分析,将540 多万个自动生成的表型性状与13 648 个SNP 标记进行全基因组关联分析,鉴定出26 个与小麦壳针孢叶枯病抗性相关的染色体区间,解释1.9%~10.6%的表型变异,其中16 个染色体区间与已知的STB 抗性区间相吻合。
4 小麦抗叶枯病基因的克隆和作用机理探究
小麦叶枯病抗性遗传分析,虽然定位到了很多质量抗性基因和QTL,但是被克隆的却很少。通过图位克隆策略,目前仅报道克隆了2 个与小麦壳针孢叶枯病相关的主效抗病基因,即Stb6 和Stb16q。
4.1 Stb6 基因
Stb6 是第1 个被克隆的小麦抗叶枯病基因,对小麦壳针孢菌株IPO323 表现特异性抗性。早在2002 年,研究者利用抗病品种Flame 和Hereward,分别与感病品种Longbow组配F1,证明该基因是一个半显性基因,通过后代F2和F3群体将该基因定位在3AS 染色体上[22]。直到2018 年,英国洛桑研究所和法国国家农业研究院联合研究,对Stb6 基因进行了精细定位,并通过候选基因表达分析、序列多态性分析、病毒诱导的基因沉默(Virus induced gene silencing,VIGS)技术、EMS 突变体分析和转基因验证,最终确定TaWAKL4 即为Stb6 基因[48]。TaWAKL4/Stb6 基因包含4 个外显子和3 个内含子,编码一个647 个氨基酸组成的抗性蛋白,其中胞外是半乳糖醛酸结合结构域(GUB_WAK),胞内是非精氨酸-天冬氨酸蛋白激酶以及一个复杂拓扑刀豆蛋白A 型结构域。简言之,Stb6 基因只对一部分小麦壳针孢菌有效,这些菌株会分泌一种特定蛋白质,该基因编码的蛋白质能识别它,启动小麦的天然防御体系。Stb6 基因的克隆为小麦叶枯病抗性基因的研究奠定了重要基础,同时也印证了先天免疫反应中的模式识别受体(Pattern recognition receptor,PRR)类蛋白也能控制质量抗性,符合“基因对基因假说”[48]。
4.2 Stb16q 基因
Stb16q 基因来自于人工合成六倍体小麦M3,在苗期和成株期都表现出稳定的广谱抗性,利用感病品种Kulm 和M3 衍生的RIL 群体,将Stb16q 基因定位在3DL 染色体上,QTL 分析结果表明,该位点可解释苗期抗性表型变异41%~71%,成株期抗性表型变异28%~31%[31]。近日,法国国家农业食品与环境研究所(INRAE)利用另外一个携带Stb16q基因的人工合成六倍体小麦TA4152-19,采用图位克隆策略克隆了Stb16q 基因[49],该基因编码一个富含半胱氨酸的类受体激酶(CRK),包含7 个外显子和6 个内含子,主要在小麦叶片中表达,并且随着发育阶段表达量增强。Stb16q 编码的蛋白包含2 个DUF26 结构域、一个跨膜结构域和一个细胞内丝氨酸/苏氨酸(Ser/Thr)蛋白激酶结构域。在烟草叶片中瞬时表达发现,Stb16q蛋白定位于质膜上。进一步研究发现,Stb16q可能在早期阶段阻止小麦叶枯病菌的侵染[49]。已有研究表明,含有DUF26 结构域的Gnk2 具有甘露糖结合活性[50],涉及该活性的所有氨基酸均在STB16 的C 端DUF26 结构域中高度保守,表明STB16 可能通过识别质外体植物或真菌衍生的甘露糖或衍生物,进而触发Stb16q 介导广谱防御反应,在病原体穿过气孔前阻止病程发展[49]。
5 小麦抗壳针孢叶枯病基因的育种应用
由于小麦叶枯病的遗传研究较为缓慢,目前抗病基因在育种中的应用还相对较少。在普通小麦中,抗叶枯病的种质资源较为匮乏。王振等[51]对东北春麦区主要推广的54 份小麦品种进行抗叶枯病评价,结果表明,仅1 个品种垦大6 号抗性较好。由我国江苏里下河农业科学院育成的扬麦6 号,在印度、尼泊尔和孟加拉等国表现稳定的叶枯病抗性[52]。BROWN 等[53]研究发现,中国春在田间对白叶枯病菌IPO323 表现特异性抗性。除此之外,大多数高抗叶枯病材料为簇毛麦、偃麦草、大赖草等小麦近缘种属[54]。来自国际玉米小麦改良中心(Centro Internacional de Mejoramientode Maizy Trigo,CIMMYT)的品种KK 和来自葡萄牙的TE 9111 对多个小麦叶枯病菌都表现持久抗性,多年来作为抗叶枯病种质资源在抗病育种中应用,有研究表明,这些品种可能含有多个针对不同菌株的抗性基因或含有一个广谱抗性基因[55]。通过聚合多个Stb 基因有望提高抗性水平,这也是在抗病育种中经常使用的策略。
第1 个克隆的小麦叶枯病基因Stb6 引起局部过敏性反应,阻碍病程的进一步发展。在98 份材料中可将Stb6 划分为8 种单倍型,其中仅有1 种抗病单倍型占71 份,而且该抗病单倍型在野生四倍体和二倍体小麦中也能鉴定到,表明Stb6 可能在小麦驯化早期已经渗入,有望在育种中得到更广泛的应用[22]。第2 个克隆的Stb16q 对已鉴定的所有叶枯病菌株均表现较强的抗病性,重要的是,利用Stb16q 基因的功能SNP 标记(cfn80044 和cfn80045)检测来自61 个国家的805 份小麦品种,发现核心种质资源不含该抗病等位基因,仅在来自法国、印度和西班牙的5 个品种和来自CIMMYT 的1 个高代品系中检测到Stb16q 的优异抗病等位基因[49]。因此,未来可以通过分子标记辅助选择回交育种,将Stb16q 基因引入到我国主栽小麦品种中,以实现小麦对叶枯病的广谱抗性。此外,对于数量性状QTL,可以通过回交等方法聚合多个QTL,增强单个微效基因的效应,从而使抗病性更为持久。
6 小麦抗壳针孢叶枯病研究思路探讨
小麦是我国主要粮食作物之一,小麦叶枯病近年来从原来的点片发生发展到较大地区范围,且危害逐年加重,在部分地区成为常年发生的重要病害。尽管化学药剂和生物防治能够在一定程度上控制小麦叶枯病,但会增加人力、物力投入,造成生态环境污染,而培育和推广抗病品种是最经济、有效和环保的防治措施。因此,筛选抗病种质资源,对小麦种质资源中的抗叶枯病基因进行发掘和育种应用,是实现我国小麦品种叶枯病抗性可持续性的基础。与其他小麦病害如锈病、白粉病相比,目前国内对小麦叶枯病抗性的遗传研究相对落后,相关基因克隆的研究还比较少,积累的抗病材料也相当缺乏。今后应加强几方面的工作。
6.1 加强小麦壳针孢叶枯病抗性种质资源的搜集、鉴定和利用
小麦抗叶枯病种质资源的搜集和鉴定是抗病育种的基础工作,前人已在栽培小麦品种、地方小麦品种、野生小麦和六倍体人工合成小麦中筛选到了高抗叶枯病的材料[56]。同时在普通小麦的祖先种(如一粒小麦、野生二粒小麦、硬粒小麦)和近缘种属(如簇毛麦、燕麦草、大赖草等)中也筛选到一些高抗叶枯病的材料[15]。此外,中间偃麦草与小麦远缘杂交创制的代换系、附加系等材料可以增强小麦的抗病性[57],例如,利用小麦-中间偃麦草部分双二倍体TAI7045 与普通小麦晋太170 进行亚远缘杂交选育的小偃麦新种质CH366 对3 个条锈菌流行小种均表现高抗[58]。因此,如何将这些抗性种质材料应用到小麦育种工作中是今后应该注意和加强的方面。此外,对审定推广品种的叶枯病抗性全面鉴定工作也需要加强,因为一旦鉴定出叶枯病抗性较好的品种,可以直接作为育种亲本材料用于小麦叶枯病抗性改良。
6.2 加强小麦抗壳针孢叶枯病基因的克隆和优异等位基因发掘
目前,已经鉴定到22 个主效Stb 抗性基因,同时通过双亲群体和自然群体定位到许多与小麦叶枯病相关的QTL,但是目前为止仅分离克隆了2 个主要基因Stb6 和Stb16q。因此,在加强种质资源叶枯病抗性评价的基础上,也应当积极开展叶枯病抗性基因的发掘与克隆。目前,小麦基因组学研究已取得重大进展,基因编辑技术在小麦研究中也得到成功运用,这些新的研究成果和技术手段将为小麦叶枯病抗性基因的克隆和优异等位基因的发掘提供便利条件。而小麦抗叶枯病基因的克隆,也为了解小麦抗叶枯病基因遗传变异机制、解析其抗性遗传机理,为小麦抗叶枯病分子设计育种、转基因育种和精准基因编辑育种提供目标基因和靶点,为小麦种质资源的收集、保护、研究和利用提供重要理论依据。
6.3 加强分子标记辅助选择及抗病分子设计育种工作
小麦叶枯病抗性是一个由多基因控制的复杂数量性状,单纯的表型筛选易受环境条件影响,选择效率较低。加强育种材料,选择抗性过硬的新品种,是小麦育种方向创新实践优化的主要策略[59]。小麦叶枯病抗性基因/QTL 的发掘和相关功能标记/连锁标记的开发,对开展叶枯病抗性分子标记辅助育种和提高育种效率奠定了基础。为了快速提高小麦品种对叶枯病的抗性,同时又保持改良后较好的农艺性状和适应性,挑选适应性较好、产量较高、综合农艺性状良好的主推品种作为育种改良的轮回亲本品种,扩大回交育种群体,回交育种结合分子标记辅助选择是抗叶枯病育种最有效的方法之一。但是国内利用分子标记辅助选择育成抗叶枯病并大面积推广的品种鲜有报道,聚合不同抗叶枯病基因的分子聚合育种的实例更少。因此,今后应加强分子标记辅助及标记聚合分子育种工作。
