低温胁迫下6 种马铃薯组培苗耐寒性评价
2021-12-16王明霞宋倩娜王慧杰吴双艳冯瑞云
王明霞,梅 超,宋倩娜,王慧杰,吴双艳,冯瑞云
(1.山西大学生命科学学院,山西太原 030006;2.山西农业大学农学院,山西太原 030031)
马铃薯(Solanaceae tuberosum L.)是茄科茄属,1 年生双子叶植物,在山西乃至全国范围内大面积栽种,是一种良好的经济作物[1]。马铃薯是山西省部分地区主要脱贫产业,是保障山西省粮食安全及精准扶贫的重要产业。因此,选育优良马铃薯品种对我国农业发展具有重要作用[2]。温度是影响作物生长发育及产量和品质的重要环境因素,低温胁迫是严重影响作物生长的非生物胁迫之一,因此,如何提高作物耐低温胁迫能力是目前研究热点之一[3]。马铃薯喜冷凉环境,不耐霜冻,0 ℃以下的低温冻害和0 ℃以上的低温冷害都会使马铃薯植物生长受到一定抑制。长期低温会对苗期马铃薯植株发育造成损害,严重时会造成马铃薯结薯量下降甚至绝收[4]。马铃薯叶片在-4 ℃低温下至少还可以存活5 d,具有一定的抗寒性[5]。马铃薯种间差异大,抗低温胁迫能力具有一定差异。因此,选育抗寒能力较强的优良马铃薯品种对减少冻害风险及促进马铃薯产业提质、增收十分必要。
细胞作为植物体最基本的单位,低温胁迫发生时,首先发生冷害的部位是细胞膜系统,植物细胞的细胞膜和细胞器膜先后遭到破坏,进而造成植株损害和死亡[6]。低温胁迫会引起植物膜系统、细胞渗透压、正常生理代谢和保护酶系统等发生一系列改变。研究表明,一些植物长期在低温逆境中形成抗寒能力,如通过改变植物体内的渗透调节物质、酶活性等方式抵御低温胁迫[7]。脯氨酸是一种亲水性溶剂,低温条件下植物体内脯氨酸积累量越多,植物耐寒性越强,可缓解细胞因低温胁迫植物脱水造成的渗透胁迫[4,8]。李飞等[9]研究表明,马铃薯抗寒性与脯氨酸含量具有一定相关性,低温驯化马铃薯品系耐寒性强的品种脯氨酸含量高于耐寒性较弱的马铃薯品系。许娟等[10]研究发现,不同品种马铃薯受到低温胁迫后,SOD、POD、CAT 等生理指标呈上升趋势,但当低温胁迫时间延长以后,各个生理指标升降趋势不一致。杨惠菊等[11]通过马铃薯苗期耐寒指标相关性分析得出,可溶性糖与过氧化物酶活性呈显著相关性。
为了进一步综合分析不同品种马铃薯耐寒性强弱,本研究以并薯6 号、克新1 号、费乌瑞它、晋薯16 号、冀张薯12 号和大西洋等脱毒组培苗为对象进行低温胁迫处理,通过测定不同品种马铃薯组培苗中过氧化氢酶、过氧化物酶活性及可溶性糖、脯氨酸含量等生理生化指标,并采用隶属函数法对其抗寒性进行综合评价[12-15],以期为抗寒性马铃薯品种的选育提供理论依据。
1 材料和方法
1.1 供试材料
供试材料并薯6 号脱毒组培苗(山西农业大学农学院与太原市惠禾经贸有限公司选育)、克新1 号脱毒组培苗(黑龙江省农业科学院马铃薯研究所选育)、费乌瑞它脱毒组培苗(国外引进示范品种,低温敏感)、晋薯16 号脱毒组培苗(山西农业大学农学院高寒区作物研究实验室选育)、冀张薯12 号脱毒组培苗(河北省高寒研究所选育)、大西洋脱毒组培苗(国外引进示范品种)等6 个马铃薯品种,均由山西农业大学农学院马铃薯基因编辑实验室提供。
1.2 试验方法
参照黄先群等[16]的研究方法对材料进行处理,并略作改动。将供试材料组培苗在MS 培养基上培养28 d 后,选取生长状态良好,长势一致的脱毒组培苗用于试验。对6 个不同品种马铃薯进行低温胁迫处理,试验在低温光照培养箱中进行,采用4 ℃和-4 ℃共2 个温度处理48 h,光照强度为2 500 lx左右,光照时间为12 h/d,每个处理重复3 次。-4 ℃处理组的马铃薯试验材料,低温处理之前进行为期5 d 的低温驯化,驯化温度为4 ℃。将常温25 ℃作为对照处理,光照强度为2 500 lx 左右,光照时间12 h/d,设置3 次重复。
1.3 测定指标及方法
低温胁迫处理后,取整株马铃薯组培苗用液氮研磨混匀后放入1.5 mL 离心管中,存放于-80 ℃超低温冰箱中储藏备用。POD、CAT 活性以及Pro、可溶性糖含量均采用生工Sangon Biotech 试剂盒测定。
1.4 采用隶属函数法综合分析马铃薯耐寒性
与抗寒性呈正相关的指标参数如下。
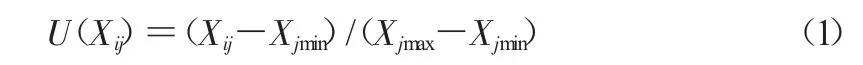
与抗寒性呈负相关的指标参数如下。
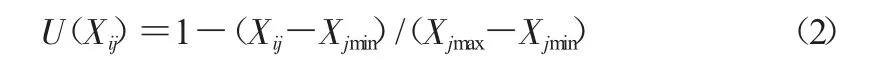
式中,U(Xij)表示各指标的隶属度值,该数值的范围在0~1,Xij中字母i 指的是不同品种的马铃薯,j 代表不同测定指标。将每个品种马铃薯的所有指标累加,求其平均数,平均数越大耐寒性越强。
1.5 数据处理
采用Excel 2019 进行数据统计和处理,采用GraphPad Prism 制作柱状图,采用SPSS 19.0 进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 低温胁迫对马铃薯生理指标的影响
2.1.1 对游离脯氨酸(Pro)含量的影响 表1 和图1 结果表明,低温胁迫后,各品种马铃薯的脯氨酸含量整体上呈现先上升后下降的趋势,与对照组相比,均呈现增加。4 ℃时各品种马铃薯的脯氨酸含量存在显著性差异,表现为并薯6 号的脯氨酸含量最大,其次依次是冀张薯12 号和晋薯16 号;-4 ℃时各品种马铃薯脯氨酸含量表现为冀张薯12 号>晋薯16 号>克新1 号>并薯6 号>大西洋>费乌瑞它,与4 ℃相比,并薯6 号和费乌瑞它的降幅较大,且二者之间存在显著性差异(P<0.05),并薯6 号的脯氨酸含量较大,冀张薯12 号和晋薯16 号的脯氨酸含量之间差异不显著,但是显著高于其他4 个品种(P<0.05)。并薯6 号在4 ℃时脯氨酸含量最高,其次依次是冀张薯12 号和晋薯16 号,具有较高的抗胁迫能力,冀张薯12 号和晋薯16 号在-4 ℃时脯氨酸依然保持较高水平,且二者之间不存在显著性差异,但是显著高于其他马铃薯品种(P<0.05),表明其耐低温能力更强。克新1 号在低温胁迫后脯氨酸含量也保持较高水平,从而抵抗低温胁迫,大西洋在低温胁迫后脯氨酸含量增加趋势相对较稳定但脯氨酸含量处于较低水平,不利于其抵抗低温胁迫,费乌瑞它-4 ℃时的脯氨酸含量较4 ℃时脯氨酸含量降幅较大且脯氨酸含量处于较低水平,抗低温胁迫能力较差。

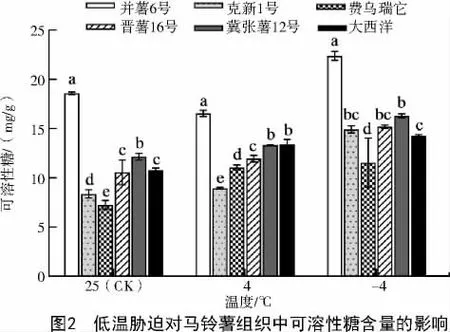
2.1.2 对可溶性糖含量的影响 可溶性糖是一种重要的渗透调节物质。由表1 和图2 可知,处理前并薯6 号的可溶性糖含量最高,其次依次是冀张薯12 号和大西洋,费乌瑞它和克新1 号的可溶性糖含量相对较少。4 ℃处理后,不同品种马铃薯可溶性糖含量整体呈现增加的趋势,说明了低温胁迫下,6 种不同品种马铃薯在4 ℃条件下通过可溶性糖的合成与积累来抵抗低温;此时,并薯6 号的可溶性糖含量最高,但是相较于对照组有少量的下降,其原因可能是由于此温度未能达到对该品种马铃薯胁迫的水平,还未启动应对低温胁迫的生理机制;其余品种中的可溶性糖含量较对照组均有不同程度的增加,其中,大西洋和费乌瑞它的可溶性糖含量增幅较大,但费乌瑞它的可溶性糖含量仍较低。-4 ℃时,6 个不同品种马铃薯的可溶性糖含量继续增加,说明在-4 ℃时各个品种的马铃薯仍能通过合成更高浓度的可溶性糖来抵抗低温;此时,6 个不同品种马铃薯的可溶性糖含量大小表现为并薯6 号>冀张薯12 号>晋薯16 号>克新1 号>大西洋>费乌瑞它,并薯6 号和克新1 号较4 ℃时的可溶性糖含量增幅较大,其次是冀张薯12 号和晋薯16 号,大西洋和费乌瑞它的增幅不明显。并薯6 号在未处理时与低温处理后可溶性糖含量均处于最高水平,具有一定的抗胁迫能力,冀张薯12 号与晋薯16 号在4、-4 ℃时可溶性糖含量表现出持续升高且维持在较高水平,具有较高的抗低温胁迫能力,其次是大西洋和克新1 号,-4 ℃时费乌瑞它的可溶性糖含量最低,表明其抵抗低温胁迫的能力较低。
2.1.3 对CAT 活性的影响 CAT 具有清除植物体内过氧化氢的能力,是植物耐寒性鉴定的一个重要指标。从图3 和表2 可以看出,处理前冀张薯12 号的CAT 活性最高,其次是大西洋,费乌瑞它的CAT活性最低。4 ℃处理后,6 种马铃薯的CAT 活性均呈现增加趋势,此时晋薯16 号的CAT 活性最高,并薯6 号与晋薯16 号不存在显著性差异,费乌瑞它的CAT 活性仍为最低。-4 ℃处理后,除并薯6 号CAT 活性较4 ℃有小幅度降低外,其余品种马铃薯组织CAT活性均呈现持续升高的趋势,冀张薯12 号CAT 活性最高,其次是晋薯16 号,显著高于其余4 个品种(P<0.05),大西洋与克新1 号CAT 活性存在显著性差异,且大西洋CAT 活性显著高于克新1 号(P<0.05)。低温胁迫可增强6 个不同品种马铃薯组织CAT酶活性,冀张薯12 号与晋薯16 号在4、-4 ℃均具有较高的CAT 酶活性,不同品种马铃薯的CAT 酶活性对低温胁迫响应的方式存在差异。


表2 不同温度下6 种马铃薯组织中保护酶活性变化
2.1.4 对过氧化物酶(POD)活性的影响 从图4可以看出,POD 可以清除植物体内过氧化物,可作为植物抗氧化能力的一个重要指标。未处理之前,晋薯16 号的POD 活性最高,冀张薯12 号与晋薯16 号之间不存在显著性差异,其次是大西洋,并薯6 号和克新1 号的POD 酶活性较低,费乌瑞它的POD 酶活性最低。4 ℃处理后,克新1 号与并薯6 号的酶活性明显增加,晋薯16 号和费乌瑞它的POD酶活性出现小幅增加,冀张薯12 号和大西洋POD酶活性出现小幅降低。-4 ℃处理后,冀张薯12 号、大西洋、晋薯16 号的POD 活性较对照处理明显增强并达到峰值,表明低温诱导可显著增强POD 活性,增强上述3 个品种马铃薯耐低温胁迫能力,并薯6 号和费乌瑞它的POD 酶活性与对照组相比出现了下降,难以更有效地清除组织内过氧化物来适应低温环境。低温可使供试的6 个不同品种的马铃薯POD 酶活性出现增强,但是,不同品种马铃薯的POD 活性对低温胁迫响应的方式不同。

2.2 马铃薯抗寒品种综合评价
植物抗寒性是一个比较复杂的过程,用某个单一指标评价植物的耐寒性十分局限,采用多个指标综合评价更能相对准确全面地反映植物的耐寒性[17]。参照王丽等[18]的研究方法,采用隶属函数法对低温胁迫下各品种马铃薯各项生理指标进行综合分析,评价6 种马铃薯的抗寒性,可相对准确地反映植物抗寒的整体表现。
本研究采用隶属函数的方法,对Pro 含量、可溶性糖含量、CAT 活性、POD 活性4 个冷胁迫响应相关指标进行了综合分析,结果显示(表3),6 个不同品种马铃薯耐寒性依次为冀张薯12 号>并薯6号>晋薯16 号>克新1 号>大西洋>费乌瑞它。
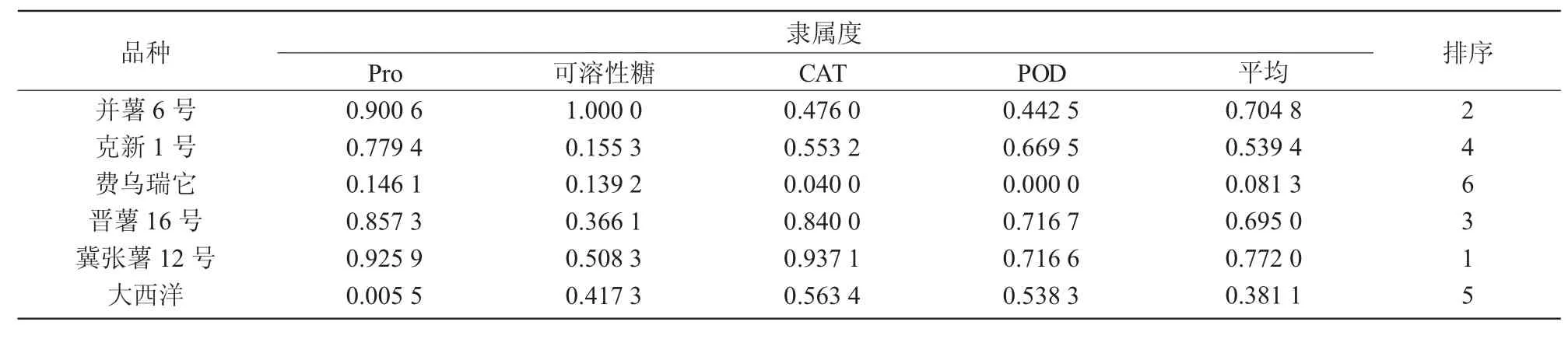
表3 不同品种马铃薯耐寒性综合评价
3 结论与讨论
植物细胞中的渗透调节物质在植物抵御冷胁迫中起着十分重要的作用,本研究选取了游离脯氨酸和可溶性糖2 个渗透调节物质作为6 个不同品种马铃薯脱毒组培苗抗寒性的指标。低温胁迫时,植物可通过合成并积累更多的渗透调节物质降低水势,减少水分的散失从而提高耐寒能力。本研究结果显示,低温处理条件下,6 种马铃薯的脯氨酸和可溶性糖含量均有所增加,体现了对低温胁迫的抗性[10]。不同品种马铃薯对低温胁迫的响应有所不同,即脯氨酸和可溶性糖积累量的峰值出现时间不一致。低温胁迫后,马铃薯幼苗组织游离脯氨酸的升降趋势与白淼等[19]研究结果一致。马英等[20]研究认为,低温胁迫发生时,细胞渗透物积累量多的植物耐寒性相对较强,反之耐低温能力较弱。本研究中,并薯6 号、冀张薯12 号、晋薯16 号在低温胁迫条件下脯氨酸和可溶性糖含量均处于较高水平,表明这3 个马铃薯品种耐寒性相对较强。
CAT 和POD 这2 种抗氧化酶在植物体内十分关键,可以对其体内活性氧自由基进行有效的去除,以此来提高植物抵抗非生物胁迫即低温胁迫[19]。本研究表明,低温胁迫条件下,马铃薯的酶促防御系统启动并活化,CAT 活性和POD 活性较对照组均出现不同程度的增加,4 ℃低温胁迫时,耐寒品种冀张薯12 号、并薯6 号、和晋薯16 号的CAT 活性显著高于不耐寒品种,这与秦文斌等[21]研究结果一致。-4 ℃低温处理后,冀张薯12 号的2 种酶活性仍然保持最高水平,晋薯16 号的2 种酶活性也比较高,表现出较强的耐寒性。本研究结果显示,低温胁迫后,6 个马铃薯品种POD 活性整体上呈现先上升再下降或持续上升趋势,未呈现一定的正相关或负相关,这与丁红映等[22]研究结果一致。
植物耐低温胁迫能力是多基因调控的复杂调控机制,仅靠酶活性、渗透调节物质等某个单一指标不能全面地评价6 种马铃薯抗寒性[20]。隶属函数分析法是一种常用的植物抗逆性综合评价方法,此法运用模糊数学原理对植物抗逆性进行综合评价,目前已成功应用于马铃薯、高原乔木、葡萄等多种植物的抗逆性综合评价[18-19]。本研究采用隶属函数法对6 个不同品种马铃薯脱毒组培苗的4 种抗寒相关指标进行耐寒性综合分析,得到耐寒性量化结果,6 个参试马铃薯耐寒性强弱排序依次为冀张薯12 号>并薯6 号>晋薯16 号>克新1 号>大西洋>费乌瑞它。
