基于转录组测序的小麦旗叶表皮蜡质差异表达基因分析
2021-12-16温宏伟党一飞董凡凡张明义武棒棒逯腊虎
温宏伟,党一飞,董凡凡,陈 楠,张明义,武棒棒,逯腊虎,杨 斌
(1.山西农业大学小麦研究所,山西临汾 041000;2.临汾市农业技术推广站,山西临汾 041000)
小麦作为我国主要的粮食作物之一,保障其产量稳定和提高其抗逆性具有重要意义。表皮蜡质是植物与外界环境接触的第1 道物理屏障,不仅可以限制植物的非气孔水分散失、提高植物抗旱能力,而且还能帮助植物减轻机械损伤、病虫害入侵,保护植物免受高温和强紫外线辐射的危害[1-2],在抵御生物胁迫与非生物胁迫方面发挥着重要的作用[3-5]。因此,研究小麦叶片表皮蜡质调控基因及机制,对于逆境条件下保障小麦产量形成具有重要意义[6]。
蜡质的合成及调控机理研究虽始于20 世纪中叶,但小麦表皮蜡质由于其组分与合成过程的复杂性,大多数还停留在蜡质成分和结构的研究上[7]。目前,蜡质分子调控方面的研究多以模式作物拟南芥为研究对象,在拟南芥和水稻中发现了许多参与蜡质合成和调控的基因[8-9],如拟南芥中CER1 的过表达导致烷烃大量积累[10],CER4(AtFAR3)的过表达诱导伯醇的产生[11]。ZHOU 等[12]研究发现,水稻中OsWR2 通过上调穗部超长链脂肪酸合成基因CER6/CUT1、FDH2、FAE 和LACS1 的表达水平,调节蜡质的合成与积累。而有关小麦表皮蜡质分子调控机制的研究较少,CHAI 等[13]从小麦中克隆出了参与伯醇合成的几个编码脂肪酰基辅酶A 还原酶的基因TaFARs,刘晓宇等[14]对TaFAR10 进行了克隆和功能验证,LI 等[15]通过研究小麦蜡质缺失突变体w5 发现,β-二酮的生物合成阻断,进而抑制蜡质合成。由于小麦基因组复杂,同源序列多,且小麦表皮蜡质生物合成过程复杂,使得蜡质相关基因调控机制的研究受到很大限制。现虽有相关学者对小麦表皮蜡质分子调控机制进行了部分研究,但仍有许多调控机制未能明确,且现有研究多以不同遗传背景下的蜡质材料为研究对象,无法排除遗传差异造成的影响。
本试验以蜡质含量差异较大的济麦22 无蜡突变体和多蜡突变体为研究材料,通过高通量测序技术对2 种突变体的转录组进行生物信息学分析,以挖掘表皮蜡质差异表达基因,揭示小麦表皮蜡质合成及分子调控的可能机制,为深入研究小麦表皮蜡质代谢的遗传与分子机制提供有价值的参考信息。
1 材料和方法
1.1 试验材料
使用0.6%的EMS 溶液诱变济麦22[16],从高代诱变材料中筛选出无蜡突变体(NW)和多蜡突变体(MW)。2020 年10 月,种植于山西农业大学小麦研究所韩村试验基地(36°N,111°E),每个材料3 次重复,双行区种植,行距0.3 m,行长2 m,每行30 粒播种,常规管理。于抽穗期分别取NW 和MW 旗叶,锡箔纸包裹液氮速冻后于-80 ℃冰箱中保存。
1.2 总RNA 提取和转录组测序
NW 和MW 旗叶分别来自各3 个重复中的混样,各自分成2 份用于RNA 提取和转录组测序。采用Trizol 法提取总RNA,使用NanoDrop2000(美国)测定RNA 浓度和纯度,使用安捷伦生物分析仪2100 系统(美国)的RNA Nano 6000 分析试剂盒评估RNA 完整性,提取纯度和完整性符合要求的RNA 样本。将提取样本送往北京百迈客公司进行转录组测序。
1.3 mRNA 差异表达分析
通过去除含有接头的reads 和低质量的reads,对Illumina 测序平台上完成测序的转录组数据进行质量控制,以获得高质量的reads。利用HISAT2软件对小麦参考基因组进行序列比对,采用StringTie 对HISAT2 的比对结果进行拼接,通过ASprofile 软件获取每个样品存在的可变剪接类型及相应表达量(FPKM值)。利用DESeq2 进行样品组间的差异表达分析,以Fold change≥2 且假发现率(False Discovery Rate,FDR 即P-value)<0.01 作为筛选标准来确定无蜡突变体和多蜡突变体之间的差异表达基因(Differentially Expressed Genes,DEGs),并在百迈客云平台(www.biocloud.net)以某一个基因在2 个样品中表达量差异倍数的对数值为横坐标、以基因表达量变化的统计学显著性的负对数值为纵坐标绘制DEGs 火山图。
1.4 生物信息学分析
利用KEGG 数据库对差异表达基因进行蜡质功能注释和通路显著性富集分析,借助百迈客云平台(www.biocloud.net)对蜡质通路中的相关调控基因进行筛选和查询。
2 结果与分析
2.1 2 个突变体转录组测序质量分析
根据转录组分析结果,共获得40.63 Gb 的Clean Data,各样品的Clean Data 均达到9.63 Gb,Q30 碱基百分比在94.22%以上。分别将各样品的Clean reads 与指定的小麦参考基因组进行序列比对,比对效率为91.79%~93.67%(表1)。结果表明,RNASeq 得到的数据利用率高,所选择的参考基因组能够满足本试验后续分析的需求。

表1 样品测序数据质量控制统计
2.2 差异基因表达分析

差异基因表达火山图(图1)直观地显示了无蜡突变体和多蜡突变体中差异表达基因,图中的每一个点表示一个基因。结果显示,从2 种突变体叶片中共鉴定出6 840 个差异表达基因,与多蜡突变体相比,无蜡突变体中3 181 个差异基因表达上调,3 659 个差异基因表达下调。
2.3 蜡质差异基因功能分析
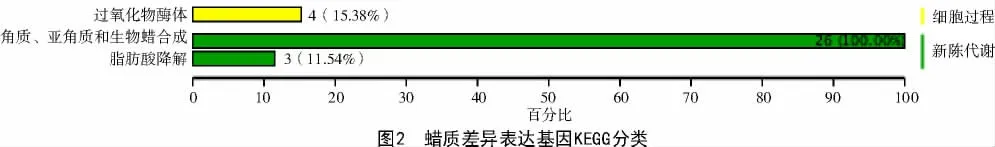
将2 种突变体共筛选到6 840 个的差异表达基因,通过KEGG 数据库对蜡质差异表达基因进行富集通路分析和分类,结果发现,蜡质相关基因注释到新陈代谢和细胞过程2 类,涉及脂肪酸降解、过氧化物酶体生理活动及角质、亚角质和生物蜡的合成过程,其中,26 个基因与角质、亚角质和生物蜡合成有关(图2)。进一步对差异表达基因的表达量进行分析,结果如表2 所示,发现其中上调基因9 个,下调基因17 个。
2.4 蜡质合成通路调控基因分析
为了分析筛选到的差异基因对蜡质合成的调控情况,通过KEGG 蜡质注释通路图发现,调控蜡质合成的基因主要包括醛脱碳酶基因(CER1)、中链烷烃羟化酶基因(MAH1)、醇合成过程中的脂肪酰基辅酶A 还原酶基因(FAR)和O-酰基转移酶家族蛋白基因(WSD1)(图3、表2)。与多蜡突变体相比,在无蜡突变体叶片中,2 个CER1 相关基因表达均下调,以抑制醛到烷烃的合成进而减少叶片蜡质;而2 个MAH1、7 个FAR 和4 个WSD1 相关基因表达水平既有上调也有下调,通过调控,烷烃向仲醇的转化、仲醇向酮的转化、长链酰基辅酶A 向伯醇的转化以及长链酰基辅酶A 和长链伯醇向蜡酯的转化过程来调控叶片表皮蜡质的合成。说明CER1 是影响2 种突变体蜡质差异的主要调控基因,通过抑制烷烃的形成减少叶片表皮蜡质含量。

表2 无蜡突变体与多蜡突变体叶片蜡质调控相关基因

3 结论与讨论
本研究通过对济麦22 无蜡突变体与多蜡突变体叶片表皮蜡质的高质量转录组数据进行差异显著性分析,得到6 840 个差异表达基因,主要富集在代谢过程中,这可能与蜡质相关物质的转化代谢有关。因为蜡质的合成需要多种酶参与并在不同器官进行的复杂过程,也说明了检测到的差异表达基因的准确性。除了蜡质的合成途径外,还涉及到脂肪酸降解过程。前人研究表明,蜡质的生物合成主要包含2 个步骤:C16、C18 脂肪酸前体的形成和超长链脂肪酸(very long chain fatty acids,VLCFAs)及其衍生物的合成[17]。脂肪酸的降解过程中,差异基因的表达可能与其转化为蜡质组分中的脂肪衍生物的过程有关,因此也说明了本研究差异表达基因涉及到的脂肪酸降解途径具有一定的合理性。
本研究检测到26 个与小麦叶片表皮蜡质相关的差异表达基因,通过KEGG 注释通路图发现,这些基因主要包括CER1、MAH1、FAR 和WSD1。与多蜡突变体相比,在无蜡突变体叶片中,CER1 相关基因全部下调表达,通过抑制长链醛向长链烷烃的转化,进而导致叶片蜡质减少。BERNARD 等[5]在拟南芥中研究也证实,CER1 基因主要通过抑制烷烃的生物合成来控制蜡质的合成。目前发现的表皮蜡质主要包括伯醇和仲醇、醛、烷烃、酮、酯、三萜类、甾醇和类黄酮[18-19],因此,推测在本研究中影响2 种突变体叶片蜡质表现差异的主要成分可能为烷烃。本研究发现,无蜡突变体叶片中MAH1 相关基因可以调控烷烃向仲醇的转化以及仲醇向酮的转化过程,杨昊虹[20]已对MAH1 相关基因进行克隆与功能验证,本研究与其研究结果类似。另外,本研究中无蜡突变体叶片中MAH1 相关基因既有表达上调也有表达下调,推测2 种突变体叶片表皮蜡质差异表达可能与烷烃、仲醇及酮的组分构成比例有关。本研究中,FAR 相关基因通过上调和下调来影响长链酰基辅酶A 向伯醇的转化过程,李玲红等[21]对小麦蜡质缺失突变体研究发现FAR 基因在突变体中大部分表达下调,少部分表达上调,这与本研究结果一致。WSD1 相关基因通过调控长链酰基辅酶A 和长链伯醇向蜡酯的转化,促进茎、叶的蜡酯积累[22]。本研究发现,在无蜡突变体叶片中WSD1 上调基因数量多于下调基因数量,这可能是由于更多的伯醇转化为蜡酯,而减少了伯醇的含量,这与前人研究发现小麦叶片中主要蜡质成分为醇、伯醇以及二酮的研究结果类似[23-24]。为了更好地研究小麦表皮蜡质的调控机理,以保障逆境条件下小麦产量的稳定[25],可以借助化学诱变技术[26],以不同遗传背景下的蜡质突变体(多蜡或少蜡)为研究材料,进一步验证相关蜡质分子调控机制,并对筛选到的蜡质调控基因进一步克隆和功能验证。
本研究通过对2 种蜡质突变体小麦叶片进行转录组分析,共检测到6 840 个差异表达基因,包含3 181 个上调基因和3 659 个下调基因。进一步对其蜡质功能注释筛选出相关差异显著表达基因26 个,主要包括CER1、MAH1、FAR 和WSD1,这些基因通过调控醛、烷烃、伯醇、仲醇、酮及蜡酯合成过程进而影响小麦表皮蜡质的差异表现。更重要的是,其中2 个CER1 相关基因(TraesCS1D03G0373-900 和TraesCS1D03G0374000)均表达下调,抑制烷烃合成而减少蜡质含量,预测其为小麦叶片蜡质的主调控基因。本研究结果为小麦叶片表皮蜡质的合成基因克隆和功能验证提供了有价值的理论支撑。
