扶正化瘀方药物血清对人脐带间充质干细胞增殖、迁移及旁分泌能力的影响
2021-12-15栾玉玲花东明陈相波王芳孔晓妮冯煜
栾玉玲,花东明,陈相波,王芳,孔晓妮,冯煜
扶正化瘀方药物血清对人脐带间充质干细胞增殖、迁移及旁分泌能力的影响
栾玉玲1,花东明1,陈相波2,王芳1,孔晓妮1,冯煜1
1.上海中医药大学附属曙光医院,上海 200120;2.杭州荣泽生物科技集团有限公司,浙江 杭州 311200
观察扶正化瘀方药物血清对人脐带间充质干细胞(HUCMSCs)增殖、迁移及旁分泌能力的影响。贴壁法分离HUCMSCs,流式细胞术鉴定HUCMSCs表型并检测其分化能力;取第5代HUCMSCs,随机分为空白血清组及5%、10%、15%药物血清组,CCK-8法检测HUCMSCs增殖能力;克隆形成实验检测HUCMSCs增殖能力;划痕实验检测HUCMSCs迁移能力,测量划痕宽度并计算细胞迁移率。Transwell实验检测HUCMSCs迁移能力,统计迁移细胞数目。ELISA检测HUCMSCs旁分泌碱性成纤维细胞生长因子(bFGF)能力。分离培养的HUCMSCs高表达标志物CD90(99.8%)、CD105(97.1%)、CD73(99.9%)、CD44(100%),符合HUCMSCs表型特征并具有成脂/成骨分化功能。CCK-8结果显示,5%、10%、15%药物血清干预HUCMSCs后,均能促进HUCMSCs增殖(<0.05)。克隆形成实验结果显示,与空白血清组比较,5%、10%、15%药物血清组HUCMSCs克隆形成数量增加。划痕实验和Transwell实验结果显示,与空白血清组比较,5%、10%、15%药物血清组干预后,HUCMSCs迁移率明显升高(<0.01),且随药物血清浓度增加,细胞迁移率呈上升趋势。ELISA结果显示,与同一时点空白血清组比较,5%、10%、15%药物血清组HUCMSCs旁分泌bFGF能力明显增强(<0.05)。扶正化瘀方药物血清对HUCMSCs增殖、迁移和旁分泌bFGF能力有明显促进作用。
扶正化瘀方;人脐带间充质干细胞;细胞增殖;细胞迁移;旁分泌
肝纤维化是肝脏对反复慢性炎症、坏死等损伤无效修复后形成的瘢痕组织,随着其程度加重,最终发展为肝硬化甚至肝癌。目前尚无特效药物进行治疗,临床以肝移植术作为终末期肝病唯一有效的治疗手段,但供体缺乏及免疫排斥限制其广泛应用[1]。人脐带间充质干细胞(HUCMSCs)移植术作为治疗肝纤维化的有效方案,其临床有效性不断得到证实[2-3]。但HUCMSCs在体外诱导增殖效率低、生物学功能易受培养环境影响,及其向肝脏迁移能力低等仍是亟待解决的问题[4]。扶正化瘀方可显著改善慢性丙型肝炎患者肝功能及肝纤维化程度[5]。基础研究表明,扶正化瘀方可降低肝纤维化小鼠肝纤维化程度[6]。但扶正化瘀方能否通过增强HUCMSCs功能发挥对肝纤维化的治疗作用,目前尚无相关研究。本研究采用血清药理学方法,观察扶正化瘀方药物血清对体外培养的HUCMSCs增殖、迁移和旁分泌能力的影响,以期为终末期肝病的临床治疗提供实验依据。
1 实验材料
1.1 动物
SPF级雄性SD大鼠20只,12周龄,体质量200~250 g,浙江维通利华实验动物技术有限公司提供,动物生产许可证号SCXK(浙)2019-0001,动物使用许可证号SYXK(沪)2020-0009。饲养于温度20 ℃、相对湿度60%环境,12 h明暗交替,自由饮水。实验前禁食12 h。动物实验经上海中医药大学动物伦理委员会审批(PZSHUTCM201106014)。
1.2 药物
扶正化瘀方浸膏粉(丹参4 g,桃仁2 g,绞股蓝6 g,松花粉2 g,冬虫夏草菌丝8 g,五味子2 g),由上海黄海制药有限责任公司提供。使用前称取适量扶正化瘀方浸膏粉,加入蒸馏水搅拌溶解,配制成浓度为0.24 g/mL溶液。质控标准:每24 g扶正化瘀方浸膏粉中丹酚酸B不少于15.6 mg、丹参素钠不少于13.2 mg、五味子乙素不少于2.28 mg、冬虫夏草菌丝腺苷不少于4.8 mg。
1.3 主要试剂与仪器
Transwell培养小室(美国Costar,货号3422),CCK-8检测试剂盒(英国Abcam,货号ab228554),成脂染色试剂盒(美国Cyagen,货号HUXUC-90031),成骨染色试剂盒(美国Cyagen,货号HUXUC-90021),碱性成纤维细胞生长因子(bFGF)ELISA试剂盒(上海酶联生物,货号ml026040),HUCMSCs标志物检测试剂盒(美国BD公司,货号562245),胎牛血清(FBS,美国Gibco公司,货号10091155),DMEM/F12培养基(美国Gibco公司,货号10565042)。生物洁净安全柜(苏州净化设备有限公司,型号BHC-1300ⅡA/B2),台式低速离心机(德国Eppendorf公司,型号5702R),多功能酶标仪、凝胶成像系统(美国Bio-Rad公司,型号分别为TC20、Gel Doc XR+),二氧化碳培养箱(美国Thermo公司,型号311),流式细胞仪(美国BD公司,型号CNL17-A0009),倒置显微镜(德国Leica公司,型号DMI3000B),电子天平(德国Sartorious公司,型号CP2251)。
2 实验方法
2.1 人脐带间充质干细胞分离与鉴定
HUCMSCs取自正常分娩产妇,采用传统贴壁法,严格按照无菌操作分离HUCMSCs[7]:将脐带剪成0.5~0.8 cm,置于含10%FBS的DMEM/F12培养液中培养12 d,换液去除漂浮组织,待贴壁细胞≥80%时开始传代,传至第3代后进行后续实验。选取第5代细胞,将细胞悬液移入流式管中,加入荧光染料标记细胞,常温避光孵育15 min,流式细胞术检测CD90、CD105、CD73、CD44,鉴定HUCMSCs表型。
2.2 成脂诱导分化能力和成骨诱导分化能力检测
取对数期HUCMSCs,按3×105个/孔接种至6孔板,每孔加入2 mL完全培养基(DMEM/F12+10%FBS),待细胞生长至60%~70%时,更换成2 mL成脂/成骨诱导分化培养基,每隔3 d换新鲜的成脂/成骨诱导分化培养基,诱导3周后,4%多聚甲醛室温固定,加入油红O/茜素红染料染色[8],显微镜下观察有无脂肪小滴或钙结节。
2.3 药物血清制备
将20只大鼠随机分为药物血清组和空白血清组,每组10只。根据人与大鼠体表面积计算给药剂量,药物血清组灌胃2.52 g/kg扶正化瘀方溶液,2次/d,连续3 d。末次灌胃后1 h行腹主动脉采血,室温静置2 h,3 000 r /min离心15 min,吸取血清,0.22 μm滤膜过滤除菌,56 ℃孵育30 min灭活,置于-20 ℃冰箱保存备用。
2.4 CCK-8法检测细胞活力
取第5代HUCMSCs,以1×103个/孔接种于96孔板。将细胞分为空白血清组和5%、10%、15%药物血清组,每组5个复孔,常规培养过夜后,空白血清组加入15%空白血清,5%药物血清组加入5%药物血清和10%空白血清,10%药物血清组加入10%药物血清和5%空白血清,15%药物血清组加入15%药物血清,置于培养箱中培养24、48、72 h,每孔加入10 μL CCK-8溶液,37 ℃孵育2 h,酶标仪波长450 nm处检测各孔吸光度(OD值)。
2.5 克隆形成实验检测细胞增殖能力
将细胞悬液以1×103个/孔接种至6孔板,分别加入相应血清培养14 d,多聚甲醛固定15 min,结晶紫染色20 min,观察克隆形成数量。
2.6 划痕实验检测细胞迁移能力
将HUCMSCs以3×105个/孔接种至6孔板,分别加入相应血清培养24 h,使细胞铺满6孔板,用10 µL枪头借助直尺进行快速划痕。PBS洗涤细胞3次,加入无血清培养基[9]培养12 h,显微镜下观察划痕愈合情况并获取图像,Image J软件分析划痕宽度并计算细胞迁移率。细胞迁移率(%)=实验后划痕宽度÷实验前划痕宽度×100%。
2.7 Transwell实验检测细胞迁移能力
HUCMSCs分别用不同血清培养24 h,收集各组细胞,进行细胞计数,取5×104个细胞,1 000 r/min离心5 min,弃去上清液,用无血清培养基重悬细胞,接种至Tranwell小室上室;将含20%FBS的培养基加入Tranwell小室下室,置于37 ℃、5%CO2培养箱中培养24 h[10]。多聚甲醛固定,结晶紫染色,显微镜下观察,统计迁移细胞数目。
2.8 ELISA检测细胞旁分泌碱性成纤维细胞生长因子能力
将HUCMSCs以3×105个/孔接种至6孔板,加入不同血清培养24、48 h,收集细胞上清液,加入96孔板中,每孔加入酶标试剂0.1 mL,37 ℃孵育60 min,PBS洗涤5次,37 ℃避光显色,酶标仪波长450 nm处测量各孔OD值。以空白孔调零,计算细胞上清液中bFGF含量。
3 统计学方法
4 结果
4.1 人脐带间充质干细胞形态、表型鉴定
脐带培养24 h后可见少量贴壁细胞,72 h全换液后,贴壁细胞明显增多;细胞传至第5代时,呈短梭形、纺锤形贴壁细胞逐渐增多(见图1),局部可形成小的集落,即HUCMSCs克隆。应用流式细胞术分析HUCMSCs表面标志物,结果显示,HUCMSCs高表达标志物CD90(99.8%)、CD105(97.1%)、CD73(99.9%)、CD44(100%),符合HUCMSCs表型特征。
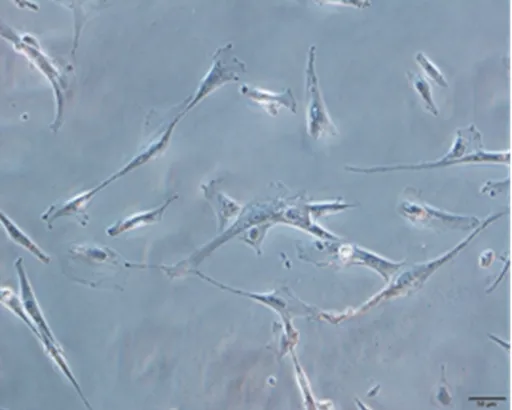
图1 第5代HUCMSCs形态(×200)
4.2 人脐带间充质干细胞分化能力鉴定
成脂诱导分化3周后,油红O染色显示,细胞胞质中脂滴被染成橘红色。成骨诱导分化3周后,茜素红染色显示,细胞内钙质沉淀被染成红色,表明HUCMSCs具有多向分化潜能。见图2。

图2 HUCMSCs成脂成骨分化鉴定(×200)
4.3 扶正化瘀方药物血清对人脐带间充质干细胞增殖能力的影响
CCK-8检测结果显示,5%、10%、15%药物血清培养细胞24、48、72 h能促进HUCMSCs增殖(<0.05,<0.01),见表1。克隆形成实验结果显示,与空白血清组比较,5%、10%、15%药物血清组细胞克隆形成数量明显增加,见图3。

表1 各组HUCMSCs不同时点增殖能力比较(±s,OD值)
注:与同一时点空白血清组比较,*<0.05,**<0.01
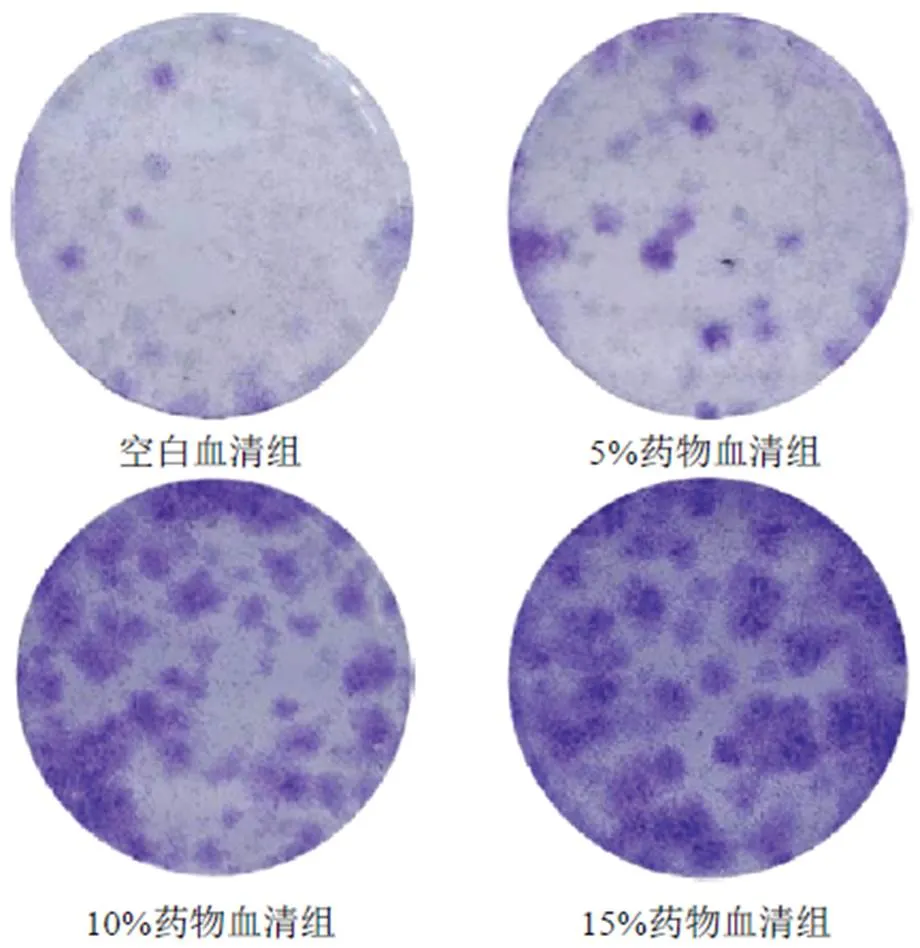
图3 各组HUCMSCs克隆形成数量比较
4.4 扶正化瘀方药物血清对人脐带间充质干细胞迁移能力的影响
划痕实验结果显示,与空白血清组比较,5%、10%、15%药物血清组细胞迁移率明显升高(<0.01),其中,10%、15%药物血清促进HUCMSCs迁移作用更明显(<0.01),见图4、表2。Transwell实验结果显示,与空白血清组比较,5%、10%、15%药物血清组迁移细胞数目显著增加(<0.01),且随药物血清浓度增加,迁移细胞数目增加(<0.01),见图5、表3。
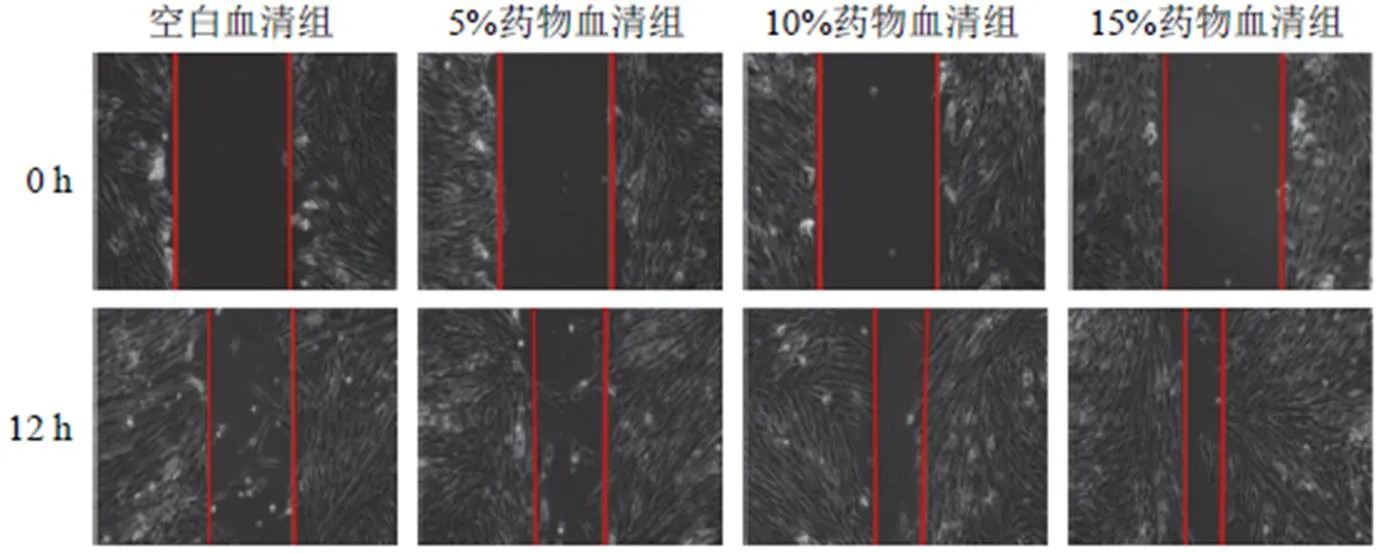
图4 各组HUCMSCs迁移能力比较(划痕实验,×100)

表2 各组HUCMSCs划痕实验细胞迁移率比较(±s,%)
注:与空白血清组比较,**<0.01;与5%药物血清组比较,##<0.01
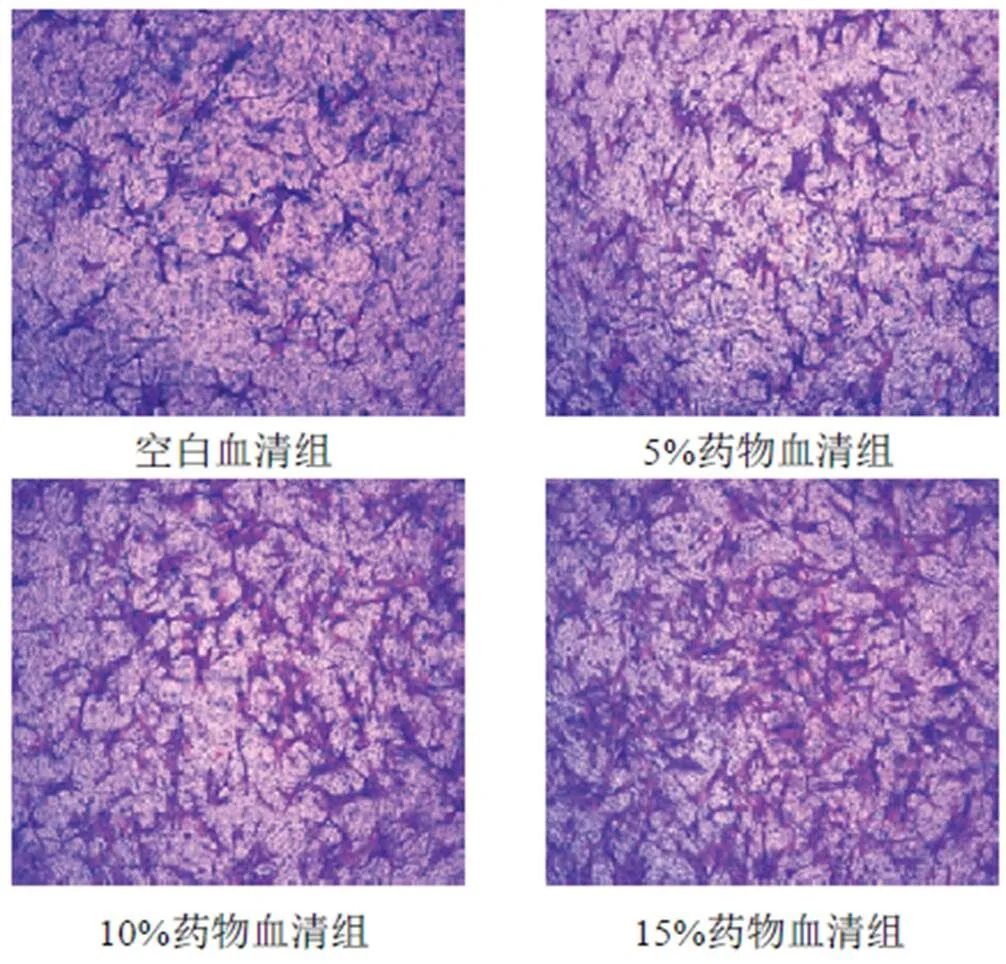
图5 各组HUCMSCs迁移能力比较(Transwell实验,×40)

表3 各组HUCMSCs Transwell实验迁移细胞数目比较(±s,个)
注:与空白血清组比较,**<0.01;与5%药物血清组比较,##<0.01
4.5 扶正化瘀方药物血清对人脐带间充质干细胞旁分泌碱性成纤维细胞生长因子能力的影响
与同一时点空白血清组比较,5%、10%、15%药物血清组HUCMSCs旁分泌bFGF能力升高,差异有统计学意义(<0.05),见表4。

表4 各组HUCMSCs旁分泌bFGF能力比较(±s,pg/mL)
注:与同一时点空白血清组比较,*<0.05,**<0.01
5 讨论
作为间质干细胞的异质性亚群,HUCMSCs具有免疫调节特性,可迁移至受损肝组织与肝细胞融合,或转分化为肝细胞,发挥对肝纤维化的治疗作用,并可通过旁分泌作用分泌可溶性因子,改善纤维化瘢痕区域的微环境,延缓纤维化进程[4,11-12]。但HUCMSCs临床应用存在的问题限制了其发展,如HUCMSCs在体外诱导增殖时增殖率较低,随着培养环境的改变其自我更新能力逐渐丧失,导致体外培养的HUCMSCs失去部分生物学功能。另外,干细胞在治疗肝脏疾病时,存在归巢于肝脏能力低等问题。
肝纤维化属中医学“肝积”范畴,《金匮要略》有“虚劳之人,阴阳伤损,血气凝涩,不能宣通经络,故积聚于内也”的记载。基于其“瘀血内结、正气虚弱”的病机,上海中医药大学总结出治疗肝硬化的临床经验方扶正化瘀方,该方由冬虫夏草菌丝、桃仁、丹参、绞股蓝、五味子、松花粉组成,以具有活血化瘀作用丹参作为君药;桃仁助丹参活血化瘀,冬虫夏草益精气补虚劳共为臣药;松花粉、绞股蓝益气健脾同为佐药;五味子味酸,作为使药引经入肝。丹参主要成分丹酚酸B可促进细胞增殖,降低细胞凋亡率[13]。桃仁可减轻血管内皮生长因子(VEGF)表达,增强Bcl-2表达,抑制内皮细胞凋亡[14]。冬虫夏草菌丝可上调解耦联蛋白2表达,下调肿瘤坏死因子-α表达,发挥保护肝脏的作用[15]。绞股蓝主要成分绞股蓝皂苷可阻断AGEs-RAGE氧化应激信号通路,通过降低细胞上清液丙二醛水平、增加细胞内谷胱甘肽水平,降低细胞氧化应激水平[16]。
扶正化瘀方在缓解临床症状、改善肝纤维化程度及并发症等方面疗效显著[11]。同时,可抑制肝星状细胞活化及增殖,减轻肝组织脂肪变、炎症及纤维化程度,抑制诱导型一氧化氮合酶表达,减轻氧化应激反应及肝细胞损伤,改善肝脏微循环及肝组织缺氧状态;也可通过抑制Kupffer细胞表达VEGF,阻止新生血管形成,促进肝窦毛细血管化逆转[17-19]。本研究进一步探讨了扶正化瘀方药物血清对HUCMSCs增殖、迁移及旁分泌能力的影响,结果表明,扶正化瘀方药物血清可提高HUCMSCs体外增殖、迁移及旁分泌bFGF能力。bFGF作为一种多肽分子,可促进HUCMSCs生长,且经bFGF处理的HUCMSCs在改善肝损伤程度及肝纤维化方面效果更显著[20]。以上研究结果可为扶正化瘀方结合干细胞治疗肝脏疾病的临床应用提供实验依据。
[1] 徐小元,丁惠国,李文刚,等.肝硬化诊治指南[J].临床肝胆病杂志, 2019,35(11):2408-2425.
[2] 孙慧聪,张国尊,郭金波,等.脐带源间充质干细胞移植治疗肝纤维化及肝硬化的相关机制[J].中国组织工程研究,2015,19(41):6638-6645.
[3] ZARE H, JAMSHIDI S, DEHGHAM M M, et al. Bone marrow or adipose tissue mesenchymal stem cells:Comparison of the therapeutic potentials in mice model of acute liver failure[J]. Journal of Cellular Biochemistry,2018,119(7):5834-5842.
[4] 王冬冬,陈刚,胡宗强,等.不同来源间充质干细胞治疗肝纤维化的研究进展[J].临床肝胆病杂志,2016,32(3):597-600.
[5] TAREK H, TERRY D, MYRON J, et al. Sa1319 a phaseⅡ, randomized, placebo-controlled, double-blind, multicenter study to assess the antifibrotic activity ofin chronic hepatitis c patients with hepatic fibrosis(S-USIIT-01)[J]. Gastroenterology, 2014,146(5):261.
[6] 吴硕,马兴彬,周成军,等.扶正化瘀方对肝纤维化小鼠肝细胞中Nrf2表达的影响[J].中华肝脏病杂志,2014,22(8):609-615.
[7]张岳汉,钟志辉,黄林燕,等.人脐带间充质干细胞的分离技术优化及其快速检测体系的建立[J].实验与检验医学,2020,38(4):637-640.
[8] 卞伟,杨丽,孙宏,等.槲皮素对骨髓间充质干细胞增殖和骨向分化的影响[J].中药药理与临床,2016,35(2):27-30.
[9] 兰智慧,李少峰,张元兵,等.温肺化纤汤含药血清对小鼠肺间充质干细胞增殖和迁移能力的影响[J].中华中医药杂志,2017,32(12):5366- 5370.
[10] 王彦超,邓蓉蓉,叶亚东,等.补肾活血舒筋方含药血清对大鼠骨髓间充质干细胞增殖、迁移的影响及其机制[J].山东医药,2017,57(16):38-40.
[11] 关茜,刘伟,陈佳美,等.扶正化瘀方治疗慢性肝病的临床与基础研究进展[J].临床肝胆病杂志,2021,37(6):1449-1453.
[12] 张艳辉,骆亚莉,刘永琦,等.黄芪多糖对骨髓间充质干细胞向肿瘤相关成纤维细胞分化中IL-6/STAT3、TNF-α/NF-κB通路的影响[J].中国中医药信息杂志,2018,25(10):54-59.
[13] 李社芳,苗灵娟,李宁,等.丹酚酸B对糖氧剥夺损伤大鼠海马神经干细胞增殖、凋亡和分化的影响[J].中国组织工程研究,2017,21(17):2735-2740.
[14] 以敏,邓家刚,郝二伟,等.桃仁对血液循环障碍大鼠内皮细胞凋亡及相关蛋白表达的影响[J].中国实验方剂学杂志,2013,19(14):178-182.
[15] 万凌峰,薛博瑜.冬虫夏草有效成分防治肝脏疾病的实验研究[J].北方药学,2014,11(1):54-56.
[16] 王艳,唐灵,周康,等.绞股蓝皂苷对晚期糖基化终末产物诱导人肾小球系膜细胞晚期糖基化终末产物受体表达及氧化应激水平的影响[J].中草药,2015,46(20):3060-3064.
[17] 赵志敏,刘成海.扶正化瘀方抗肝纤维化的主要作用机制与效应物质[J].上海医药,2016,37(13):13-16.
[18] 黄兰蔚,姜娜,平键,等.扶正化瘀复方抑制小鼠自噬的抗纤维化机制研究[J].中华肝脏病杂志,2019,8(8):621-627.
[19] 霍苗苗,程变巧,林伟国,等.扶正化瘀方对非酒精性脂肪性肝病大鼠肝纤维化及ACE-AngⅡ-AT1R轴的影响[J].解放军医学杂志,2018, 43(2):114-119.
[20] 赵福平.碱性成纤维细胞生长因子在骨髓间充质干细胞治疗小鼠肝硬化中的作用[D].兰州:兰州大学,2017.
Effects ofDecoction Contained Serum on Proliferation, Migration and Parapocrine Capacity of Human Umbilical Cord Mesenchymal Stem Cells
LUAN Yuling1, HUA Dongming1, CHEN Xiangbo2, WANG Fang1, KONG Xiaoni1, FENG Yu1
To investigate the effects ofDecoction contained serum on the proliferation, migration and paracocrine ability of human umbilical cord mesenchymal stem cells (HUCMSCs).HUCMSCs were isolated by adherence method. The phenotype and the differentiation ability of HUCMSCs were examined by flow cytometry. The fifth generation of HUCMSCs were randomly divided into blank serum group, 5%, 10% and 15% drug-contained serum group, CCK-8 method was used to detect the proliferation ability of HUCMSCs. The proliferation ability of HUCMSCs was detected by clone formation experiment. The migration ability of HUCMSCs cells was detected by scratch adhesion test. Transwell assay was used to detect the migration ability of HUCMSCs. The ability of HUCMSCs to paracrine bFGF was detected by ELISA.The high expression markers of CD90 (99.8%), CD105 (97.1%), CD73 (99.9%) and CD44 (100%) in isolated and cultured HUCMSCs were consistent with the phenotypes of mesenchymal stem cells and had the ability of osteogenic and adipogenic differentiation. CCK-8 results showed that 5%, 10% and 15% drug-contained serum could promote the proliferation of HUCMSCs (<0.05). The clone formation experiment showed that, compared with the control group, the number of cell clone formation significantly increased in the 5%, 10% and 15% drug-contained serum groups. Scratch adhesion test and Transwell assay results showed that, compared with the control group, the migration rate of HUCMSCs cells in 5%, 10% and 15% drug-contained serum groups significantly increased (<0.01), and the cell migration rate showed increased trend with the increased drug-contained serum. The ELISA result showed that, compared with the control group at the same period, the ability of HUCMSCs to paracrine bFGF in 5%, 10% and 15% drug-contained serum group increased (<0.05).Decoction contained serum can significantly promote the abilities of proliferation, migration and paracrine bFGF of HUCMSCs.
Decoction; human umbilical cord mesenchymal stem cells; cell proliferation; cell migration; paracrine ability
R285.5
A
1005-5304(2021)12-0056-05
10.19879/j.cnki.1005-5304.202104350

国家自然科学基金(81873582);上海中医药大学“研究生创新培养”专项科研项目(3489)
冯煜,E-mail:davisfy@126.com
(2021-04-19)
(修回日期:2021-05-02;编辑:郑宏)
