消化内镜下黏膜剥离术治疗早期结直肠癌的效果
2021-12-14李会敏王世超兰秋红夏兴洲王文真王小星于政洋黄真婷
李会敏,王世超,兰秋红,夏兴洲,王文真,王小星,于政洋,黄真婷
郑州大学第五附属医院消化内科 郑州 450052
结直肠癌(colorectal cancer,CRC)是一种常见的恶性消化道肿瘤。随着社会的发展和生活方式的改变,CRC发病率不断升高,且逐渐趋向年轻化,对人类的身体健康产生了极大的威胁[1]。临床主要采取手术治疗早期CRC,消化内镜下黏膜切除术(endoscopy mucosal resection,EMR)是目前常用的一种微创手术方法,与传统手术比较,其创伤小、并发症少、有利于患者预后[2-3],但有学者[4]发现EMR难以完全切除较大病灶,很可能引起复发,进而影响临床治疗效果。消化内镜下黏膜剥离术(endoscopic submucosal dissection,ESD)是以EMR为基础发展出的一种治疗手段,能够一次性完全剥离癌变病灶,且切除范围广[5]。过氧化物酶体增殖物激活受体γ辅助激活因子1α (peroxisome proliferator activated receptor γ coactivator 1α,PGC-1α)作为转录辅助活化因子之一,与肿瘤的发生发展密切相关[6-7]。血清淀粉样蛋白A(serum amyloid A,SAA)作为一种急性时相反应蛋白,在炎症、心肌梗死、感染、肿瘤等的发生中发挥着重要的作用[8]。本研究观察早期CRC患者ESD术前术后血清PGC-1α和SAA的变化,并对ESD治疗早期CRC的术后并发症发生率、肿瘤复发率和残留率进行临床分析,为早期CRC治疗方案的制订提供参考依据。
1 对象与方法
1.1 一般资料选取2016年8月~2020年1月就诊于郑州大学第五附属医院消化内科的早期CRC患者125例,63例行EMR,62例行ESD。研究对象纳入标准:①参照《中国结直肠癌诊疗规范(2017年版)》[9]中早期CRC诊断标准确诊为早期CRC。②未接受过相关治疗。③心、肝、肾等功能正常。排除标准:①中途退出或死亡。②合并其他恶性肿瘤。③存在手术禁忌证或对本研究手术不耐受。④妊娠或哺乳期妇女。⑤浸润性CRC。⑥合并急慢性病症、血液系统疾病、免疫系统疾病等。本研究通过院伦理委员会审查。患者均知情同意。
1.2 手术方法患者均于术前进行常规治疗和护理,检查凝血功能、血常规、肝肾功能以及心电图等,采用消化内镜(宁波贝格医疗器械有限公司)确定病灶具体位置及其和固有肌层的关系。患者取仰卧位,行全身麻醉。
EMR:用黏膜下注射-切除法向CRC病灶基底部注射生理盐水并将其抬举,再采用圈套器(江苏康进医疗器材有限公司)将病灶切除。当病灶较大时,在消化内镜前端放置透明帽(河南中可美医疗器械有限公司),黏膜下注射生理盐水后,再负压吸引,缩紧圈套器,切除病灶。
ESD:将0.5 mL靛胭脂(南京微创医学科技有限公司)、5.0 mL玻璃酸钠(山东博士伦福瑞达制药有限公司)、1.0 mL肾上腺素(威尔曼医药集团有限公司)、100 mL氯化钠(江苏省勤奋药业有限公司)混合完全后,借助23G注射针进行黏膜注射,若病灶部位仅为直肠,则只注射玻璃酸钠。借助Hook刀(石家庄翰鸿自动化科技有限公司)顺着标记点切开结直肠黏膜,借助一次性黏膜切开刀(杭州安瑞医疗器械有限公司)将病灶处的黏膜下层剥离,直至将病灶组织剥离。当患者大量出血或创面较大时,则钛夹(杭州桐庐医达器械设备有限公司)止血或采取氩离子凝固术对创缘、裸露的小血管、出血点进行处理。术后常规抗感染治疗。
1.3 血清PGC-1α和SAA水平检测两组患者分别于术前和术后1 d抽取清晨空腹肘静脉血3 mL,置于EP管内,常温下静置1 h后,3 000 r/min离心10 min分离血清,于-80 ℃保存。采用免疫定时散色比浊法检测PGC-1α、SAA水平,所用试剂盒由深圳市锦瑞生物科技有限公司提供,相关操作严格遵照试剂盒说明书进行。
1.4 观测指标整块切除指整块病灶被完全切除并获单块标本;完全切除指整块切除标本的垂直和水平切缘均为阴性[10]。随访1 a,无死亡患者,观察并比较两组患者术后并发症(感染、穿孔、出血、吻合口瘘),肿瘤复发、残留[10]发生情况。
1.5 统计学处理采用SPSS 23.0进行分析,两组年龄、手术时间、术前术后血清PGC-1α和SAA水平差值的比较采用两独立样本t检验;性别、病灶直径<2 cm和≥2 cm例数及病灶部位,整块切除及完全切除率,术后并发症发生率,肿瘤复发率和残留率的比较采用χ2检验和精确概率法,检验水准α=0.05。
2 结果
2.1 两组患者一般资料比较患者性别、年龄、病灶直径<2 cm和≥2 cm例数,以及病灶部位的差异无统计学意义,见表1。
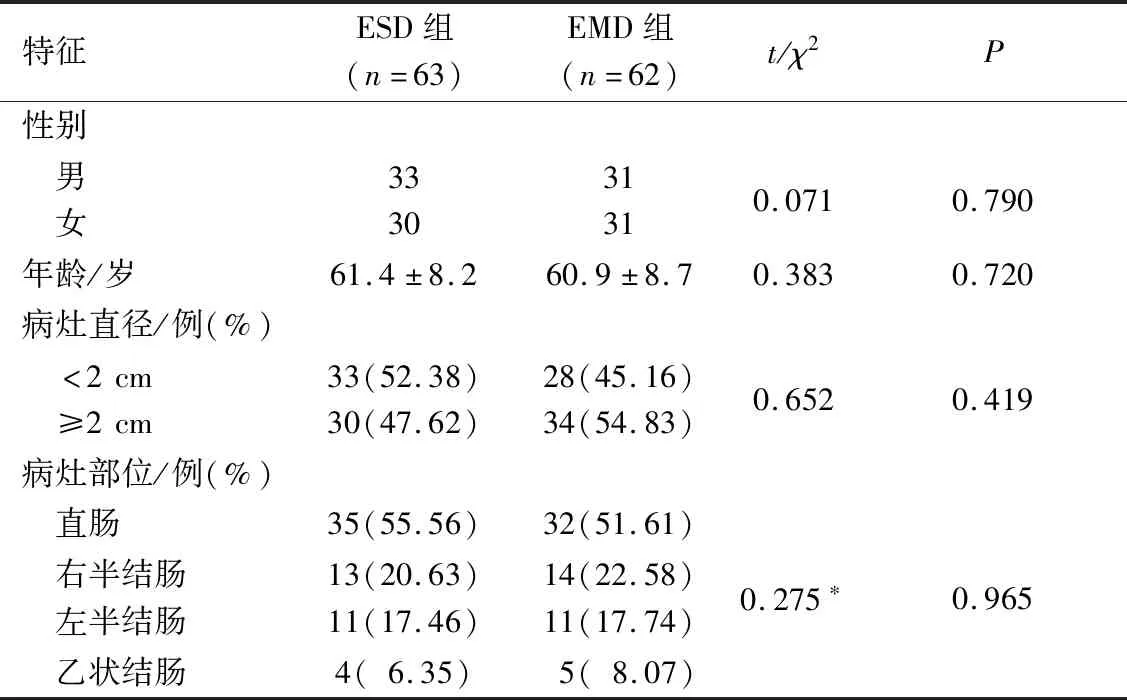
表1 两组患者一般资料比较
2.2 两组患者手术时间、病灶整块切除和完全切除情况比较无论病灶直径<2 cm或≥2 cm,ESD组手术时间均长于EMR组,但病灶整块切除率和完全切除率均高于EMR组。结果见表2。
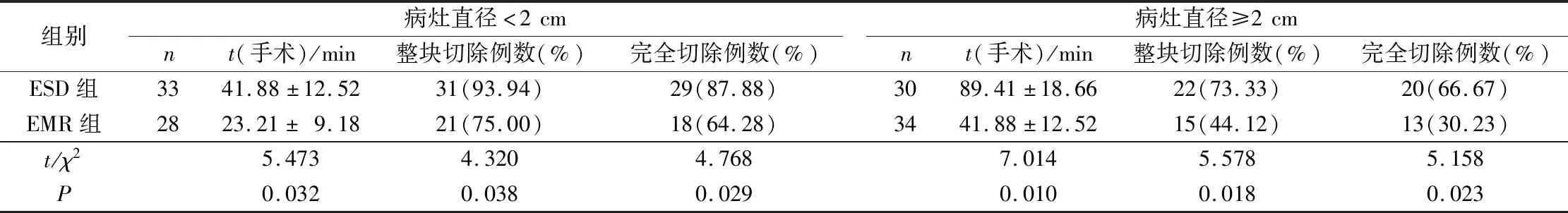
表2 两组患者手术时间、病灶整块切除和完全切除情况比较
2.3 两组患者术前术后血清PGC-1α、SAA水平比较与EMR相比,ESD患者术前术后血清PGC-1α、SAA水平降低幅度大。结果见表3。

表3 两组患者术前术后血清PGC-1α、SAA水平的比较
2.4 两组患者术后并发症发生,肿瘤复发、残留情况的比较见表4。与EMR相比,ESD患者术后并发症发生率升高,肿瘤复发率、残留率降低。ESD患者术后并发症包括感染4例,肠穿孔3例、出血6例,吻合口瘘1例;EMR感染3例,肠穿孔2例。

表4 两组患者术后并发症发生,肿瘤复发、残留情况比较 例(%)
3 讨论
CRC生长速度较为缓慢,早期多无明显症状,具有较强的隐蔽性,大多患者确诊时已至肿瘤中晚期[11-12]。早期CRC治疗不仅能够降低难度,而且还能够提高患者预后。根治性手术、放疗、化疗等是临床治疗CRC的常用手段,虽有一定的疗效,但创伤大、副作用多,导致大多数患者预后不佳。近年来内镜技术得到大力发展,并局有价格低廉、并发症少、微创等特点。EMR是目前最常用的一种内镜手术,在早期CRC的治疗中取得了显著的疗效[13]。而相关研究[14]显示,ESD切除病灶的优势更为明显。
伦伟健等[15]的研究显示,早期CRC EMR手术时间短于ESD。本研究结果与其一致。以上结果提示,ESD手术操作较为复杂、难度更高,同时病灶直径越大,手术难度越高。分析原因可能为结直肠走形曲折、皱襞多、肠壁薄,病灶体积大可能会加大手术难度,对术者的要求也较高。
陈静等[16]的研究结果显示,ESD对结直肠病灶的整块切除率达到了100%,治愈性切除率达到了85.7%。本研究结果显示ESD组病灶整块切除率、完全切除率高于EMR组,提示ESD治疗早期CRC的效果更为显著。对于较大病灶,EMR不能对其进行整体剥离,需分块一一将其切除,因而常常导致病灶切除不全。ESD是以EMR为基础所延伸出的一种新技术,借助Hook刀、Dual刀或IT刀完全切除病灶,并将病灶黏膜一并完全剥离,切除范围广而深[17]。
PGC-1α作为核转录因子中的一种,能够与不同转录因子结合,进而发挥转录和转录后剪接修饰的调控作用,同时还能够调控肿瘤的发生及发展[18];SAA是由肿瘤坏死因子、白介素-1及白介素-6等诱导产生的一种炎性介质,主要合成部位为肝细胞,是一种急性时相蛋白;当机体发生刺激、感染、炎症时,其水平显著升高[19]。PGC-1α在子宫内膜癌、前列腺癌、胃癌等组织中高表达[20];SAA在胃癌、前列腺癌、肾细胞癌、肺癌、直肠癌等组织中表达上调[21]。本研究结果显示,经手术治疗后,两组PGC-1α、SAA水平均降低,且ESD组降低幅度较大,提示ESD治疗早期CRC的效果更佳。
术后并发症、肿瘤复发和残留等均是影响患者预后的危险因素,因此减少其发生是目前临床治疗研究的重点内容之一。徐杲等[22]研究发现ESD治疗胃癌时出血较常见。本研究结果显示,ESD组的术后并发症发生率明显高于EMR组,主要表现为出血,与上述研究结果相符。因此在手术过程中应进行密切观察,一旦出血即给予相对应的止血措施。肖飞等[23]研究结果显示经ESD治疗的食管癌患者的复发率、残留率为3.60%和0.00%。本研究结果显示ESD组的肿瘤复发率、残留率分别为3.17%和0.00%,均低于EMR组。上述研究结果提示ESD治疗早期CRC可显著降低术后肿瘤复发和残留,对改善患者预后有着重要的意义。
综上所述,ESD治疗早期CRC的效果显著,不仅能够提高病灶的切除率,而且还能够降低肿瘤复发和残留风险;但手术时间长、术后并发症多,临床应根据患者具体情况谨慎使用。
