DBD低温等离子体处理对多酚氧化酶活力及构象的影响
2021-12-14成军虎汪慧芬韩永旭
成军虎 汪慧芬 韩永旭
(1.华南理工大学 食品科学与工程学院,广东 广州 510640;2.华南理工大学 现代食品工程研究中心,广东 广州 510006)
多酚氧化酶(Polyphenol Oxidase,PPO)是酶促褐变中的一种主要内源性酶,广泛分布在微生物、动物和植物体中,其活性位点包含双核铜原子,其中一个铜原子与组氨酸相连,另一个铜原子与半胱氨酸相连。在植物体中,一般认为PPO位于叶绿体中,能促进光合作用,降解木质素和促进褐变反应。褐变反应发生在氧气存在的条件下,PPO催化单酚发生羟基化反应生成邻苯二酚,邻苯二酚被进一步催化氧化生成邻苯二醌,产物进一步聚合成黑色或者褐色的物质[1]。PPO催化的酶促褐变是新鲜果蔬及其制品品质劣变的主要原因。这种褐变会引起果蔬色泽、风味等感官品质的劣变,同时降低其营养价值,最终影响消费者的购买欲望,是果蔬加工和储藏过程中的一个难题[2]。开展降低PPO酶活的研究显得尤为重要[3]。
目前控制PPO酶活的方式主要有物理和化学方法。化学方法主要是指通过添加还原剂、螯合剂等抑制PPO的酶活,但有些化学试剂对人体健康有一定的影响且提取步骤复杂,因此目前更多的研究转向了采用天然产物来对PPO的酶活进行抑制。物理方法包括热烫、超高压、脉冲电场及超声波处理等。热烫会破坏苹果汁中的热敏性物质如维生素C和黄酮等;超高压处理在不同的参数设置和样品条件下会呈现不同的效果;脉冲电场通常需要与热处理结合才能达到理想的钝酶效果;超声波需要结合其他处理方式效果才更佳。而低温等离子体作一种新型的非热加工技术,广泛应用于食品加工领域,由于其可以产生丰富的活性物质,呈高氧化态,因此主要应用于杀菌、降解食品表面污染物和生物大分子改性等方面,在果蔬加工及延长货架期等方面也具有很好的应用前景。介质阻挡放电(Dielectric Barrier Discharge,DBD)是等离子体的一种发生方式,由介电材料(如聚丙烯、玻璃和石英)覆盖在一个或两个金属电极(如铜、铝和黄铜)上,通过外部供给能源使电极间的气体电离形成。相较于其余放电形式(辉光、脉冲、电晕等),DBD形式的等离子体技术可在常温、大气压下进行操作,放电安全性高,处理范围广,操作温度低,设备灵活性强,具有良好的工业应用前景。高振红等[4]发现,等离子体对鲜榨猕猴桃汁中氯吡脲的降解率达87.5%;Chutia等[5]发现,等离子体可以延长椰子汁的货架期;Xu等[6]发现,借助DBD等离子体处理不会影响橙汁的糖度值;Illera等[7]利用等离子体在10.5 kV的电压下对苹果汁处理5 min,其中的PPO完全失活。但是,目前鲜见从分子水平上探究等离子体对PPO活性和结构影响的研究。有鉴于此,文中以PPO为研究对象,采用操作空间灵活的DBD等离子体,探究等离子体对PPO分子构象的影响及降低酶活的机制,以期为等离子体控制果蔬及其制品的酶促褐变提供科学依据。
1 材料和方法
1.1 实验材料与仪器
PPO,美国Sigma公司生产;酪氨酸酶、L-左旋多巴,购自阿拉丁试剂(上海)有限公司;磷酸氢二钠和磷酸二氢钠均为分析纯。
DBD- 50低温等离子体设备,南京苏曼等离子体技术有限公司生产;UV- 1800紫外分光光度计,日本岛津公司生产;RF- 6000荧光分光光度计,日本岛津公司生产;J- 810圆二色光谱仪,日本分光公司生产;Multimode 8原子力显微镜(AFM),德国布鲁克公司生产;FE28- Meter pH计,梅特勒-托利多(上海)有限公司生产;AL204 电子分析天平,梅特勒-托利多(上海)有限公司生产;HH- 501恒温水浴锅,常州澳华仪器有限公司生产。
1.2 实验方法
1.2.1 样品的准备与处理
取适量的屈臣氏双蒸水配置pH=6.8的磷酸盐缓冲(Phosphate Buffer Saline,PBS)溶液,将冻干、纯净的PPO溶于预冷(4 ℃)的PBS溶液中。吸取10 mL酶液,依次放入洁净的培养皿(直径3.5 mm)并做好标记,然后进行DBD低温等离子体处理。研究中采用的DBD等离子体包括一个交流电源(CTP- 2000K)和一个DBD等离子体反应器(DBD- 50),其中5 mm厚的石英板材作为电介质材料覆盖在高压电极上。工作电压为0~30 kV,频率为5~20 kHz。两个平面电极之间的工作距离为5.0 mm,选择周围环境的空气作为工作气体。当等离子体稳定(即无明显丝状火花)时,启动定时器,设置处理时间分别为10、30、60、120、180 s,所有测试在24 h内完成。
1.2.2 PPO相对残余酶活的测定
根据Zhou等[8]的方法并做适当修改,采用紫外分光光度法测定PPO的活性。反应混合物包括 1 mL 的PBS(50 mmol/L,pH=6.8)和0.2 mL的L- 左旋多巴,在37 ℃下保温后,加入0.2 mL的PPO溶液启动反应,空白组则加入相同体积的缓冲溶液。记录初始2 min内420 nm波长下吸光度的变化。所有测量重复3次。PPO的相对残余酶活(RA)按下式计算:
(1)
式中,RA表示经DBD低温等离子体处理后PPO的相对残余酶活(%),At为DBD低温等离子体处理后PPO的酶活,下标t代表等离子体处理时间(s),A0为未处理PPO的酶活。
1.2.3 PPO酶活的动力学方程模拟
为进一步了解DBD对PPO的抑制作用,建立一级动力学方程和威布尔模型进行曲线拟合[9]。
一级动力学方程公式为
RA=e-kt
(2)
式中的钝化速率常数k通过最小二乘法非线性回归得到。
威布尔模型的方程如下:
RA=e-(x/α)β
(3)
式中:x为等离子体处理的时间(s);α为比例因子;β为无因次的形状参数,代表模拟曲线的形状。
1.2.4 圆二色光谱测定
室温条件下,利用圆二色(CD)光谱仪对样品进行二级结构的测定,扫描范围为200~250 nm,扫描步长和带宽均设置为1 nm。以PBS为空白对照,重复测定3次。采用Pro-data进行光谱绘制,采用CDNN软件计算二次结构的比例。
1.2.5 荧光光谱测定
在室温条件下,取适量处理前后的PPO溶液(0.12 g/L),采用荧光分光光度法测定PPO的荧光发射光谱,其中激发波长为280 nm,激发和发射的狭缝宽度均设为3 nm,扫描速度为600 nm/min。采集315~400 nm处的光谱,所有样品均重复采集3次。
根据文献[10]的方法并做稍微修改,在室温条件下测定样品的同步荧光光谱,Δλ分别设置为15和60 nm,所有样品均重复采集3次。
根据文献[11]的方法并做稍微修改,在室温条件下测定样品的3D荧光光谱,激发波长设置为200~350 nm,发射扫描波长为280~450 nm,扫描速度为600 nm/min,所有样品均重复采集3次。
1.2.6 AFM测定
在室温条件下利用AFM在分子水平上捕获PPO分子微观结构和形貌的图像。依次取10 μL 等离子体处理和未处理的PPO溶液(40 mg/L)滴在洁净的云母片表面,于通风橱中进行风干处理。样品在轻敲模式下进行扫描,扫描速率和步长分别为0.997 Hz和2 μm,使用NanoScope Analysis 1.8对采集到的AFM图像进行处理和分析。
1.2.7 数据处理
所有测量至少进行3次。用OriginPro 9.1和Python 3.7进行数据绘图分析,采用SPSS进行数据方差分析(ANOVA)。皮尔森相关系数采用Python 3.7进行多重分析。
2 结果和讨论
2.1 等离子体处理后PPO的相对残余酶活及动力学模拟分析
如图1所示,DBD低温等离子体处理对PPO的活性产生了显著的抑制作用。在最初的10 s内,PPO的相对残余酶活急剧下降为38%。随着处理时间的延长,PPO酶活呈现平稳下降的趋势,当处理时间达到120和180 s时,几乎检测不到PPO的酶活力,这说明DBD等离子体对PPO溶液产生的物理轰击促进了酶活力的降低[12]。为了进一步研究低温等离子体抑制PPO活力的机制,研究中采用一阶动力学和威布尔模型对PPO的失活进行建模分析[9]。

(a)一级动力学方程拟合曲线

(b)威布尔模型拟合曲线
模型拟合结果如表1所示。本研究中,一阶动力学模型的均方根误差(RMSE)偏高,说明该模型在描述低温等离子体对PPO的钝化效果时并不理想。此外,图1(a)中所示的失活过程近似分成两段,这也暗示着DBD等离子体对复杂结构的PPO的抑制作用可能涉及不同的过程。威布尔模型则具有较高的相关系数(r2)和较低的RMSE,说明拟合的效果较好。一般地,β=1表示数据模拟结果为一条直线,β>1表示数据模拟结果是一条向上凸起的曲线,β<1表示数据模拟结果是一条下凹的曲线。从图1可以明显地看出,威布尔模拟的结果为一条下凹的曲线,形状参数β<1也证实了这一结果;此外,β<1还说明了PPO对长时间等离子体处理的抵抗性,这一现象得到了文献[13]结果的支持。威布尔模型也被应用在其他非热加工技术抑制酶活的研究中。

表1 等离子体抑制PPO酶活的动力学模型拟合结果
2.2 等离子体处理PPO的圆二色光谱分析
圆二色光谱可用于快速检测天然蛋白质在热、超声波和超高压处理等物理过程中的二级结构变化,以及与变性剂结合的相互作用[14]。PPO的二级结构包括α-螺旋、β-折叠、β-转角和无规则卷曲,可以通过测定其CD光谱计算得出。如图2(b) 所示,未经处理的PPO,其α-螺旋结构(占比39.92%)为主要的二级结构,这与Zhou等[8]的研究结果一致。在起始的60 s内,随着等离子体处理时间的延长,205~220 nm处的峰均向上逐渐移动。当处理时间延长至120和180 s时,可以看到峰的强度和形状出现了显著的变化(几乎持平),说明PPO分子中不同形式的二级结构之间发生了转换。为了详细地描述这种转换,利用CDNN软件定量计算了各二级结构的百分比。经过180 s的处理后,α-螺旋结构大幅减少,占比从最初的39.92%下降到9.47%;β-折叠结构占比则从15.32%上升到44.30%,同时伴随着β-转角的轻微降低;相反,无规则卷曲呈上升趋势。以上结果说明,DBD等离子体对PPO二级结构产生了较强的破环作用,使得PPO构象向无规则、不稳定转变。

(a)圆二色光谱

(b)二级结构占比
2.3 等离子体处理PPO的荧光光谱分析
荧光光谱是一种简易、快捷的光谱诊断方式,蛋白质三级结构微环境的变化可以通过荧光光谱进行定性的分析[15]。一般来说,荧光发射光谱揭示了蛋白质的内源荧光,荧光主要来源于芳香族氨基酸残基(色氨酸、酪氨酸和苯丙氨酸)和肽键的变化,由于酪氨酸的荧光总是被附近的羧基或者别的氨基酸淬灭,而苯丙氨酸的荧光量子产率有限,因此,蛋白质的内源荧光主要来源于色氨酸[16]。如图3(a)所示,随等离子体处理时间的延长,PPO的荧光强度呈降低的趋势。在荧光发射光谱中,PPO的荧光强度从未处理时的512.9下降到330.6,最大吸收峰的位置有1.75 nm的红移。
同步荧光光谱在扫描过程中使激发波长和发射波长之间保持固定的差值Δλ,从而可以更加细致地展示芳香族氨基酸的变化。通常,当Δλ设置为15 nm时,显示的是酪氨酸残基周围微环境的变化;当Δλ设置为60 nm时,显示的是色氨酸附近微环境的变化;当最大荧光吸收峰变化时,说明色氨酸和酪氨酸周围的微环境发生了变化。芳香族氨基酸因为有较大的疏水面积而被掩盖在蛋白质的核心部位,即在两个蛋白质结构域或子结构的界面上,或者在寡聚蛋白组的亚界面上,当吸收光子后,吲哚环上的电子重新排布而导致荧光吸收峰红移[17]。当蛋白质的三级结构和四级结构被破坏时,这些氨基酸侧链就会暴露在极性环境中,从而引起荧光光谱的改变。在同步荧光光谱中,当Δλ=15 nm时,PPO的荧光强度仅呈现较轻微的变化,从未处理时的190.8下降到118.2,但是最大吸收峰的位置有1 nm的蓝移,说明酪氨酸附近微环境的疏水性增强,蛋白质进一步折叠,荧光强度的下降说明了等离子体的淬灭作用;当Δλ=60 nm时,PPO的荧光强度呈现与荧光发射光谱近似的变化趋势,暴露于DBD等离子体180 s后,荧光强度从最初的486.1下降到322.05,最大吸收峰呈现最大1 nm的红移,这进一步说明色氨酸在内源荧光发射光谱中起主要作用,经过DBD低温等离子体处理后,PPO分子中色氨酸周围微环境的亲水性增强,极性增大。以上结果表明,等离子体的作用位点更加靠近色氨酸所在的位置。Takai等[18]也报道了色氨酸受到的等离子体的修饰作用。

(a)荧光发射光谱
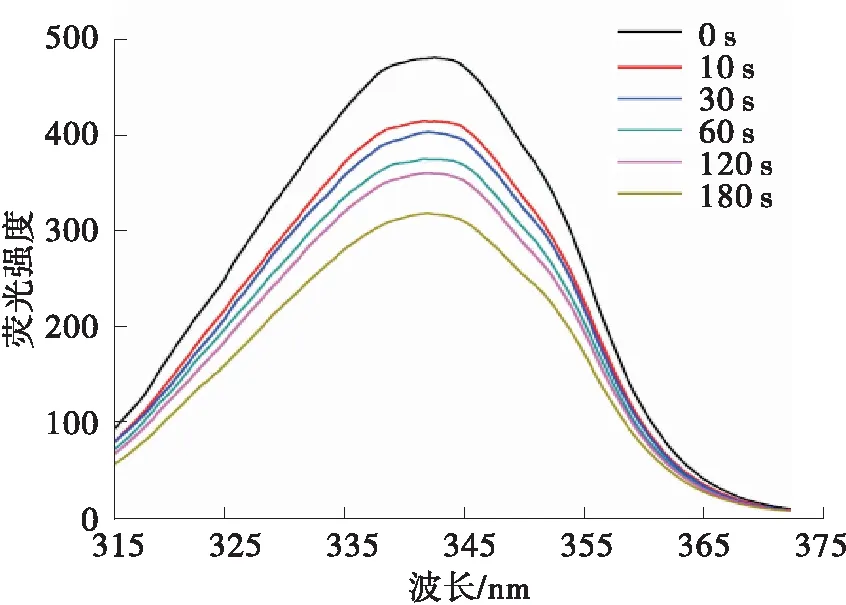
(b)Δλ=60 nm的同步荧光光谱

(c)Δλ=15 nm的同步荧光光谱
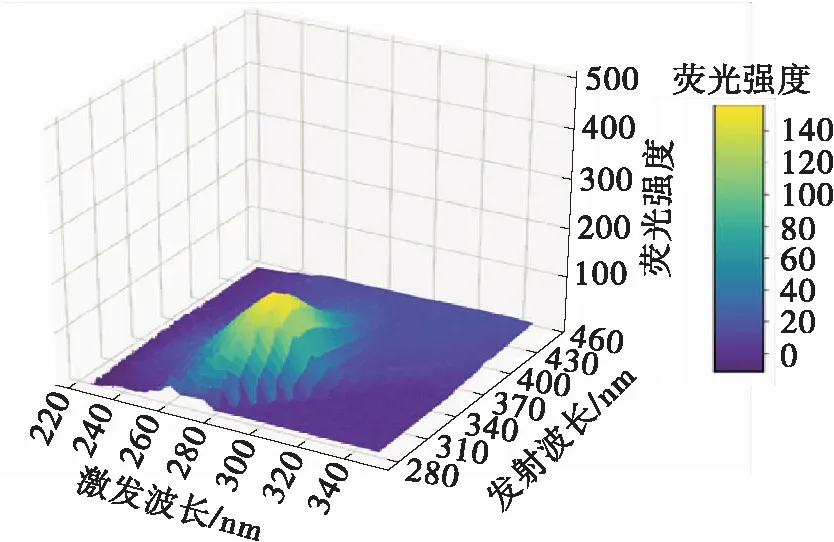
为了更加全面、详细地解释DBD等离子体对PPO构象的影响,采用3D荧光光谱进行监测。3D荧光光谱被认为和人的指纹图谱一样,能够提供专一、特有的信息,因此被称为“荧光指纹”[19]。它呈现的是荧光强度同时随着激发波长和发射波长而变化的等高线图,已逐渐成为一种可靠、完善的分析方法,能够更加科学地揭示蛋白质空间构象的特异性变化[11]。如图4(a)所示,通过对PPO分子的3D光谱进行处理,将拉曼峰和瑞利散射峰去除,未处理的PPO有两个峰,峰1在λex=230 nm附近,峰2在λex=280 nm附近。随着DBD低温等离子体处理时间的延长,峰1和峰2的强度均下降,可以明显地看出,当处理时间延长到120 s时,峰1消失。王瑞[11]认为,当激发波长为230和330 nm时,荧光峰代表了蛋白质多肽链骨架结构的特征吸收峰。以上结果表明,DBD处理对肽链骨架和芳香族氨基酸周围的微环境造成了影响,对色氨酸和酪氨酸的内源荧光产生了淬灭作用,这与前述报道一致——Takai等[18]的研究指出,等离子体影响二硫键和羰基的形成,以及对氨基酸残基的修饰,从而影响蛋白质多肽链骨架。
2.4 等离子体处理PPO的AFM结果分析
AFM结果可以表征PPO分子的颗粒形态、大小和高度。图5所示为DBD低温等离子体处理前后PPO的AFM图像。使用NanoScope Analysis软件对图像进行分析可知:未经处理PPO分子的平均直径为109.64 nm,平均高度为3.251 nm;经等离子体处理后,PPO分子的平均高度和粒径随着处理时间的延长逐渐下降(处理10 s的除外);在最初10 s的处理时间内,PPO分子的平均高度下降了0.52 nm,平均粒径上升了25.29 nm;处理时间延长到30 s,PPO分子的平均高度上升了0.13 nm,平均粒径下降了27.80 nm,说明在较短时间(30 s)的等离子体处理条件下,PPO分子发生了聚集作用。从图5(b)和5(c)可以看出,PPO分子形成较大且变形的颗粒,这可能是因为在等离子体高能粒子的轰炸及活性氧、活性氮的作用下,PPO蛋白质分子之间发生了化学键的断裂与重组,巯基被氧化[16],使得蛋白分子团进一步变大。但是随着处理时间的延长,持续的高强度轰炸以及活性成分的持续氧化,会使PPO分子团发生解聚作用,PPO分子逐渐变小。通过计算得到,当处理时间增加到60、120和180 s时,PPO分子的平均高度依次下降到2.362、1.462和1.390 nm,平均粒径依次下降到75.659、65.840和66.792 nm。

(a)处理0 s

(b)处理10 s

(c)处理30 s

(d)处理60 s

(e)处理120 s
(f)处理180 s


3 结论
文中研究了DBD低温等离子体处理对PPO活力及构象的影响,得到以下结论:
1)PPO活力随着处理时间的延长而降低,且在处理120 s时几乎检测不到其酶活,说明DBD等离子体对PPO产生的物理轰击降低了PPO的酶活;
2)DBD低温等离子体处理对PPO二级结构的破坏程度较大,处理180 s后,PPO的α-螺旋结构占比从最初的39.92%下降到9.74%,β-折叠结构占比从最初的15.32%上升到44.30%;
3)随着等离子体处理时间的延长,PPO的内源荧光强度和同步荧光强度均呈现降低的趋势,3D荧光光谱显示,无论是芳香氨基酸还是肽链骨架,都受到了等离子体的修饰作用,特别是当处理时间达180 s时,PPO多肽链骨架的3D荧光吸收峰消失;
4)AFM结果显示,PPO分子的平均高度和大小随着处理时间的延长逐渐下降(处理10 s时的除外),颗粒形态呈现先聚集再解聚的现象,等离子体处理破坏了PPO分子的聚集状态,活性中心完全暴露在活性成分中,从而引起PPO活性的丧失。
