miR-452-5p 靶向SOX5 调控信号通路对乳腺癌细胞增殖与侵袭的影响
2021-12-13冯连杰付小娜赵世杰刘伟鹏
魏 涛,冯连杰,付小娜,赵世杰,刘伟鹏,梁 豪
乳腺癌患者的死亡多由局部肿瘤转移引起[1],在肿瘤转移过程中,侵袭性癌细胞的增殖程序受基因的调控[2]。miRNA 是一类内源性非编码小RNA,可通过与靶基因结合,调控蛋白的表达和细胞功能。已有研究发现,miR-452-5p 可抑制乳腺癌细胞转移[3],miR-485-5p 通过靶向survivin 抑制乳腺癌的进展和化学敏感性[4]。在细胞中,小RNA 通过与靶基因的3'-未翻译区互补结合抑制基因表达,研究显示,miR-146a-5p 通过调控SOX5 的表达影响三阴性乳腺癌细胞的增殖和转移[5]。SOX5 作为癌基因发挥作用,抑制SOX5 的表达可抑制非小细胞肺癌和前列腺癌的发展[6,7]。SOX5 被证明是由多个小RNA 调控的,但在乳腺癌中,miR-452-5p 是否调控SOX5 还没有研究。笔者通过检测miR-452-5p、SOX5 的表达,探讨miR-452-5p 对乳腺癌细胞增殖、侵袭、迁移的影响。
1 材料与方法
1.1 材料人乳腺上皮细胞株HBL-100、人乳腺癌MCF-7、SKBR-3、BT549 细胞株(上海细胞库);胎牛血清、RPMI 1640 培养基(美国Gibco 公司);Tranwell 小室(美国Millipore 公司);Matrigel 胶(美国BD 公司);MTT、DMSO(美国Sigma 公司);miRcon、miR-con mimic 的构建(上海吉凯基因公司);SOX5、Cyclin D1、CDK4、MMP-2、MMP-9 一抗(美国Abcam 公 司);Twist、N-cadherin、Vimentin、βactin 抗体(美国CST 公司);lipofectamine TM2000转染试剂(美国invitrogen 公司);SOX5 过表达载体及空载体、SOX5 野生型(WT)或突变型(MUT)荧光素酶报告载体(广州复能基因有限公司);miR-452-5p、SOX5 引物(上海生工公司);IgG 二抗(北京博奥森生物科技有限公司);RIPA 裂解液、BCA 蛋白检测试剂盒(美国Thermo scientificals 公司);酶标仪购自Bio-Red 公司;电子荧光显微镜购自日本Olympus 公司;Western blot 发光成像系统(美国UVP公司)。
1.2 实验方法
1.2.1 细胞的培养与分组 HBL-100、MCF-7、SKBR-3、BT549 细胞置于含10%胎牛血清的RPMI 1640 培养基中,置于37 ℃、5%CO2培养箱中培养。实验首先分为空白对照组(NC),阴性对照组(miRcon),miR-452-5p 过表达组(miR-452-5p mimic);miR-con 组:将miR-con 转染至SKBR-3 细胞中;miR-452-5p mimic 组:将miR-452-5p mimic 转染至SKBR-3 细胞中。后续实验分为miR-con 组,miR-452-5p mimic 组,miR-452-5p+pcDNA 组,miR-452-5p+pcDNA-SOX5 组;miR-452-5p +pcDNA 组,将pcDNA空载体转染miR-452-5p mimic 细胞;miR-452-5p+pcDNA-SOX5 组,将pcDNA-SOX5 载体转染miR-452-5p mimic 细胞,比较2 组间检测数据的差异。
1.2.2 细胞转染 miR-452-5p mimic、miR-con 使用lipofectamineTM2000 转染试剂进行转染,转染后6 h 后更换培养基,荧光显微镜下观察转染效率;pcDNA-SOX5 通过慢病毒转染细胞。
1.2.3 实时荧光定量PCR 细胞中提取总RNA,反转录为cDNA,荧光定量PCR 仪进行实时荧光定量PCR,反应参数设置为95 ℃预变性2 min,95 ℃变性15 s,60 ℃退火20 s,72 ℃延伸20 s,共40 个循环。以U6 和β-actin 分别为miR-452-5p、SOX5 的内参基因,采用2-ΔΔct方法计算miR-452-5p、SOX5 的相对表达量,实验重复3 次取平均值。引物序列:miR-452-5p:F 5'-GACCCAATACGAGTCGGCAATTCCA ACT-3',R 5'-GCGAGGTCAAGTCACTAGTGGT-3';U6:F 5'-CTCGCTTCGGCAGCACA-3',R 5'-AACG CTTCACGAATTTGCGT-3';SOX5:F 5'-CAGCCAG AGTTAGCACAATAGG-3',R 5'-CTGTTGTTCCCGT CGGAGTT-3';β-actin:F 5'-GGAGCGAGATCCCT CCAAAAT-3',R 5'-GGCTGTTGTCATACTTCTCAT GG-3'。
1.2.4 MTT 法检测细胞增殖情况 调整SKBR-3细胞浓度至5×104个/ml,96 孔板每孔加入100 μl细胞悬液,分别于24 h,48 h,72 h 检测细胞活力;每孔加入MTT 试剂20 μl,继续培养4 h,离心保留下层细胞,每孔加入100 μl DMSO,锡箔纸包裹震荡孵育15 min,酶标仪检测490 nm 波长的吸光度。
1.2.5 Transwell 实验检测乳腺癌细胞的迁移和侵袭能力 Transwells 小室接种5×104个SKBR-3 细胞,培养24 h 后检测迁移至小室膜细胞数,200 倍光镜下随机选取5 个视野比较穿膜细胞数。Matrigel包被小室基底膜,其余步骤与迁移实验相同,检测细胞侵袭能力。实验均独立重复3 次。使用相同方法检测miR-con 组,miR-452-5p mimic 组,miR-452-5p+pcDNA 组,miR-452-5p+pcDNA-SOX5 组SKBR-3 细胞的迁移侵袭能力。
1.2.6 双荧光素酶实验检测miR-452-5p 对SOX5的影响 构建野生型pGL3-SOX5-3’UTR(wt-SOX5 3’UTR)和突变型pGL3-SOX5-3’UTR(mutpGL3-SOX5-3’UTR)表达载体转染至miR-con、miR-452-5p mimic SKBR-3 细胞,转染后48 h 裂解细胞,双荧光素酶检测系统检测双荧光素酶活性,检测miR-452-5p 对SOX5 荧光活性的调控。
1.2.7 采用蛋白印迹(western blot,WB)法检测蛋白表达情况 RIPA 裂解液裂解细胞,提取细胞中总蛋白,BCA 试剂盒测定蛋白浓度;SDS 变性蛋白;电泳转膜封闭1,一抗以1∶500 稀释后4 ℃孵育过夜,二抗孵育1 h,ECL 显影液显影,AI600 成像系统观察目的蛋白条带,Image J 软件对目的条带进行灰度值分析,以β-Actin 为内参进行灰度值比较。
1.3 统计学方法采用SPSS 22.0 进行数据分析。2 组间比较采用t 检验,多组间比较采用单因素方差分析,进一步两两比较采用snk-q 检验;以P<0.05 为差异具有统计学意义。
2 结果
2.1 miR-452-5p 和SOX5 在乳腺癌细胞系中的表达RT-qPCR 检测结果显示,乳腺癌细胞系MCF-7、SKBR-3、BT549 中miR-452-5p 表达显著低于正 常乳腺癌细胞系HBL-100(P<0.05),且SKBR-3 细胞中miR-452-5p 表达水平最低(图1A)。乳腺癌细胞系MCF-7、SKBR-3、BT549 中SOX5 mRNA 及蛋白水平显著高于HBL-100(P<0.05),且SKBR-3 细胞中SOX5 mRNA 及蛋白水平均最高(图1B~D),选择乳腺癌细胞系SKBR-3 进行后续功能实验。

图1 miR-452-5p、SOX5 在乳腺癌细胞系中的表达
2.2 转染miR-452-5p 抑制乳腺癌SKBR-3 细胞增殖在SKBR-3 细胞中分别转染 miR-con、NC和miR-452-5p mimic,RT-qPCR 检测显示,与NC、miR-con 组比较,转染miR-452-5p mimic 后,乳腺癌SKBR-3 细胞miR-452-5p 表达水平显著升高(P<0.05)(图2A)。MTT 检测显示,与NC、miR-con组比较,过表达miR-452-5p 后乳腺癌SKBR-3 细胞活性显著降低(P<0.05)(图2B)。Western blot 结果显示,与NC、miR-con 组比较,过表达miR-452-5p 后,细胞周期蛋白Cyclin D1、CDK4 表达水平显著降低(P<0.05)(图2C、D)。

图2 转染miR-452-5p 对乳腺癌细胞增殖的影响
2.3 转染miR-452-5p 抑制乳腺癌SKBR-3 细胞迁移和侵袭Transwell 侵袭实验显示,与NC、miR-con 组比较,转染miR-452-5p mimic 组乳腺癌SKBR-3 细胞迁移和侵袭数量显著降低(P<0.05)(图3A、B),提示miR-452-5p 能够抑制乳腺癌细胞的迁移和侵袭。Western blot 结果显示,与NC、miR-con 组比较,过表达miR-452-5p 后,乳腺癌SKBR-3 细胞中与侵袭、转移密切相关的MMP-2、MMP-9 蛋白表达水平显著降低(P<0.05)(图3C、D)。

图3 转染miR-452-5p 对抑制乳腺癌细胞迁移和侵袭的影响
2.4 miR-452-5p 靶向SOX5TargetScan 软件预测miR-452-5p 与SOX5 3’UTR 存在结合位点(图4A),荧光素酶实验进一步验证miR-452-5p 与SOX53’UTR 关系,根据预测结果构建SOX5-WT-3’UTR 和SOX5-MUT-3’UTR 质粒,分别与miR-452-5p mimic 或miR-452-5p NC 共转染至SKBR-3 细胞,荧光素酶报告基因显示,只有SOX5-WT--3’UTR 与miR-452-5p mimic 共转染组的荧光素酶活性显著降低(P<0.05),其余三组荧光素酶活性无明显差异,提示miR-452-5p 可与SOX5 特异性结合(图4B)。Western blot 结果显示,过表达miR-452-5p 后SOX5 表达显著减少,沉默miR-452-5p后SOX5 表达显著升高(P<0.05)(图4C)。
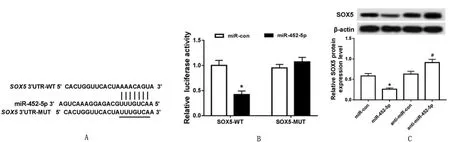
图4 miR-452-5p 靶向SOX5
2.5 过表达SOX5 降低miR-452-5p 对乳腺癌SKBR-3 细胞的抑制作用MTT 检测显示,与miR-con 组比较,过表达miR-452-5p 后,miR-452-5p 组乳腺癌SKBR-3 细胞增殖活性受到抑制,迁移数和细胞侵袭数显著减少,SOX5、Cyclin D1、CDK4、MMP-2、MMP-9 蛋白水平均显著降低(P<0.05);过表达SOX5 后,与miR-452-5p+pcDNA 组比较,miR-452-5p+pcDNA-SOX5 组细胞活性显著增加、迁移和侵袭数显著增加,SOX5、Cyclin D1、CDK4、MMP-2、MMP-9 蛋白水平显著增加(P<0.05)(图5)。

图5 过表达SOX5 部分逆转miR-452-5p 抑制乳腺癌细胞增殖、迁移和侵袭
2.6 miR-452-5p 调控SOX5 影响乳腺癌SKBR-3细胞中Twist1 信号通路和EMT 的发生Western blot 结果显示,与miR-con 组比较,过表达miR-452-5p 后,Twist、N-cadherin、Vimentin 蛋白水平显著降低,E-cadherin 水平显著升高(P<0.05);过表达SOX5 后,与miR-452-5p 组比较,miR-452-5p+pcDNA-SOX5 组Twist、N-cadherin、Vimentin 蛋 白水平显著增加,E-cadherin 水平显著降低,miR-452-5p+pcDNA 组各蛋白水平与miR-452-5p 组无显著变化(图6)。
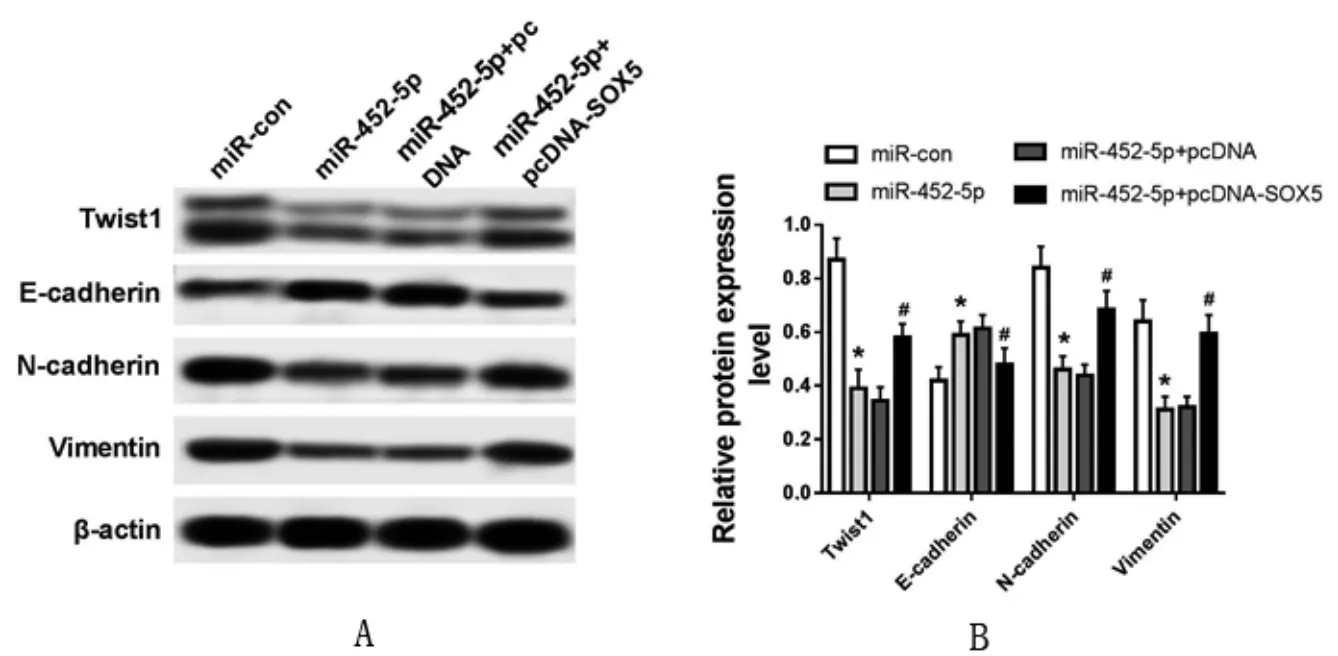
图6 miR-452-5p 调控SOX5 影响乳腺癌细胞中AKT 信号通路
3 讨论
乳腺癌进展缓慢,但仍是引起女性癌症死亡的主要原因[8]。目前关于乳腺癌的治疗主要有手术、化疗、放疗、激素治疗和靶向治疗。随着对乳腺癌研究的深入,目前的治疗方法极大地改善了患者的预后,但是耐药性和肿瘤细胞复发转移仍然限制了当前治疗方法的有效性。
miRNA 是一类长约20~25 个核苷酸的内源性非编码小RNA,通过碱基互补配对的方式与靶基因结合,调控基因的表达。有研究报道,提高miR-452-5p 的表达可抑制肝癌细胞的恶性侵袭和迁移[9]。该研究结果显示,miR-452-5p 在乳腺癌细胞中低表达,过表达miR-452-5p 可抑制细胞的增殖、侵袭和转移,与上述研究结果相似,提示miR-452-5p 在乳腺癌细胞中发挥抑癌基因作用。
Cyclin D1 调控细胞增殖周期的G1-S 过程,其在正常组织中不表达或者低表达,在恶性肿瘤组织中高表达[10]。CDK 也是调节细胞周期的重要蛋白,包括CDK1~7,CDK 蛋白的激活依赖于Cyclin 的结合[11]。CDK4 是细胞增殖周期G1-S 过程的重要成分,其在肿瘤和细胞系中异常高表达[12]。研究报道,喉癌细胞中Cyclin D1、CDK4 表达水平显著高于正常喉上皮细胞,抑制Cyclin D1 或CDK4 表达后喉癌细胞的增殖受到抑制[13]。该研究中过表达miR-452-5p 后,乳腺癌SKBR-3 细胞Cyclin D1、CDK4蛋白水平显著降低,提示miR-452-5p 发挥抑癌基因作用,阻滞细胞的增殖。
MMPs 活化可促进细胞外基质(Extracellular matrix,ECM)降解,促进癌细胞的侵袭和转移[14]。研究报道,MMP-2、MMP-9 在人卵巢黏液囊腺上皮癌细胞高表达,其表达水平与细胞的恶性程度,侵袭和转移密切相关[15]。该研究中过表达miR-452-5p后,乳腺癌SKBR-3 细胞MMP-2、MMP-9 蛋白水平显著降低,提示过表达miR-452-5p 可抑制细胞侵袭和转移能力,进一步验证了miR-452-5p 的抑癌作用。
TargetScan 软件预测miR-452-5p 与SOX5 3’UTR 存在结合位点,该研究进一步采用双荧光素酶实验验证显示,miR-452-5p 靶向调控SOX5 的表达。SOX 家族可编码包括SOX1~15、17、18、21、30等一系列转录因子,SOX5 基因位于染色体12p12.1区域,其在细胞生长、增殖、分化中发挥重要作用[16]。近年来发现,SOX5 作为癌基因在前列腺癌、三阴性乳腺癌等几种癌症中高表达[5,7]。该研究结果显示,SOX5 在乳腺癌细胞系中的表达水平显著高于正常乳腺癌细胞,与上述研究结果一致,提示SOX5 在乳腺癌中发挥癌基因作用。研究表明,SOX5 可以被小RNA 调控,在前列腺癌细胞中,miR-139-5p 的升高导致SOX5 表达下降[17]。该研究中过表达miR-452-5p 后,乳腺癌SKBR-3 细胞SOX5 蛋白水平显著降低,提示miR-452-5p 可调控SOX5 的表达。研究报道,过表达SOX5 可促进胃癌细胞的增殖和侵袭[18]。该研究中过表达SOX5 后发现,细胞的增殖活性显著增强,细胞迁移和侵袭数显著增加,SOX5、Cyclin D1、CDK4、MMP-2、MMP-9 蛋白水平显著增加,提示过表达SOX5,可降低miR-452-5p 对乳腺癌细胞的增殖抑制、侵袭和迁移抑制作用。恶性肿瘤的发展是多因素、多步骤的病理变化,有研究报道,Twist信号通路、EMT 过程与多种肿瘤细胞的侵袭转移途径相关,调节前列腺癌细胞中SOX5 的表达,可以抑制Twist 表达进而抑制EMT 过程[19]。该研究中过表达miR-452-5p 后,Twist、N-cadherin、Vimentin 蛋白水平显著降低,E-cadherin 水平显著升高,EMT进程受到抑制。过表达SOX5 后,Twist、N-cadherin、Vimentin 蛋白水平显著增加,E-cadherin 水平显著降低,减弱miR-452-5p 对EMT 的抑制作用,提示可通过调节SOX5 表达调控EMT 过程。从机制上讲,miR-452-5p 调控SOX5 的表达,抑制EMT 过程,抑制乳腺癌细胞的增殖和迁移,为miR-452-5p作为乳腺癌的治疗靶点提供有力的理论依据。
综上所述,该研究初步证实miR-452-5p 可能通过靶向SOX5 调控Twist 信号通路进而抑制乳腺癌细胞增殖、侵袭和迁移,其机制可能与Twist 通路相关。
