大肠埃希氏菌荧光定量PCR法与酶底物法相关性分析
2021-12-09路晓锋
路晓锋,吴 凡
(广东粤港供水有限公司,广东深圳 518001)
大肠埃希氏菌,属于革兰氏阴性短杆菌,鞭毛周生,能运动,无芽孢,兼性厌氧生长,是人体和其他动物肠道中的正常寄居细菌[1-2]。但当人体机体免疫功能降低时,这类细菌会表现出对人体的致病性,通常表现为腹泻、肠炎等症状,因此,大肠埃希氏菌也被归类为条件致病菌[3-5]。在水质检测领域,国内外水质标准中通常把大肠埃希氏菌作为水体受粪便污染的检测指标。
国内《生活饮用水标准检验方法》(GB/T 5750—2006)中对大肠埃希氏菌的检测方法包括多管发酵法、滤膜法和酶底物法,其中酶底物法检测步骤最简单,仅需在水样中加入MMO-MUG培养基进行24 h培养后即可得到大肠埃希氏菌的结果,目前已逐渐被广泛采用。但检测结果需要1 d,具有一定的滞后性,不能满足水样应急检测的需求。荧光定量PCR法通过提取大肠埃希氏菌的基因,利用设计好的大肠埃希氏菌靶标基因引物进行基因扩增,以仪器读取的荧光强度计算出基因的拷贝数,整个操作仅需1~2 h,且能对多个样品进行同步检测,适合大批量的试验操作。楼秋雯等[6]进行相关的方法研究,使用荧光定量PCR中的染料法对大肠埃希氏菌靶标基因进行定量检测。由于染料法使用SYBR Green Ⅰ对双链DNA结合后的荧光信号值进行检测判断,同时对非特异扩增的荧光信号也会进行读取,容易造成检测结果的误差。因此,本试验使用探针法检测大肠埃希氏菌靶标基因,提高检测的特异性。对大肠埃希氏菌不同检测方法的比较,陈樑[7]将荧光定量PCR法和滤膜法的检测结果进行比较分析,发现两种方法的相关性较强。但大多数研究使用定性的结果进行比较,没有进行定量,且目前针对水体中大肠埃希氏菌的荧光定量PCR法与酶底物法检测结果的相关性研究仍较少,能否把荧光定量PCR法作为酶底物法的补充方法仍缺乏相关的数据支撑。
通过前期的试验,建立了针对大肠埃希氏菌靶标基因gus的荧光定量PCR法,方法灵敏度高、检测时间短,能批量进行样品检测。在前期研究的基础上,进一步比较分析荧光定量PCR法和酶底物法的相关性,为荧光定量PCR法能实际应用于水体中大肠埃希氏菌的检测提供理论依据。
1 材料和方法
1.1 设备和耗材
荧光定量PCR仪(美国伯乐);恒温培养箱(上海一恒);移液枪(德国艾本德);高压蒸汽灭菌器(雅马拓);生物安全柜(苏净安泰);程控定量封口机(美国爱德士);97孔定量盘(美国爱德士);8连PCR管(美国伯乐);纯水机(密理博);水浴锅(常州朗越);核酸分光光度计(美国赛默飞);接种环。
1.2 菌种和试剂
大肠埃希氏菌(CMCC 44102,中国医学细菌菌种保藏管理中心);酶底物法试剂盒(美国爱德士);麦氏比浊管试剂盒(广东环凯);营养肉汤培养基(广东环凯);2×itaq Mix试剂盒(美国伯乐);大肠埃希氏菌质粒DNA标准菌株(上海生工);质粒DNA小量抽提试剂盒(北京天根);引物和探针(上海生工),碱基序列如表1所示。

表1 大肠埃希氏菌荧光定量PCR检测用引物和探针序列Tab.1 Primers and Fluorogenic Probes for Detection of Escherichia coli
1.3 样品检测
1.3.1 样品制备与采集
(1)标准菌株模拟配水样品
制备不同浓度梯度的大肠埃希氏菌模拟水样样品。对干粉菌株进行复苏后传代培养,第三代的培养物作为试验用菌株。使用接种环挑取培养后的菌落接种于肉汤培养基,经培养把肉汤培养物添加到1号麦氏比浊标准管内,对照标准管的细菌浓度使用0.9%灭菌的生理盐水进行稀释,麦氏比浊的标准对照如表2所示。以系列稀释方式制备1、10、50、100、500、1 000、1 500、2 000 CFU/(100 mL)的大肠埃希氏菌系列样品,每个梯度样品各200 mL。对梯度样品分别使用酶底物法和荧光定量PCR法进行操作,两种方法使用的样品量均为100 mL。

表2 麦氏比浊标准对照Tab.2 McFarland Standards Control
(2)采集实际水样样品
采集不同来源的水源水各300 mL,分别使用100 mL水样进行荧光定量PCR法和酶底物法的比对试验,编号分别为1#水源水、2#水源水和3#水源水。同时,同步采集不同的出厂水(1#出厂水、2#出厂水和3#出厂水)各300 mL和不同的管网水(1#管网水、2#管网水和3#管网水)各300 mL进行两种方法的比对试验,每种方法使用水样各100 mL,并分别在90 mL的3#水源水、3#出厂水和3#管网水中加入10 mL浓度为5 000 CFU/(100 mL)标准菌株,编号分别为4#含标准菌株水源水、4#含标准菌株出厂水和4#含标准菌株管网水。
1.3.2 酶底物法检测大肠埃希氏菌
参照《生活饮用水标准检验方法》(GB/T 5750.12—2006)4.3节中酶底物法操作进行。
1.3.3 荧光定量PCR法检测大肠埃希氏菌
使用质粒DNA小量抽提试剂盒对含标准品的质粒菌株提取质粒DNA,用于构建标准品的标准曲线,取10 μL液体作为检测用的标准品DNA模板。使用快速法提取水样样品的DNA。对样品进行离心,10 000 r/min离心10 min,留取下层液体约5 mL,充分混匀后分次转移到1.5 mL同一离心管中,7 500 r/min离心5 min收集菌体沉淀物,在沉淀物中加入10 μL的无菌水,充分混匀,100 ℃水浴10 min,水浴结束后12 000 r/min离心10 min,吸取上清液约10 μL作为检测用的DNA模板,-20 ℃保存备用。
配置标准品拷贝数浓度梯度,对提取的质粒DNA使用核酸分光光度计进行质粒的浓度测定,核酸分光光度计在检测前需使用灭菌的去离子水进行调零。测定的质粒浓度经换算公式得出标准品的拷贝数,使用无菌水进行10倍的逐级稀释,制备成107、106、105、104、103、102、101Copies/μL这7个标准浓度,用于建立荧光定量PCR法的标准曲线。
配置荧光定量PCR反应体系,具体含量如下:10 μmol/L的上游引物2.5 μL,10 μmol/L的下游引物2.5 μL,10 μmol/L的探针2.5 μL,2×itaq Mix试剂12.5 μL,DNA模板2 μL,无菌水补充至25 μL。反应体系设置阳性对照和阴性对照,其中,阳性对照使用拷贝数为102Copies/μL的标准品,阴性对照使用无菌水。
荧光定量PCR扩增程序,95 ℃预变性5 min,95 ℃变性5 s,60 ℃延伸30 s,变性与延伸步骤循环40次,延伸阶段读取荧光信号,荧光通道选择6-羧基荧光素(FAM)模式。
2 结果和讨论
2.1 酶底物法检测
对大肠埃希氏菌系列浓度梯度标准水样和实际水样进行酶底物法检测,使用爱德士酶底物法检测试剂盒,每个样品使用量为100 mL,培养结束后使用366 nm紫外光光源照射,大肠埃希氏菌在光源下会显示荧光,统计97孔定量盘中发出荧光的孔数,对照MPN表得出检测结果,如表3~表5所示。

表3 大肠埃希氏菌酶底物法标准水样检测结果Tab.3 Detection Results of Escherichia coli by Enzyme Substrate Technique for Standard Water Samples
由表3可知,酶底物法检测结果与比浊法测定的样品浓度接近,相关系数r=0.99,表明酶底物法能较真实地反映浓度梯度范围内的样品浓度。表4和表5是使用酶底物法应用于水源水、出厂水和管网水的检测结果,水源水、含标准菌株水源水、含标准菌株出厂水和含标准菌株管网水结果显示,酶底物法能有效检出含有大肠埃希氏菌的实际水样,且检测结果与含标准菌株水样的理论浓度接近,可作为与荧光定量PCR法方法比对的可靠方法。
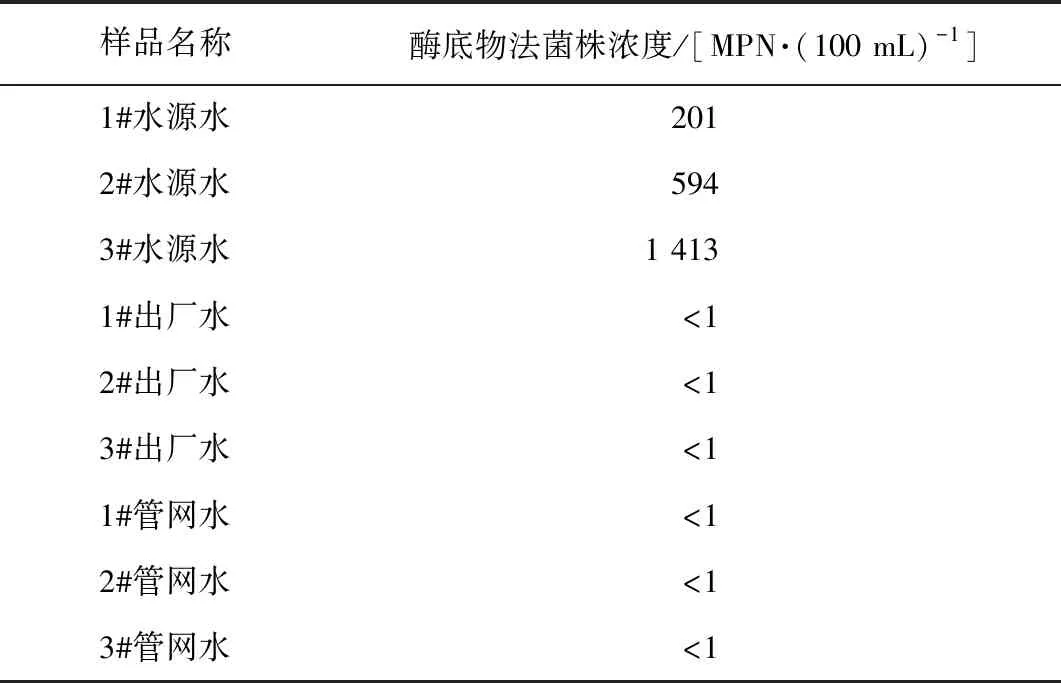
表4 大肠埃希氏菌酶底物法实际水样检测结果Tab.4 Detection Results of Escherichia coli by Enzyme Substrate Technique for Water Samples

表5 含标准菌株水样检测结果Tab.5 Detection Results of Water Samples Containing Standard Strains
2.2 荧光定量PCR法检测
2.2.1 建立标准品质粒的标准曲线
使用质粒DNA小量抽提试剂盒对质粒DNA进行抽提,按照试剂盒说明书进行操作,最后使用10 μL无菌水洗脱质粒,对抽提的质粒DNA使用核酸分光光度计进行浓度检测,质量浓度为40 ng/μL,计算出标准品的拷贝数为2.01×1010Copies/μL,具体计算如式(1)[8]。对初始标准品使用无菌水稀释后配置成系列浓度标准品,先取5 μL拷贝数约为2.01×1010Copies/μL的初始标准品与5 μL无菌水混匀,此时标准品拷贝数约为1010Copies/μL,再取10 μL拷贝数约为1010Copies/μL的标准品与90 μL无菌水混匀制备成拷贝数约为109Copies/μL的标准品。以相同10倍逐渐稀释的方式制备成约107、106、105、104、103、102、101Copies/μL的系列标准品用于制备标准曲线,绘制成的标准曲线用于样品的定量,以标准品拷贝数的对数值为横坐标,以仪器测定的荧光信号到达阈值时的循环数(cycle threshold,Ct值)为纵坐标,其中Ct值即PCR扩增反应的次数,当样品的初始拷贝数越高,所需要的反应次数越少,标准曲线如图1所示。浓度梯度质粒的扩增曲线如图2所示,横坐标为Ct值,图上表示从基线到指数增长的拐点所对应的循环数,即扩增曲线与水平基线相交点所对应的横坐标的值;纵坐标为相对荧光单位(relative fluorescence units,RFU),表示经PCR反应后的信号强度,即被扩增的产物量。
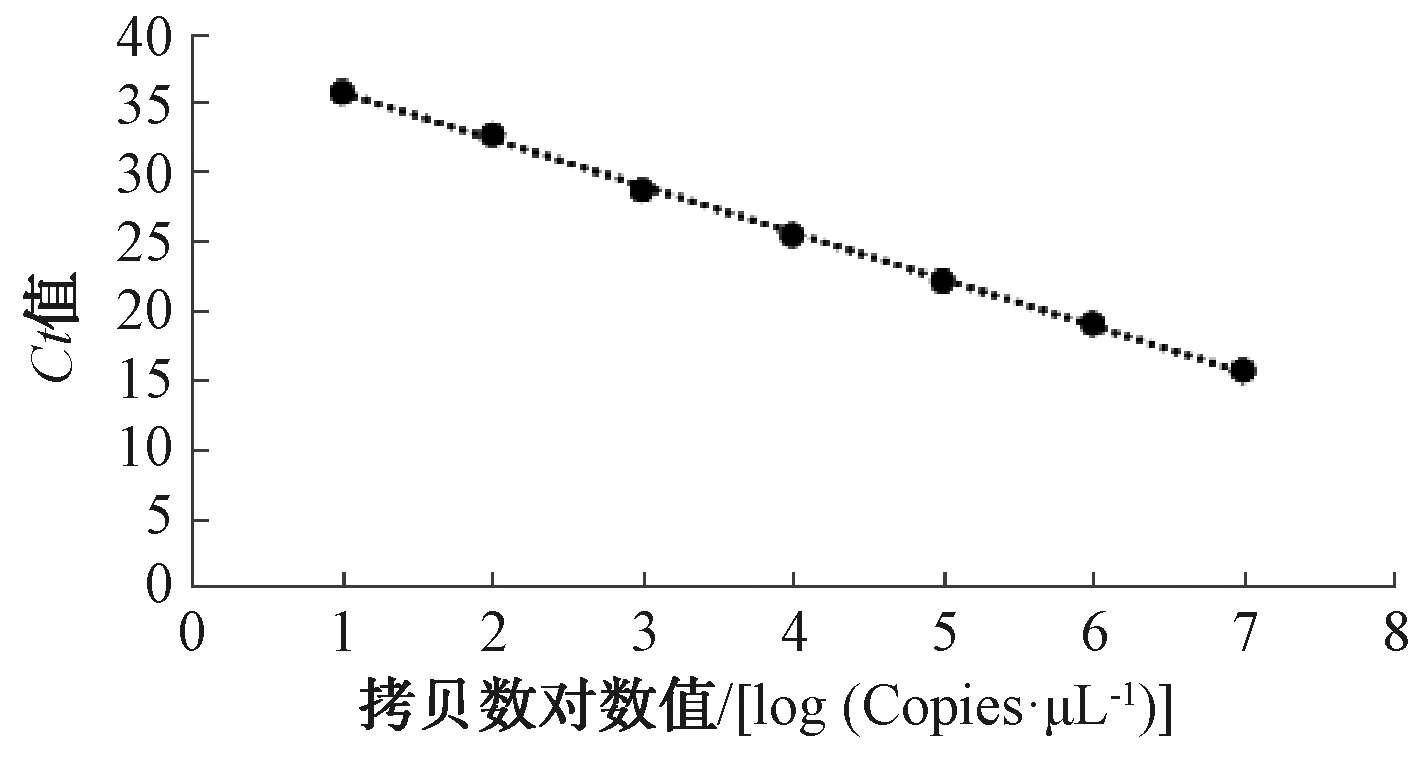
图1 大肠埃希氏菌荧光定量PCR标准曲线Fig.1 Standard Curve Recorded with the Real-Time PCR for Escherichia coli Detection

图2 大肠埃希氏菌荧光定量PCR扩增曲线Fig.2 Amplification Curves Recorded with the Real-Time PCR for Escherichia coli Detection
(1)
其中:Cn——标准品拷贝数,Copies/μL,即每μL中大肠埃希氏菌gus基因的个数;
NA——阿伏加德罗常数,6.02×1023Copies/mol,即1 mol的拷贝数为6.02×1023Copies;
C——质粒浓度,ng/μL,取40 ng/μL;
L——大肠埃希氏菌gus基因长度,1 811 碱基数(bp),bp代表基因的长度;
660——每个碱基的物质的摩尔质量,g/(mol·bp)。
图1的标准曲线方程为Ct=-3.368 6x+39.041,相关系数r=0.999,扩增效率为98.1%,扩增效率表示PCR反应对扩增样品的效率,理论上PCR反应为指数增长,即反应n次,对应的扩增产物增长为原来的2n,扩增效率计算如式(2)[9]。不同扩增曲线间的间隔明显,可满足标准曲线用于大肠埃希氏菌样品的定量检测。
(2)
其中:E——扩增效率,一般在90%~110%;
k——标准曲线方程的斜率。
2.2.2 大肠埃希氏菌荧光定量PCR法检测
对大肠埃希氏菌系列浓度标准水样和实际水样进行定量分析,每个样品进行3次平行试验,通过检测的Ct值代入标准曲线的公式,计算得出拷贝数浓度,最后经体积换算出100 mL样品的大肠埃希氏菌靶标基因的拷贝数。具体检测结果如表6和表7所示。
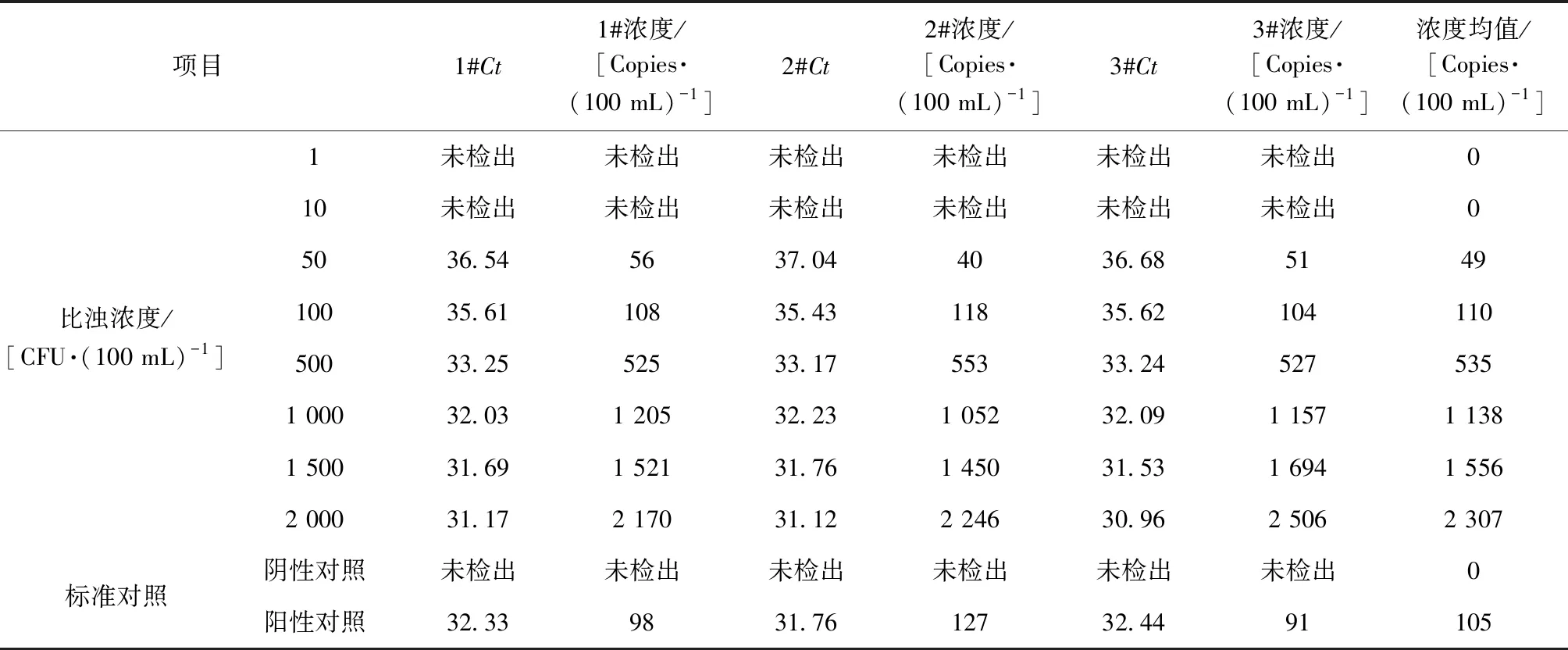
表6 大肠埃希氏菌荧光定量PCR法标准水样检测结果Tab.6 Detection Results of Escherichia coli by Fluorescence Quantitative PCR for Standard Water Samples
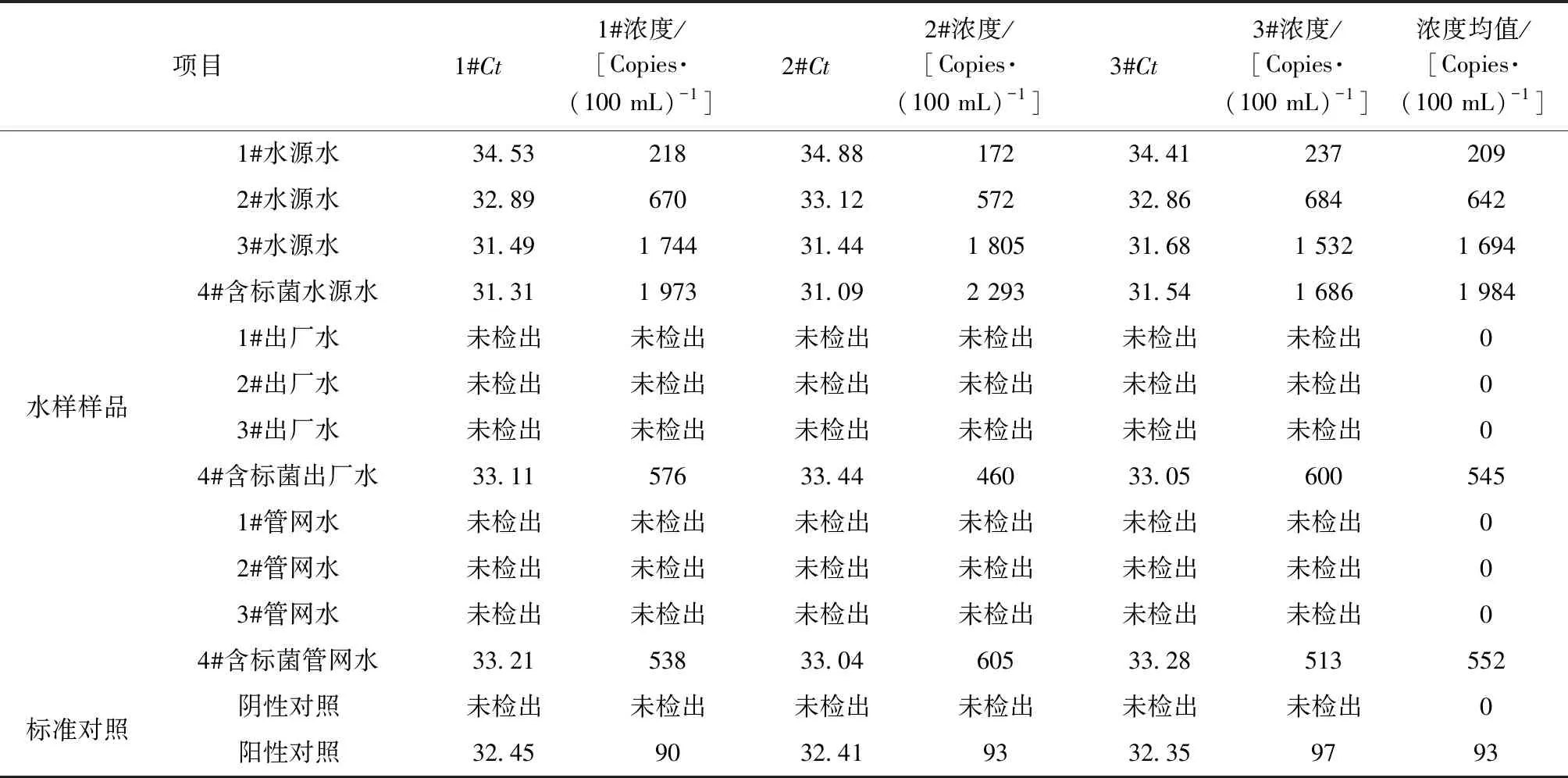
表7 大肠埃希氏菌荧光定量PCR法实际水样检测结果Tab.7 Detection Results of Escherichia coli by Fluorescence Quantitative PCR for Water Samples
大肠埃希氏菌荧光定量PCR检测结果与比浊法检测的菌液浓度无显著性差异,两者相关系数r=0.99,阴性对照与阳性对照结果准确,表明用于大肠埃希氏菌靶标基因gus的荧光定量PCR法能真实反映浓度梯度范围内的样品浓度。从实际水样的检测结果分析,荧光定量PCR法对含标菌的不同类型水样及水源水均能检出,且含标菌样品检测结果与标准菌株浓度相接近,表明荧光定量PCR法对实际水样的检测结果可靠。浓度梯度的标准水样样品和实际水样样品平行样品间的相对标准偏差分别在3%~16%和8%~16%,检测方法的精密度较好,能满足对大肠埃希氏菌的检测要求。对于浓度在1~10 CFU/(100 mL)的样品,荧光定量PCR法不能进行检测,所有检测结果均为未检出,方法适合应用于50 CFU/(100 mL)及以上的样品的定量检测。
2.2.3 荧光定量PCR法与酶底物法相关性分析
将荧光定量PCR法与酶底物法的检测结果进行相关性线性回归分析,结果如图3所示。
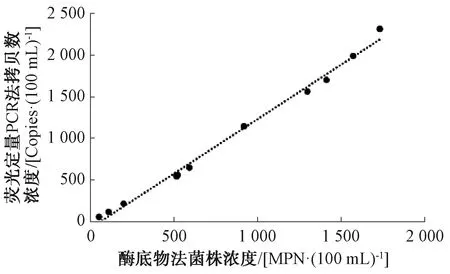
图3 荧光定量PCR法与酶底物法线性回归图Fig.3 Linear Regression between Fluorescence Quantitative PCR and Enzyme Substrate Technique
由图3可知,两种方法的相关性系数r=0.99,表明两种方法的相关性较好。如表8所示,将两种方法的检测结果进行统计学分析,使用配对t检验方法进行结果评价,分析结果表明,P=0.58>0.05,配对t检验结果的绝对值|t|=0.56,小于t双尾临界值,表示两组数据在α=0.05的置信水平上无差异。综上,荧光定量PCR法能作为酶底物法的有效补充方法。
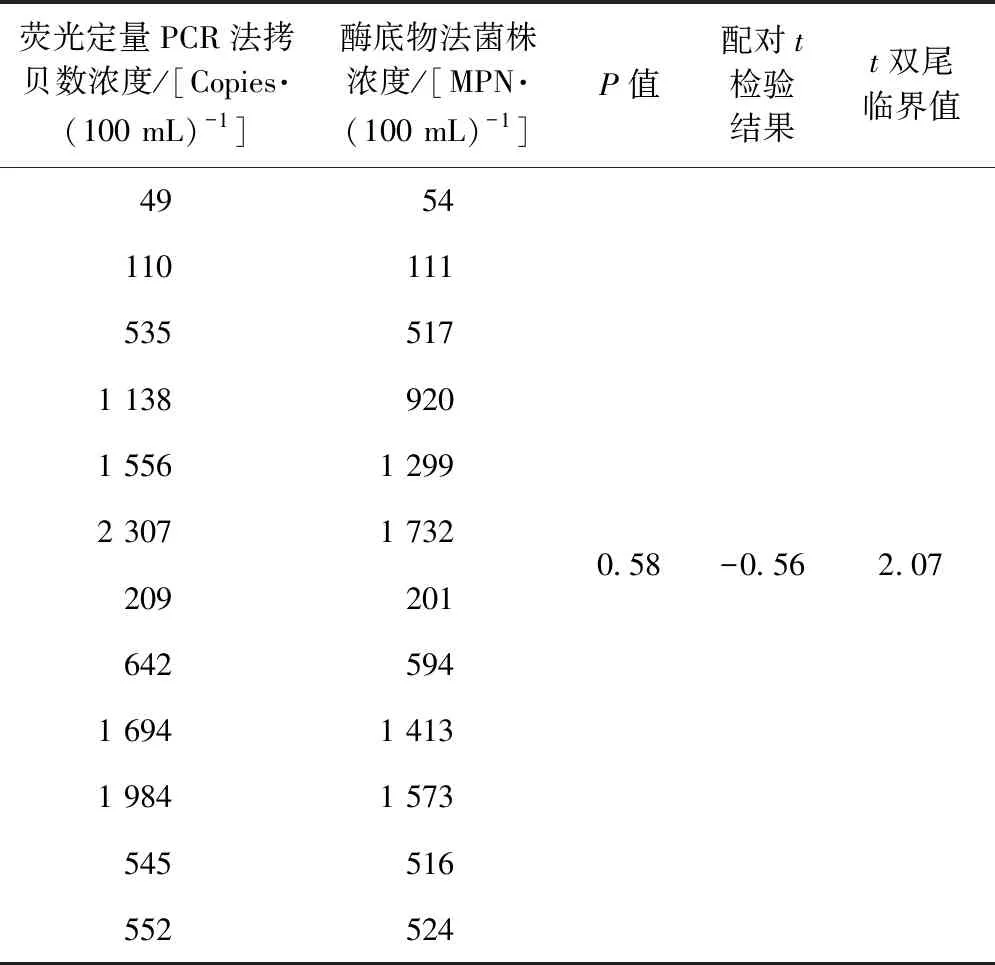
表8 荧光定量PCR法与酶底物法统计学分析Tab.8 Statistical Analysis between Fluorescence Quantitative PCR and Enzyme Substrate Technique
刘渠等[10]使用总大肠菌群β-半乳糖苷酶编码基因lacZ作为靶标基因建立荧光定量PCR法,并与多管发酵法进行相关性分析,结果表明含量为100 CFU/(100 mL)水平以上的总大肠菌群样品,两种检测方法的相关性较高,相关性系数r=0.99。刘永军等[11]使用通用引物荧光定量PCR法对5个地表水体的病原性肠杆菌进行检测,并与滤膜法检测的总大肠菌群、菌落总数与粪大肠菌群的计数结果进行相关性分析,结果显示荧光定量PCR结果与总大肠菌群、菌落总数与粪大肠菌群的滤膜法计数结果均呈显著性正相关,相关系数r分别为0.983、0.908、0.948。本研究对含量为50 CFU/(100 mL)的大肠埃希氏菌样品建立荧光定量PCR法与酶底物法的相关性分析,结果表明在此浓度上的相关系数r=0.99,相比使用lacZ基因的总大肠菌群荧光定量PCR检测结果,试验在更低细菌含量水平上达到较好的相关性,表明方法的灵敏度比以往的研究方法高。同时,使用针对β-葡萄糖醛酸酶编码基因gus进行大肠埃希氏菌荧光定量PCR法检测,比使用通用引物对大肠菌群进行检测的相关系数更高,表明使用专一性引物比通用引物具有更高的准确性。
在实际水质检测中,对于大肠埃希氏菌的标准检测方法均需要经过至少24 h的培养基培养后才能得出检测结果,不能满足应急检测时检测结果的及时性要求。从对比试验分析,可以采用荧光定量PCR法应用于水体中大肠埃希氏菌的检测,且荧光定量PCR法能在1~2 h内得出检测结果,能更好地适用于水体大肠埃希氏菌的应急检测需求。
3 结论
(1)使用荧光定量PCR法能检测大肠埃希氏菌靶标基因gus,检测浓度在101~ 107Copies/μL具有较高的线性关系。
(2)荧光定量PCR法检测浓度梯度的大肠埃希氏菌样品时,检测结果与比浊法的菌液浓度数值相接近;在实际水样检测中,对含有标准菌株的不同类型水样及水源水均能检出阳性结果,管网水与出厂水均为阴性结果,含标准菌株样品检测结果与理论浓度值接近。PCR阴性对照结果为未检出,阳性对照检测结果分别为105 Copies/μL和93 Copies/μL,与标准浓度100 Copies/μL相接近。以上结果表明检测方法的准确度高。浓度梯度标准水样与实际水样平行样品间的相对标准偏差分别在3%~16%和8%~16%,检测方法的精密度较好。方法适合于浓度在50 CFU/(100 mL)及以上样品的定量检测。
(3)荧光定量PCR法与酶底物法相关性分析,在系列浓度为50~2 000 CFU/(100 mL)的模拟水样及实际水样检测中,两种方法的相关系数r=0.99,相关性较好,经统计学分析两种方法无显著性差异,表明荧光定量PCR法能作为酶底物法的有效补充方法。
