Vibrio sp.FG1琼胶酶的分离纯化及酶学性质研究
2021-12-09张力雄刘明明方再光
张力雄,刘明明,方再光
琼胶是一种特殊的海藻多糖,可从石花菜等红藻类植物中提取出来,是海洋红藻类植物细胞壁的一种粘性多糖,由于其独特的凝固性和稳定性等优良性质使其极具经济价值[1].琼胶酶是一种糖苷水解酶(GH)类,能够特异性降解琼胶,其水解产物是琼胶寡糖[2].根据作用方式的不同可以把琼胶酶分为两类:α-琼胶酶和β-琼胶酶[3].琼胶酶产生菌的来源有海水、海洋软体动物、海洋沉积物、土壤及海藻等,海洋环境成为其最主要来源[4].目前,已报道多种琼胶酶产生菌,包括假单胞菌属(Pseudomonas sp.)[5]、交替单胞菌属(Al⁃teromonas sp.)[6]、噬纤维菌属(Cytophaga sp.)[7]、弧菌属(Vibrio sp.)[8]、不动杆菌属(Acinetobacter sp.)[9]、噬琼胶菌属(Agarivorans sp.)[10]和 类 芽孢杆菌属(Paenibacillus sp.)[11]等.
琼脂的降解产物琼寡糖和新琼寡糖在食品、保健品、水产养殖业、生物实验中的应用前景广泛,一方面使海藻具有免疫防御和诱导抗逆性的作用;另一方面使动物具有体内抗氧化、抗紫外线、提高保鲜度的作用,并改善人类肠道微生物菌群、促进益生元.探究琼胶降解菌发酵工艺、琼胶酶分离纯化方法,以及重组酶高表达载体构建是实现琼寡糖产业化的重点.本实验通过发酵、超滤浓缩、透析、凝胶柱层析对琼胶酶FG1进行分离纯化,并优化酶解反应条件,为日后高纯度琼胶酶的制备以及琼胶酶分子结构的研究和琼胶寡糖的大量制备奠定基础.
1 材料与方法
1.1 材料
(1)菌株.本实验室从海南陵水热带海洋环境中分离筛选出菌株FG1.
(2)培养基.X培养基(优化后的2216E海水培养基[12-14]):0.5%蛋白胨,0.1%酵母粉,0.1% K2HPO4·3H2O,0.05% KCl,0.05% MgSO4·7H2O,0.01% FeSO4·7H2O,0.5%~1.5%琼 胶,pH 7.21~7.25.121℃、20 min高温高压灭菌后待用.固体培养基中琼脂粉含量为1.2%.
(3)试剂与仪器.细菌基因组DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒购自中科瑞泰(北京)生物科技有限公司;质粒pMD19-T、感受态细胞DH5α购自大连宝生物有限公司;凝胶颗粒Sephadex G-100购自南京森贝伽生物科技有限公司;蛋白质电泳marker购自中科瑞泰(北京)生物科技有限公司;GL-802A型微型台式真空泵购自海门市其林贝尔仪器制造有限公司;HL-2恒流泵购自上海青浦沪西仪器厂;HD-3紫外检测仪购自上海和勤分析仪器有限公司.
1.2 FG1菌株粗酶液的制备
去适量活化后的菌株接种到含0.5%琼脂的X固体培养基(含链霉素)中,置于28℃的恒温震荡培养箱中发酵培养,转速150 r/min,36 h后收集发酵液,12 000 r/min、4℃离心15 min,弃沉淀,取上清.超滤浓缩并透析后得到粗酶液.吸取10µL粗酶液滴于琼脂(仅含1.5%琼脂,20 mmol/L Tris-HCl,pH 8.0)培养基表面,封口置于37℃恒温培养箱中反应3~5 h,用卢戈氏碘液染色,观察结果.若出现透明圈,则证明该酶液具有琼胶酶活力.
1.3 Native-PAGE电泳
分别制备Native-PAGE蛋白电泳胶与SDS-PAGE蛋白电泳胶,每组制备两块胶作为平行实验.点样后接上电泳仪,将电压调至80 V,待溴酚蓝移动至浓缩胶与分离胶的界限处,更改电压至120 V,直至溴酚蓝移出分离胶.将Native-PAGE分离胶切下,一块胶平铺于琼脂培养基(1.5%琼脂,20 mmol/L Tris-HCl,pH 8.0)上,置于37℃恒温培养箱中反应3~5 h,用卢戈氏碘液染色,观察结果.另一块胶用考马斯亮蓝染色,观察结果.
1.4 葡聚糖凝胶柱层析
本实验选用Sephadex G-100作为层析介质,根据柱型称取适量干粉浸泡于乙醇中,搅拌均匀放置24 h.再用倾泻法除去凝胶上层水及细小颗粒,用蒸馏水反复洗涤几次,再以缓冲液A洗涤2~3次,使用真空抽滤抽去溶液及凝胶颗粒内部气泡.之后装柱过夜沉降后加入FG1粗酶液并收集各组分.将收集到的组分同时进行Native-PAGE电泳与SDS-PAGE电泳后染色并脱色观察.
1.5 FG1粗酶液的酶活测定
(1)制作葡萄糖标准曲线.按照表1添加试剂,煮沸10 min,待冷却后加入4 mL双蒸水.用紫外分光光度计测定540 nm下的吸光度.
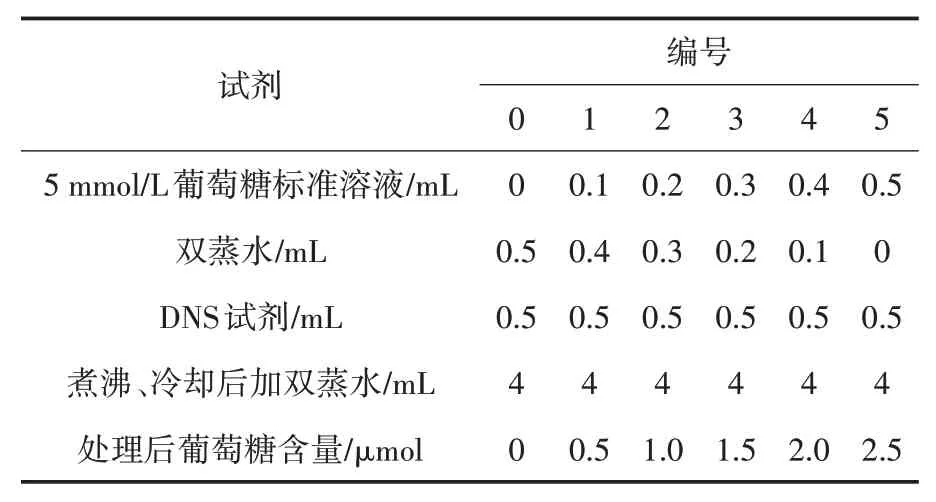
表1 葡萄糖标准曲线试剂表
(2)测定FG1粗酶液酶活.以反应产物还原糖的含量作为检测琼胶酶活力的指标.取100µL粗酶液至100 mL加热溶解的含0.3%琼脂20 mmol/L PBS缓冲体系(pH=7.4)培养基中,于37℃恒温震荡箱中反应10 min.10 000 r/min、4℃离心10 min.取0.5 mL上清液与0.5 mL DNS试剂混合,煮沸10 min,冷却后加入4 mL双蒸水,在540 nm波长下测其OD值,重复3次,以灭活酶液作对照.根据标准曲线计算还原糖含量.
相对酶活力(%):每一酶解反应影响因素下,各因素水平酶液的酶活力与最高反应因素水平酶液酶活力的百分比[12].
1.6 FG1琼胶酶的酶促反应条件优化
根据本实验前期研究,已知FG1琼胶酶酶促反应的最佳缓冲体系为20 mmol/L PBS缓冲液.本实验主要进行底物浓度、pH、温度三个影响因素的优化.酶液加样量均为1%.
(1)底物浓度对酶促反应的影响.将培养基中的琼脂浓度配制为:0.10%、0.15%、0.20%、0.25%、0.30%、0.35%、0.40%、0.45%.温度控制为37℃,pH控制为7.4.酶解反应30 min后测上清液中的酶活力.
(2)pH对酶促反应的影响.配制初始pH分别为:6.00、6.40、6.90、7.40、7.60、7.80、8.00、8.20、8.40、8.60,温度控制为37℃,底物浓度控制为0.3%.酶解反应30 min后测上清液中的酶活力.
(3)温度对酶促反应的影响.根据大多数琼胶酶反应温度的经验值设定温度梯度为:27℃、32℃、37℃、42℃、47℃、52℃、57℃,pH控制为7.4,底物浓度控制为0.3%.酶解反应30 min后测上清液中的酶活力.
(4)酶促反应条件的正交设计.单因素实验结束后,根据每个因素的最佳值设计三个水平,运用正交表进行实验,每组取三个重复值.
2 结果分析
本实验室前期对FG1菌株进行了16s rDNA鉴定,结果为vibrio.sp.其16s序列信息已收录于NCBI数据库中,编码为KU362877.
2.1 FG1菌株粗酶液制备及酶活检测
结果如图1所示,经染色后的反应体系中出现透明光圈,表明提取的粗酶液具有琼胶酶活性.

图1 琼胶酶的活性检测结果
2.2 粗酶液Native-PAGE电泳结果
将FG1粗酶液进行Native-PAGE电泳.电泳后,将分离胶切下,一块胶铺于琼胶培养基表面反应并用卢戈氏碘液染色,另一块胶用于考马斯亮蓝染色,染色结果如图2.由该图可知,在发酵液上清液经超滤浓缩、透析后获得的所有蛋白成分中含有3种琼胶酶,并且在染色后的琼胶薄膜中呈现出了比较明显的水解带.

图2 Native-PAGE与碘液染色结果
2.3 葡聚糖凝胶柱层析纯化结果
弃去一个柱床体积的洗脱液之后开始收集样品,根据紫外检测仪示数的变化分开收集每个不同示数的洗脱液,共收集45管洗脱液并进行活性测定,结果如图3所示.

图3 葡聚糖凝胶柱层析纯化产物活性检测结果
根据紫外检测结果可知,21号管之后无蛋白峰存在,45管洗脱液从1号到45号分成3组,1~9号为一组、10~18号为一组、21号与后续27号、33号、39号为一 组,分别滴加到3个琼脂培养基上反应,210 min后卢戈氏碘液染色.结果表明,从第2号收集管到21号收集管均检测到琼胶酶活性.
紫外检测仪检测到两个峰值,故可推测FG1琼胶酶粗酶液中至少含有两种琼胶酶,命名为酶组分A和酶组分B.
对酶组分A和酶组分B进行SDS-PAGE电泳后,结果如图4所示,酶组分B纯化效果较酶组分A明显.对比酶组分A与酶组分B的相对迁移距离与蛋白质marker的相对迁移距离,计算得到两个组分中三种琼胶酶的分子量为:53.45 kD、46.85 kD、42.50 kD.

图4 SDS-PAGE结果
将两种酶液分别进行Native-PAGE电泳,结果如图5所示.酶组分A中存在两个分子量非常接近的琼胶酶,酶组分B中只含一种琼胶酶.

图5 各组分Native-PAGE与碘液染色结果
2.4 FG1琼胶酶B的活力测定结果
取100µL粗酶液B加入到100 mL加热溶解的琼脂培养基中,置于37℃震荡培养30 min,测定其上清液OD值为0.421,计算得到其酶活为25.94 U/mL.在同样条件下,组分B稀释10倍,测组分B反应上清液OD值为0.325,计算得到其酶活为198.48 U/mL,纯化了7.65倍,如图6所示.
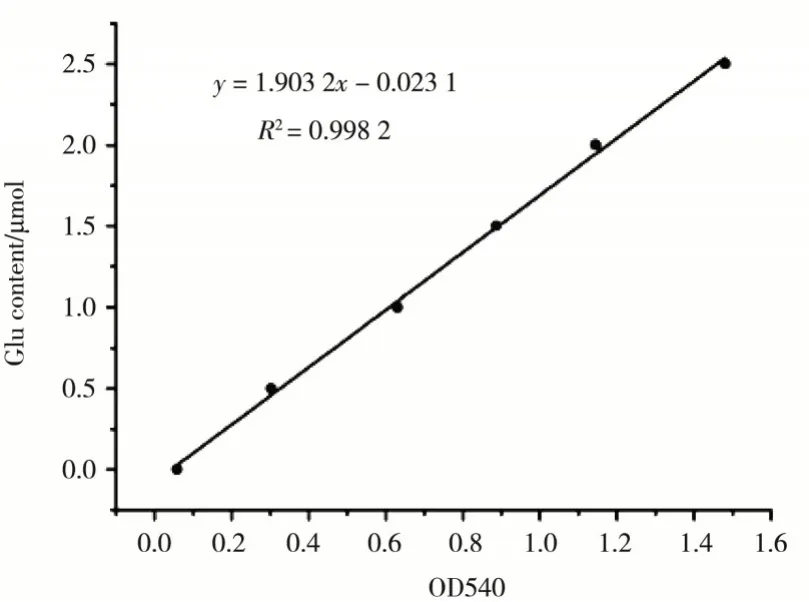
图6 葡萄糖标准曲线
2.5 FG1琼胶酶B的酶促反应条件优化
由图7可以看出在单因素条件下,FG1琼胶酶B的最适条件分别为温度32℃、pH 6.9、底物浓度0.35%.分别对温度、pH、底物浓度单因素实验结果分析,利用3因素3水平正交表设计9个实验组(表2),每组重复3次,进行酶活测定,计算相对酶活力.正交试验后,这3个因素的最佳组合为温度37℃、pH 6.4、底物浓度0.35%,酶活力319.23 U/mL,提高了1.61倍.


图7 各单因素条件对酶活力的影响
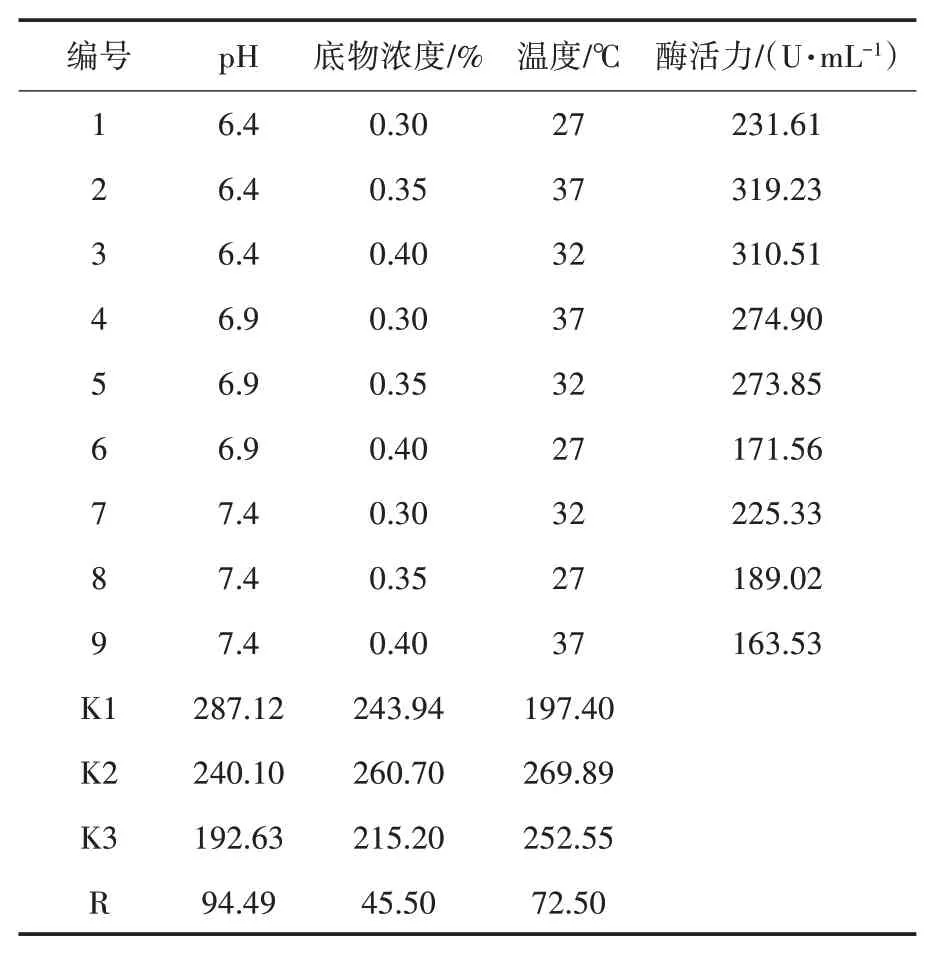
表2 正交设计实验数据表
本实验同时利用Design-Expert 8.0软件进行响应面分析,绘制了响应面分析图及其对应的等高线图,如图8所示,可直观地看出各因素之间交互作用的强弱,预测最佳条件为:温度38.21℃、pH 7.05、底物浓度0.45%.在随后的验证实验中发现,该组条件下的酶活力为312.43 U/mL,略小于正交实验结果,故最终采取正交实验所得优化后条件.

图8 响应面及等高线图
3 讨论
本实验研究材料为FG1琼胶酶,根据先前的实验[13-14]得知,此类琼胶酶为胞外酶,发酵上清液中的杂蛋白相对菌体抽提液较少.通过葡聚糖凝胶柱层析将FG1琼胶酶分成了酶组分A和酶组分B,电泳结果显示,酶组分A仍含有两种琼胶酶,分子量分别为53.45 kD和46.85 kD,没有达到理想的纯化效果,因此还需对FG1琼胶酶组分A进行进一步纯化;在对FG1琼胶酶组分B进行单因素酶促反应实验时发现其有噬酸倾向,遂进行了补加初始pH 4.2~pH 5.8条件组,配置培养基时发现以琼胶为唯一碳源的培养基均发生了不同程度的液化现象,在初始pH为5.8的条件下,培养基液化现象基本不明显,测得酶活小于初始pH为6.0时的酶活,固初步判断单因素条件下其最适pH为6.9左右,轻微噬酸.
本实验利用琼胶降解菌株FG1分离纯化获得了分子量大小分别为53.45 kD、46.85 kD和42.50 kD三种琼胶酶.根据以往研究报道,同一种菌株可产生两种分子量不同的琼胶酶.朱启忠等从海洋细菌NBRC 102603中得到两种分子量不同的琼胶酶[15]、解卉等从海洋细菌QM38中得到两种分子量不同的琼胶酶[16].少量研究发现从同一菌株中得到三种及以上分子量不同的琼胶酶,本实验研究结果也进一步验证了琼胶酶的多样性.
4 结论
本实验通过葡聚糖凝胶柱层析将FG1琼胶酶分成了酶组分A和酶组分B,电泳结果显示,酶组分A仍含有两种琼胶酶,分子量分别为53.45 kD和46.85 kD,没有达到理想的纯化效果,酶组分B只含有一种琼胶酶,分子量为42.50 kD,纯化效果更好.经超滤浓缩、葡聚糖凝胶柱层析,组分B纯化了7.65倍.
同时,本实验还探究了温度、pH、底物浓度对较单一组分琼胶酶B酶促反应的影响.最适反应温度为37℃,与目前发现的大多数琼胶酶相似.最适初始pH为6.9,偏酸性,低于大多数琼胶酶pH范围,当pH超过8.6,几乎不能降解琼脂.最适底物浓度为0.35%,偏向于半固态琼脂.正交试验后,这三个因素的最佳组合为:温度37℃、pH 6.4、底物浓度0.35%,酶活力提高到1.61倍.但是相较于本实验室保存的其他琼胶降解菌的琼胶酶,本实验琼胶酶酶活依旧偏低,因此还有待于对FG1所产琼胶酶组分进一步分离纯化,为琼胶酶的分离纯化以及实现工业化生产奠定基础.
