重度抑郁症发病机制关键基因和信号通路的生物信息学分析
2021-12-07杨文山王一晨
杨文山,王一晨,刘 屏,胡 园
(1. 中国人民解放军总医院医疗保障中心药剂科,北京 100853;2. 解放军医学院,北京 100853;3. 82 集团军医院门诊部,河北 保定 071000)
重度抑郁症是一种严重威胁全世界人民身心健康的精神类疾病,其主要特征是情绪低落并伴有疲劳、注意力不集中、睡眠障碍和语言障碍的精神障碍综合征[1]. 尽管人们对重度抑郁症进行了广泛深入的研究,重度抑郁症的发病机制已经取得了十分显著的进展,例如科学家发现单胺类特别是5-羟色胺的缺乏是重度抑郁症的重要发病机制之一[2]。然而越来越多的研究表明,单胺类神经递质的改变不足以解释重度抑郁症的全部发病机制,目前的治疗方案对某些抑郁症患者疗效有限甚至是无效。
重度抑郁症潜在的发病机制中,突触可塑性、表观遗传学和免疫系统起着十分重要的作用。进一步研究重度抑郁症发病机制的分子机制和信号通路,发现重度抑郁症新的诊断和治疗策略,仍极为重要的。幸运的是,随着高通量测序技术的发展,已发现新的核心基因和信号通路与重度抑郁症的发生和进展相关。例如,Jollant 等[3]使用外周血转录组学阐明了5-羟色胺和nociceptin 系统与抑郁症的活动相关。 Hepgul 等[4]则通过外周血转录组学分析发现抑郁症与IFN-α 分子机制相关的多条证据。 Wang 等[5]通过分析mRNA 的表达谱发现NFκB 信号通路在重度抑郁症的发作和发展中起重要作用。 Carboni 等[6]发现大脑海马转录因子在抑郁症患者和具有抑郁症症状的动物模型中生长因子信号传导和炎症反应均存在失调现象。 因此,研究重度抑郁症的关键基因和信号通路,阐明关键基因和信号通路之间的相互作用网络,是进一步阐明重度抑郁症发病机制的基础。为此,本研究旨在通过运用生物信息学方法分析建立关键基因和信号通路作为重度抑郁症的生物标志物。
1 材料与方法
1.1 数据的获取与差异基因的筛选.
从美国国家生物技术信息中心网站GEO 公共数据库下载重度抑郁症脑皮质基因表达谱数据GSE101521(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE101521)[7]。此 数 据 是 基于Illumina MiSeq 人类平台GPL15520 的基因表达数据信息。该数据集包括:猝死的非精神病个体中收集的29 个大脑背外侧前额叶皮层样本和重度抑郁症死亡患者中收集的30 个大脑背外侧前额叶皮层样本。本研究将GSE101521 数据集分为两组,即正常组和重度抑郁症组,并提取数据。 从GSE101521 数据集中选取的counts 数据通过edgeR 在networkanalyst(https://www.networkanalyst.ca/)进行标准化,并利用networkanalyst 筛选正常组和重度抑郁症组之间存在差异的基因。筛选标准设置如下:| log2Fold Change(FC)| >1 并且校正后P值<0.05。
1.2 Gene Ontology(GO)基因功能注释和KEGG信号通路富集分析
使 用 Database for Annotation,Visualization and Integrated Discovery(DAVID)在 线 数 据 库(https://DAVID.ncifcrf.gov/)进行Gene Ontology(GO)基因功能注释富集分析[8,9]。富集分析从生物过 程(biological process,BP),细 胞 成 分(cellular components,CC)和 分 子 功 能(molecular function,MF)三方面进行。此外,使用KOBAS 在线数据库对KEGG 信号通路进行分析(http://kobas.cbi.pku.edu.cn/kobas3)[10],筛 选 标 准 设 置 为P 值<0.05。KEGG 是一个在已知生物过程中整合了基因,化合物和调控网络的数据库,并在整体水平分析了基因功能和基因组。
1.3 蛋白-蛋白互作网络(Protein-protein interaction,PPI)分析
使 用STRING 11.0 在 线 软 件(https://stringdb.org/)[11]进 行 差 异 基 因 的PPI 分 析,采 用Cytoscape 3.7.2[12]对结果进行可视化处理。使用Cytoscape 软件的MCODE 插件筛选PPI 关键模块,Cytoscape 的cytohubba 插件筛选PPI 关键基因。关键模块的筛选标准设置如下:Degree cut-off=2,node score cut-off=0.2,k-core=2 和max. depth =100;关键基因的筛选标准设置为degree >10。对得分最高的关键模块中的差异基因再次进行GO 功能注释富集分析和KEGG 信号通路分析。
2 结果
2.1 差异基因的筛选
根据 校正后P值<0.05 和|log2(FC)|>1 的筛选标准,共筛选出41 个正常组和重度抑郁症组间见有显著差异的基因,其中39 个差异基因上调,2 个差异基因下调,见图1、表1。

表1 正常组和重度抑郁组之间差异表达基因Tab 1 Genes showing significant expressions between the normal and MDD groups.
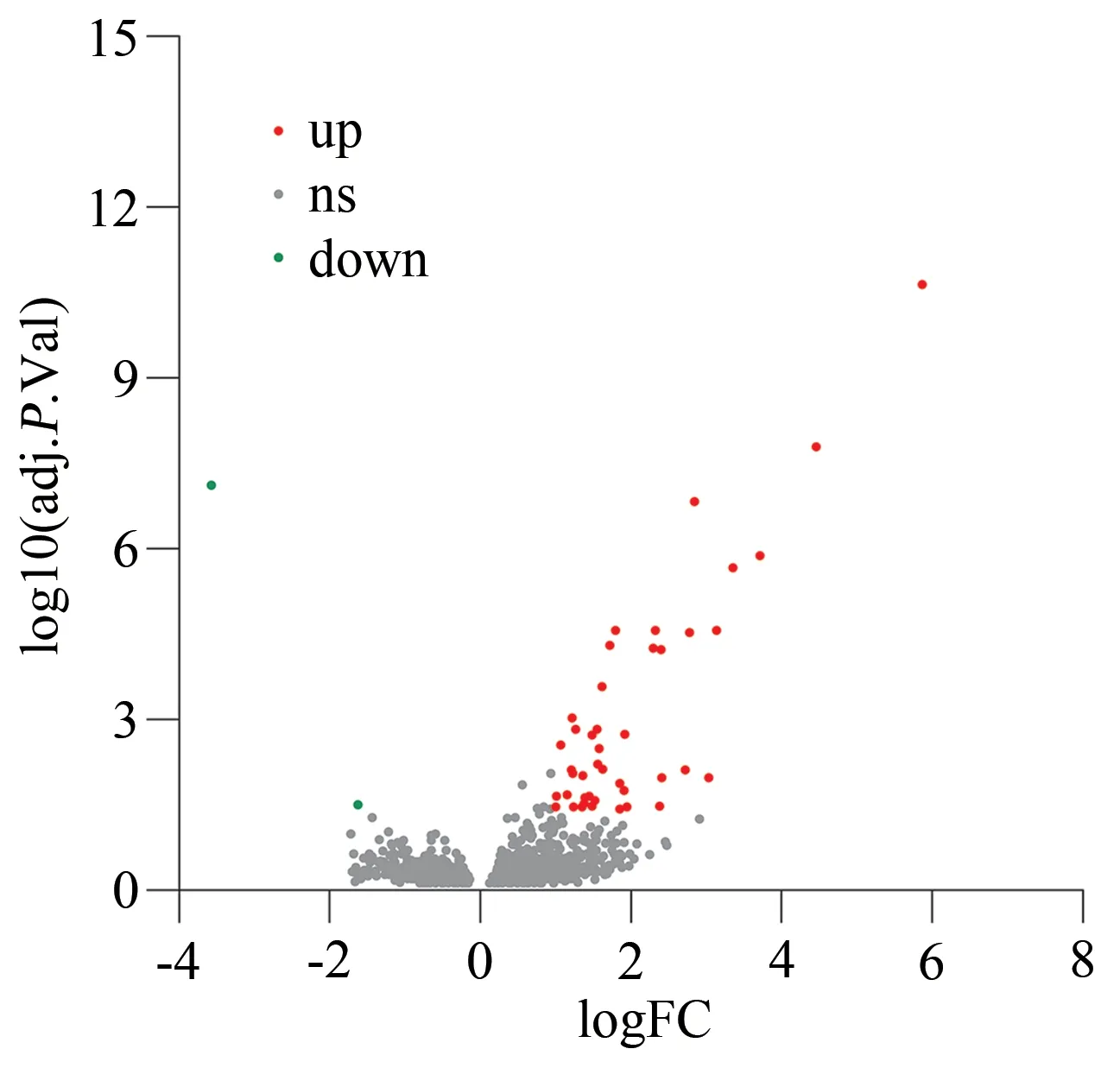
图1 差异表达基因火山图Fig 1 Volcano plot of genes with different expressions
2.2 GO 功能注释富集分析和KEGG 信号通路富集分析结果
使用DAVID 在线数据库对41 个显著差异基因进行GO 功能注释富集分析。在生物过程(BP)方面,差异基因主要富集在炎性反应,血管生成的阳性调节和细胞对热的反应,见图2A。在细胞成分(CC)方面,差异基因主要富集在细胞外间隙,细胞外基质和胞液,见图2B。在分子功能(MF)方面,差异基因主要富集在未折叠蛋白结合和热休克蛋白结合,见图2C。KEGG 信号通路富集分析结果显示,显著差异基因主要富集在IL-17 信号通路,军团菌病和麻疹,见图2D。GO 功能注释富集分析和KEGG 信号通路富集分析结果显示,与抑郁最相关的生物学功能是炎症反应。
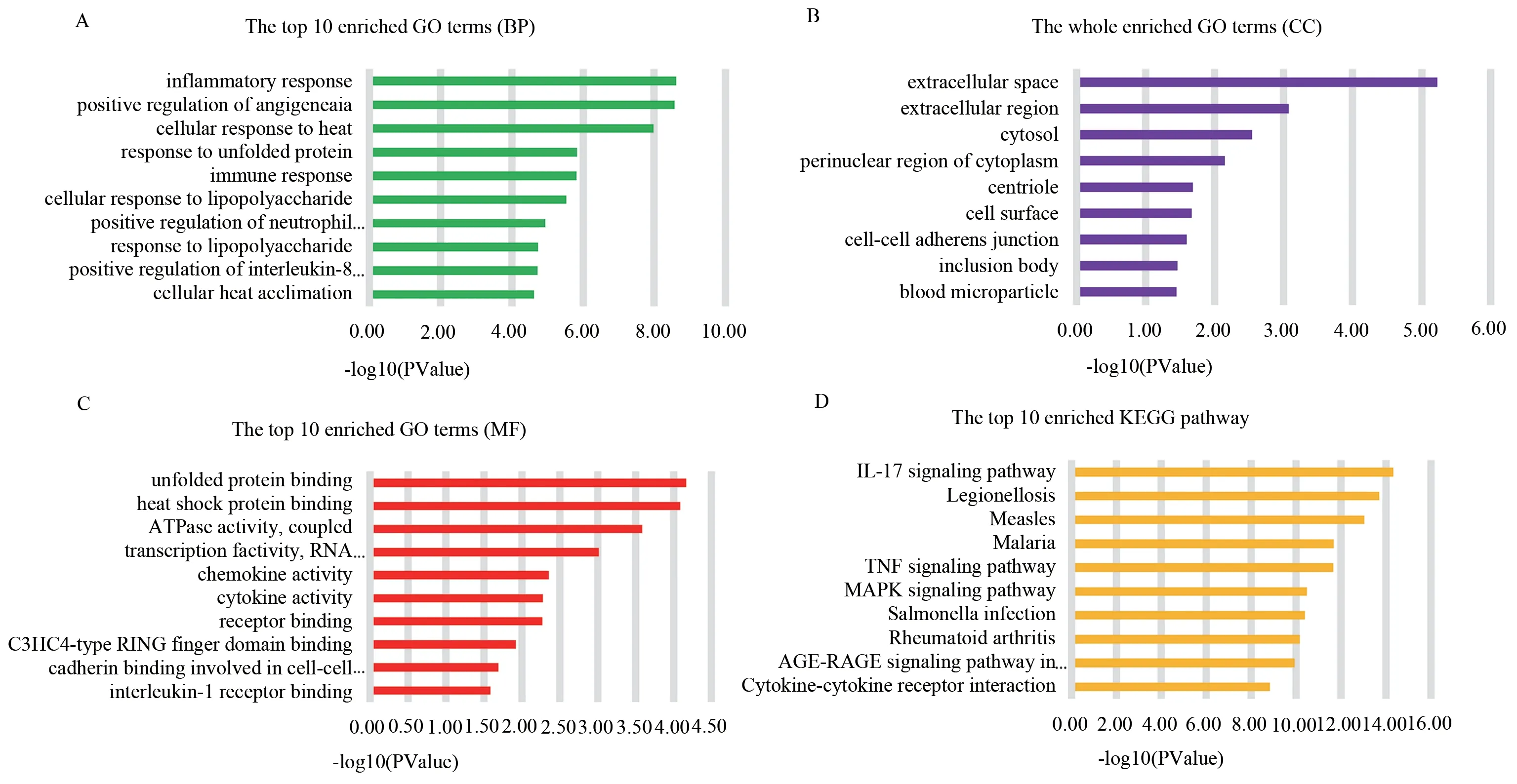
图2 差异表达基因GO 功能注释富集分析和KEGG 信号通路分析Fig 2 GO and KEGG enrichment analyses of DEGs
2.3 蛋白-蛋白互作网络(Protein-protein interaction,PPI)分析
为了筛选出了与重度抑郁症最为相关的差异基因,本研究使用STRING 11.0 在线数据库进行PPI 分析,将41 个差异基因映射到PPI 中,共包含28个节点和108 条线,见图3A。PPI 分析结果显示,28 个差异基因对抑郁症的发病机制有影响。应用Cytoscape 软件中的MCODE 插件筛选出了PPI 中3个群集。其中,集群1 得分最高(分数= 8.222),包含10 个 节 点(FOS、SELE、ATF3、CXCL8、TNFAIP3、IL-6、IL-1B、C5AR1、CCL2、CXCL2)和37条连接线,见图3B;群集2 包含4 个节点和6 条连接线(分数= 4.000),见图3C;群集3 包含3 个节点和3 条连接线(得分= 3.000)(图3D)。
在 群 集1 中,Cytoscape 软 件 的cytohubba 插 件将6 个基因(IL-6、CXCL8、IL-1B、FOS、CCL2、CXCL2)筛选为关键基因(degree>10)。对得分最高的集群1 中的显著差异基因进行GO 功能注释富集分析和KEGG 信号通路富集分析。 结果显示,对于GO 功能注释富集分析,群集1 的差异基因大部分在炎症反应和免疫反应中富集,见图4A。KEGG 信号通路富集分析表明,群集1 的差异基因主要富集在IL-17 信号转导通路,TNF 信号通路和NOD 样受体信号通路。全部6 个关键基因(CCL2、CXCL2、FOS、CXCL8、IL-6和IL-1B)都被定位在IL-17 信号通路上,5 个关键基因(CXCL2、CCL2、IL-1B、FOS、IL-6)被定位在TNF 信号上通路,见图4B。此外,还筛选出了5 个关键基因(CCL2、CXCL2、CXCL8、IL-6和IL-1B)与群集1 中的NOD 样受体信号通路相关。
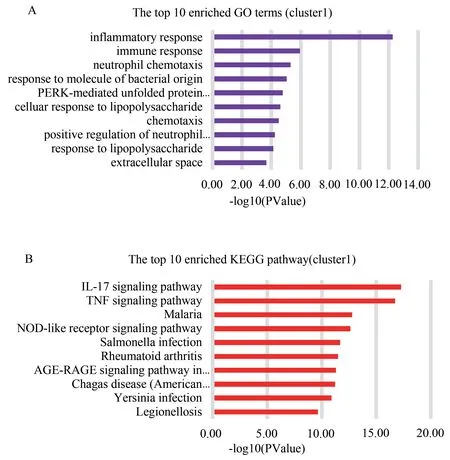
图4 集群1 的GO 功能和KEGG 信号通路富集分析Fig 4 GO and KEGG enrichment analyses of cluster 1
3 讨论
本研究筛选出了41 个显著差异基因,进行了PPI 分析和模块分析,筛选出了关键基因(IL-6、CXCL8、IL-1B、FOS、CCL2、CXCL2),KEGG 信号通路分析结果表明,与重度抑郁症相关的最主要信号通路是IL-17 信号通路,TNF 信号通路和NOD 样受体信号通路。本研究确定了可能参与重度抑郁症发病机制的免疫系统新的标志物和靶标。
随着高通量测序技术的发展,转录组学和下一代测序技术已经产生了大量的数据集,包括lncRNA、miRNA 和mRNA 表达谱。许多研究者通过使用生物信息学技术,筛选出大量核心基因和信号通路来预测重度抑郁症潜在的发病机制。与其他文献不同的是,本研究从GEO 公共数据库获得了重度抑郁症患者脑皮质转录组表达谱的数据集(GSE101521),并应用生物信息学分析筛选出了与重度抑郁症最为相关的新的关键基因和信号通路。本研究利用DAVID 在线数据库和KOBAS 在线数据库进行GO 功能注释富集分析和KEGG 信号通路富集分析。DAVID 对显著差异基因进行GO 富集功能注释的结果以及KEGG 信号通路富集分析结果表明,与重度抑郁症患者发病机制最为相关的关键功能标志是炎症反应。差异基因GO 功能注释富集分析主要与生物过程有关,包括炎症反应,血管生成的正调节,细胞对热的反应,对未折叠蛋白的反应,免疫反应,细胞对脂多糖的反应等。
此外,本研究发现,显著差异表达基因富集到与重度抑郁症相关的KEGG 信号通路是IL-17 信号通路,TNF 信号通路和NOD 样受体信号通路。本研究部分结果与之前的研究结果一致,表明免疫和炎性反应是与重度抑郁症发病机制最为相关的生物学反应系统[13-15]。脑中炎性因子和炎症激活的增加在重度抑郁症的发病机制中起着十分重要的作用[16]。一些组学研究还表明了IL-17 信号通路和TNF 信 号 通 路 与 抑 郁 症 有 关[17,18]。TNF-α 通 过NF-κB 信号通路和促炎性细胞因子调节小胶质细胞的活化,在神经炎症中起关键作用[19]。IL-17 信号触发细胞因子和趋化因子进而激活NF-κB 信号通路[20],抑制IL-17 细胞因子家族可能对中枢神经系统的致病条件有益[21,22]。NF-κB 信号级联反应也可以激活NOD 样受体[23],NOD 样受体炎性体的活化和激活导致人类巨噬细胞随后释放IL-1B[24]. 因此,结合文献和本研究结果,笔者推测,NF-κB 信号级联和NOD 样受体信号的激活可能引起IL-17 信号和TNF 信号失调,并导致包括释放细胞因子和趋化因子(IL-1B、IL-6、CCL2、CXCL2)在内的一系列的免疫炎症反应,这在重度抑郁症的发病机制中至关重要
本研究结果表明,通过IL-17 信号通路,TNF 信号通路和NOD 样受体信号通路激活了参与重度抑郁症发病机制中的关键基因(IL-6、CXCL8、IL-1B、FOS、CCL2、CXCL2),表明这些新的标志物和靶标参与了重度抑郁症的免疫炎症发病机制。不过,确切结论仍需实验研究验证。
