腹腔镜与内镜逆行胰胆管造影在二次胆道手术中的应用
2021-12-07王方平
石 余,王方平
(新昌县人民医院肝胆外科,浙江 绍兴,312500)
胆总管结石是临床常见病。据估计,20%有症状的胆石症患者合并胆总管结石[1]。由于胆道结石复发率较高[2],胆道探查后复发胆总管结石的治疗仍在讨论中,内科医生更倾向于通过内镜逆行胰胆管造影(endoscopic retrograde cholangiopancreatography,ERCP)的方式治疗,而外科医生则更倾向于腹腔镜胆总管探查(laparoscopic common bile duct exploration,LCBDE)二次胆道手术[3]。ERCP有时不能插管或插管成功后无法取石,这种情况尤其容易发生在十二指肠乳头及周围解剖异常或胆总管下段的嵌顿结石[4]。对于ERCP失败的患者,有的研究者赞成再次行ERCP治疗,即ERCP手术失败后延迟再次行ERCP取石;有的研究者则更愿意ERCP失败后选择LCBDE[5]。对于ERCP无法取石的患者可选择放置鼻胆管后行LCBDE一期缝合胆管,无需再放置T管[6]。反复的内镜下操作会导致十二指肠乳头、胆总管局部炎症与纤维化增加,ERCP失败后同期行LCBDE,由于局部炎症变化,手术可能在技术上具有挑战性。目前国内关于ERCP失败后同期行LCBDE的相关研究很少。因此,本研究的目的是比较未行ERCP的LCBDE与ERCP失败后再行LCBDE的安全性及临床疗效。回顾分析分别采用LCBDE及ERCP失败后同期行LCBDE治疗的62例二次胆道手术患者的临床资料,将体会报道如下。
1 资料与方法
1.1 临床资料 回顾分析2016年1月至2020年1月为62例胆总管结石患者行LCBDE二次胆道手术的临床资料,向患者告知LCBDE与ERCP的优缺点,由患者自行选择治疗方案。其中ERCP失败后同期行LCBDE的26例患者为观察组,直接行LCBDE的36例患者作为对照组。入组标准:(1)术前确诊为复发性胆总管结石;(2)有胆道探查手术史。排除标准:(1)计划性开腹手术;(2)合并严重心脑肺疾病;(3)合并胆源性胰腺炎;(4)有除胆道探查外的其他上腹部手术史;(5)合并胆道肿瘤。收集人口统计学数据、美国麻醉医师协会(American society of anesthesiologists,ASA)分级与术前临床资料。
1.2 手术方法 观察组:行ERCP治疗,术前患者禁食6 h,禁饮2 h,麻醉成功后取左侧卧位。十二指肠镜经口腔、食管、胃送至十二指肠降部,通过横行皱褶与纵行皱褶标志找到十二指肠乳头,观察十二指肠乳头周围是否存在解剖变异、十二指肠乳头旁憩室病变,应用拉式切开刀在导丝配合下选择性插管,若插入胰管,可选择“预切开法”或“双导丝法”进行胆道插管。若插管失败,同期行LCBDE。插管成功后,排气造影,确定胆总管结石的位置与大小,再次确认是否合并胆道肿瘤,明确后行内镜下乳头括约肌切开取石术:应用拉式切开刀沿胆道方向切开乳头,根据结石大小,必要时应用扩张球囊扩张胆道下段后,取出胆道结石,若结石较大,可用碎石网篮碎石后取出,若结石较多、较大、较硬,无法取出、需多次取出或取石风险较大,则仅放置鼻胆管,结束ERCP后同期行LCBDE取石后一期缝合。对照组:直接行LCBDE,术前禁食6 h,禁饮2 h,不常规放置胃管、尿管,采用静吸复合插管全麻,麻醉成功后,患者取头高脚低位,左倾15°。采用标准四孔法施术。脐周距原手术切口至少3 cm穿刺10 mm Trocar,或Hasson法直视下切开腹膜后置入Trocar与腹腔镜作为观察孔,观察腹腔内粘连情况。沿外周向肝下方向通过锐性、钝性分离法分离腹腔内粘连,沿原T管窦道向胆道方向找寻胆总管,也可通过原胆总管缝线、胆囊管缝线、Hem-o-lok夹在十二指肠球部上方寻找胆总管,最终穿刺证实为胆总管。根据结石大小纵向切开胆总管,用胆道镜取石网篮取出结石,若结石嵌顿,应用液电碎石仪碎石后取出,再次探查无结石残留后,如果患者有鼻胆管引流,在此阶段应用“4-0”PDS缝线连续或间断缝合胆总管切开处,一期关闭胆管。如果存在组织水肿、纤维化、十二指肠乳头水肿等可能增加术后胆漏的情况,可使用缓慢吸收的可吸收缝线间断缝合修复胆总管切口,并在胆总管内插入T形引流管。最后取出结石,检查创面无活动性出血及胆漏后,放置网膜孔引流管,结束手术。
1.3 观察与评价指标 主要结果:胆总管结石清除率、术中出血量、中转开腹率、术后并发症发生率、术后通气时间、住院时间,其中术后30 d内发生的并发症被考虑在内。次要结果为手术时间、住院费用。

2 结 果
2.1 两组临床资料的比较 观察组患者ERCP失败后同期行LCBDE。ERCP失败的原因主要为结石嵌顿8例,多发、巨大胆总管结石9例,胆道下端狭窄3例,Mirizzi综合征1例,胆总管囊性扩张症1例,十二指肠乳头旁(内)憩室4例。两组患者年龄、性别、体重指数、ASA分级、结石直径、血清碱性磷酸酶、总胆红素差异无统计学意义(P>0.05),观察组结石数量明显多于对照组,差异有统计学意义(P<0.05),见表1。
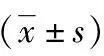
表1 两组患者临床资料的比较
2.2 两组术中及术后结果的比较 两组手术均顺利完成,无术中、术后30 d内死亡病例。观察组手术时间、住院费用高于对照组,差异有统计学意义(P<0.05)。两组胆总管结石清除率、术中出血量、中转开腹率、术后并发症发生率、术后通气时间、住院时间差异无统计学意义(P>0.05),见表2。观察组ERCP插管失败,同期行LCBDE+T管引流10例;ERCP插管成功,取石失败,同期行LCBDE一期缝合16例。对照组均行LCBDE+T管引流术。对照组残余结石患者均通过ERCP取石治愈。观察组术后发生切口感染1例,换药后治愈;发生胰腺炎1例,按胰腺炎治疗指南治愈;胆漏1例,经皮经肝胆管穿刺引流后治愈。对照组发生切口感染1例,换药后治愈;肺部感染2例,痰培养应用敏感抗生素治愈;胆漏2例,经ERCP放置胆道支架治愈。
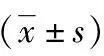
表2 两组患者术中及术后结果的比较
3 讨 论
胆总管结石是临床常见病,具有较高的复发率,目前对于复发性胆总管结石,多数医生倾向于行ERCP治疗,ERCP应用广泛,患者创伤小,耐受性好,胆总管结石清除率高[7],但ERCP也存在取石失败,并发十二指肠乳头切开处出血、穿孔,急性胰腺炎,胆道感染等风险。Andriulli等的回顾报道显示,ERCP术后胰腺炎发生率为3.5%(重症占11.4%),胆道感染发生率为1.4%(重症占19.8%),出血为1.3%(重症占29.2%),十二指肠穿孔为0.6%(重症占47.3%),死亡率为0.3%[8]。对于有胆道探查手术史的患者,腹腔内粘连牵拉,造成十二指肠解剖扭曲,胆道方向异常扭曲,使ERCP成功率降至62%~71%[9]。ERCP取石失败的其他原因还包括十二指肠乳头旁憩室、结石嵌顿、结石较多较大。十二指肠憩室主要发生在80岁以上的人群,在这种情况下,ERCP的成功率为78%[9]。此外,如果十二指肠乳头位于憩室内,则成功率仅为38%[10]。其他解剖因素还包括胆道下端狭窄、Mirizzi综合征、胆总管囊性扩张症(其潜在诱因是胆胰合流异常)等,都是ERCP失败的潜在原因,胆总管插管率甚至可低至8.3%[11]。
困难插管、多次插管失败均增加ERCP术后胰腺炎或十二指肠穿孔的风险[12]。ERCP失败后,提倡直接行LCBDE,关于时机问题,我们认为ERCP反复插管失败后,乳头炎症、水肿更加严重,胆道内压力进一步增加,同期行LCBDE治疗可降低胆道压力,将感染的胆汁排出体外,降低ERCP术后胆管炎、胰腺炎等并发症发生率。同时因为同期行LCBDE,并不增加胆管炎及胆道内鼻胆管或支架引起的胆道炎症粘连,因此得到了两组中转开腹率相当的结果。此技术的另一个优点是可缩短住院时间、降低住院费用。但从另一个方面而言,ERCP失败后再选择LCBDE治疗必然增加了总的手术时间与住院费用,因此如果预期ERCP失败或ERCP术后并发症风险较高,LCBDE二次胆道手术应被视为复发性胆总管结石的一线治疗。
文献中,ERCP失败后的LCBDE与直接行LCBDE二次胆道探查在技术上均更具挑战性。两组术后并发症发生率差异无统计学意义,Karaliotas等的研究也证明了同样的结果[13]。当然,LCBDE二次胆道手术需要特殊的手术设备及具备丰富腹腔镜胆道手术经验的外科医生。不具备以上两个因素的外科医生在ERCP失败后并不一定会同期LCBDE手术中获益。众所周知,ERCP取石失败,但放置了鼻胆管的患者,可在LCBDE后一期缝合胆管,并降低术后胆漏的风险,也并不增加住院时间。
研究结果表明,ERCP失败后同期行LCBDE是安全、有效的。然而,与从未接受过ERCP的患者相比,手术时间更长,住院费用更高。尽管采用ERCP失败后同期行LCBDE或直接选择LCBDE的方法取决于可用的设备与技能,但必须仔细选择患者以进行最适当的治疗。当预测到ERCP失败风险性较高或术后并发症风险较高时,LCBDE二次胆道手术应被视为复发性胆总管结石的一线治疗方法。这是一项回顾性研究,并且样本量较小,限制了本研究的结论,因此需要大样本、多中心的前瞻性研究得出更明确的结论。
